凋亡在原发性肺损伤中的变化
2016-02-14颖张文胜苏惠斌王
叶 颖张文胜苏惠斌王 乐,3*
(1 苏州大学剑桥-苏大基因组资源中心,江苏 苏州 215123;2 苏州市立医院东区麻醉科,江苏 苏州 215000;3 苏州大学医学部,江苏 苏州 215123)
凋亡在原发性肺损伤中的变化
叶 颖1张文胜1苏惠斌2王 乐2,3*
(1 苏州大学剑桥-苏大基因组资源中心,江苏 苏州 215123;2 苏州市立医院东区麻醉科,江苏 苏州 215000;3 苏州大学医学部,江苏 苏州 215123)
目的气管滴注法构建脂多糖(LPS)引起的大鼠原发性急性肺损伤(acute lung injury,ALI)模型,研究肺组织细胞凋亡的时间变化。方法30只雄性SD大鼠随机均分为5组:对照组,LPS(1、6、12和24 h)组。LPS组气管内滴注LPS,5 mg/kg,正常对照组气管内注入等量生理盐水。于1 h、6 h、12 h和24 h后处死,取肺组织,行苏木精-伊红(HE)染色,观察病理变化;测定肺湿重/干重(W/D)比值;TUNEL(terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling)法,检测细胞凋亡;蛋白免疫印迹法(Western blot)检测凋亡蛋白cleaved-capase3的表达水平。结果HE染色可见,LPS滴注后肺泡间隔增宽、间质充血水肿、肺泡腔变窄、炎性细胞渗出及小气道损伤随着时间增加呈现趋势性变化。LPS组肺W/D比对照组明显增加。TUNEL法检测发现,1 h、6 h、12 h和24 h实验组肺组织细胞凋亡指数(apoptosis index,AI)较对照组明显升高,且1~12 h内AI值随时间增加而增加,其中12 h AI值最高,24 h时间点AI有所下降。对照组AI低于实验组(P<0.01)。Western blot发现,在1 h、6 h、12 h和24 h实验组cleaved-caspase-3含量较对照组明显升高,且1~12 h内随时间增加而增加,其中12 h最高,24 h有所下降。对照组cleaved-caspase-3含量低于实验组(P<0.01)。结论LPS导致大鼠原发性肺损伤随着时间的推移而逐渐加重,大鼠肺组织细胞大量凋亡,其凋亡程度对时间的延长呈现一先升后降的过程。
急性肺损伤;内毒素;凋亡;时程变化
急性肺损伤(acute lung injury,ALI)是各种直接或间接因素导致的肺泡上皮细胞和毛细血管内皮细胞损伤,导致急性低氧性呼吸功能不全[1]。ALI发病机制尚未完全明确,是近年来研究的重点[2]。肺性的ALI是病因对肺泡细胞的直接损伤效应,又称为原发性肺损伤。直接和间接ALI肺内外器官损伤表现,发病程度,进程,致死率以及治疗均有所差别,LPS致急性肺损伤进展快,发展至严重阶段称为急性呼吸窘迫综合征,如不及时干预,致死率极高[3]。关于肺组织细胞在ALI发病进程的研究并不多见,本研究采用气管内直接滴注LPS的方法建立原发性肺损伤,旨在观察原发性肺损伤时肺组织的凋亡情况以及凋亡时程变化,为进一步探讨原发性肺损伤发病机制以及早期干预时机提供实验依据。
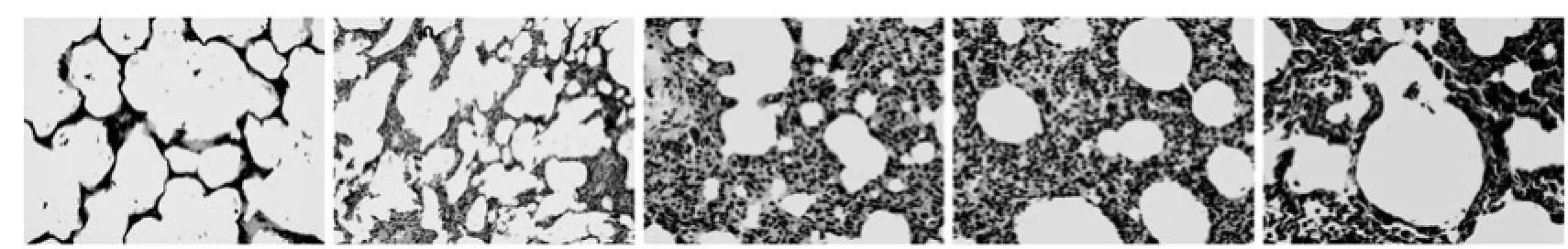
图1 苏木精-伊红染色检测肺组织病理变化(放大倍数×400)
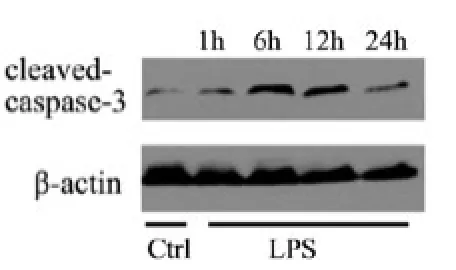
图2 蛋白印记检测Cleavedcaspase-3在肺组织中的表达水平*P<0.05 vs.对照组
1 资料与方法
1.1 实验动物及分组:健康雄性SD大鼠(苏州大学实验动物中心)30只,体质量250~280 g,随机分为对照组、LPS处理1 h、6 h、12 h、24 h组(每组6只)。5组动物均腹腔注射1%戊巴比妥钠40 mg/kg麻醉后做颈部正中切口,暴露气管,将LPS用1 mL注射器注入气管,制备ALI模型,对照组注射等量生理盐水,注射LPS后分别于1 h、6 h、12 h、24 h经颈动脉放血处死动物,剖胸取肺。
1.2 肺组织病理学观察:取右肺下叶组织,10%甲醛固定后用石蜡包埋切片,片厚5 μm,HE染色,光镜观察肺组织形态。
1.3 肺水含量测定:取右肺中叶,吸水纸吸干表面水分及血液,称量肺湿重。置于80 ℃烤箱72 h后,称量肺干重,计算W/D。
1.4 TUNEL法肺组织细胞凋亡:步骤如TUNEL分析试剂盒说明。AI的计算方法:每个标本取2张切片,每张切片选择4个具有代表性的视野(×400),计数500个细胞中明显的TUNEL染色阳性细胞数并计算AI。AI=凋亡细胞数/细胞总数×100%。
1.5 蛋白免疫印迹:注射LPS后,开胸取出左肺下叶,迅速冻存于液氮中。用BCA法测定蛋白浓度。等量蛋白样品经10%SDS-聚丙烯酰胺凝胶电泳分离后,以半干转法电转移至硝酸纤维素膜上。室温封闭3 h后,加入一抗:抗cleaved-capase-3抗体(1∶800)4 ℃过夜。洗膜3遍后用相应的碱性磷酸酶标记的二抗室温孵育2 h,最后用ECL显色。
2 结 果
2.1 肺组织光镜检测:正常对照组肺泡结构完整,肺泡腔内清晰,胞壁光滑,肺泡腔及间质内无渗出;LPS组1 h即有肺泡腔及间质内炎性细胞浸润,肺泡腔内有渗出液,肺泡隔增厚,肺泡及间质充血、出血,部分肺泡塌陷,这些变化在6 h、12 h逐渐加重,24 h时又有所下降,其中以12 h组改变最明显(图1)。
2.2 W/D比值:LPS可以诱导大鼠肺组织湿质量/干质量值升高,1 h(4.80±0.13)即开始升高,6 h(6.47±0.36)继续升高,12 h(6.74 ±0.26)时W/D值升高显著高于其他LPS组,24 h(4.71±0.57)有所下降。与对照组(4.35±0.37)比较,有统计学意义(P<0.01)。
2.3 肺组织细胞凋亡的变化:TUNEL分析LPS处理后,肺组织中TUNEL阳性细胞明显增加[1 h,(28.01±2.74);6 h,(37.22± 2.95);12 h,(48.13±1.88);24 h,(15.85±1.99)]。与对照组(11.23±2.31)比较有统计学意义(P<0.01)。
2.4 肺组织cleaved-caspase-3蛋白表达:以ß-actin作为内参,cleavedcaspase-3蛋白表达量的光密度扫描分析显示,LPS组cleaved-caspase-3蛋白表达明显上升(P<0.05,图2),与对照组组比较,有统计学意义。
3 讨 论
目前ARDS的病死率仍高达40%~60%[4]。ALI是ARDS的早期阶段,内源性ALI的主要病因有:吸入肺部感染,淹溺,有毒气体吸入,肺创伤[5]。当LPS进入体内后激活炎性细胞释放炎性介质,触发局部炎性反应而产生肺损伤,且LPS本身对肺上皮和血管内皮也有直接损伤作用,可建立确切的直接肺损模型[6]。
在不同肺损伤中,凋亡起到了很大的作用。有报道显示,与全身炎性反应不同,LPS可以直接导致肺泡上皮细胞,血管内皮细胞,支气管上皮细胞凋亡[7]。研究显示,在ALI的修复期,肺泡Ⅱ型细胞是以凋亡的方式参与其结构重建,同时大量凋亡细胞被吞噬细胞清除,故细胞凋亡是一个动态发展的过程。在凋亡信号通路中,cleavedcaspase-3作为最终末的凋亡蛋白,它的增加表示凋亡已经不可逆转[8]。
本研究发现,在直接肺损伤时,肺组织的整体凋亡率的改变与病理组织形态改变呈现一致性改变,LPS滴注后1 h,肺损伤逐渐增加持续至24 h,损伤和凋亡率在12 h时达到峰值,随后凋亡率开始下降,肺损伤减轻,所以我们认为,LPS导致了肺组织炎症,细胞的凋亡,二者相辅相成,是一个先升后降的过程,该结果为肺源性肺损伤选择药物,呼吸支持的时机时间以及预后提供了一定的科学依据,但其具体凋亡发展机制仍待进一步研究。
[1] Hughes KT,Beasley MB.Pulmonary Manifestations of Acute Lung Injury:More Than Just Diffuse Alveolar Damage[J].Arch Pathol Lab Med,2016,21.
[2] Gao W,Ju YN.Budesonide Attenuates Ventilator-induced Lung Injury in a Rat Model of Inflammatory Acute Respiratory Distress Syndrome[J].Arch Med Res,2016,47(4):275-284.
[3] Nagamine Y,Tojo K,Yazawa T,et al.Inhibition of Prolyl Hydroxylase Attenuates Fas Ligand-induced Apoptosis and Lung Injury in Mice [J].Am J Respir Cell Mol Biol,2016,5.
[4] Ruthman CA,Festic E.Emerging therapies for the prevention of acute respiratory distress syndrome[J].Ther Adv Respir Dis,2015, 9(4):173-187.
[5] Monahan LJ.Acute respiratory distress syndrome[J].Curr Probl Pediatr Adolesc Health Care,2013,43(10):278-284.
[6] Dauphinee SM,Karsan A.Lipopolysaccharide signaling in endothelial cells[J].Lab Invest 2006,86(1):9-22
[7] Chopra M,.Reuben JS,.Sharma AC,et al.Acute Lung Injury:Apoptosis and Signaling Mechanisms[J].Exp Biol Med,2009,234(4): 361-371.
[8] Galani V,Tatsaki E,Bai M,et al.The role of apoptosis in the pathophysiology of Acute Respiratory Distress Syndrome (ARDS):an up-to-date cell-specific review[J].Pathol Res Pract,2010,203(3): 145-150.
R563
B
1671-8194(2016)33-0015-02
*通讯作者
