2株海洋来源产浅蓝霉素A的异壁放线菌的分离和鉴定
2015-12-26纪昌涛宋永相黄洪波鞠建华
纪昌涛, 周 潇, 陈 奇, 宋永相, 黄洪波, 王 博, 鞠建华*
(1.中国科学院 热带海洋生物资源与生态重点实验室,中国科学院 海洋微生物研究中心,广东省海洋药物重点实验室,中国科学院 南海海洋研究所,广东 广州 510301;2.中国科学院大学,北京 100049;3.西南林业大学,云南 昆明 650224)
2株海洋来源产浅蓝霉素A的异壁放线菌的分离和鉴定
纪昌涛1,2, 周 潇3, 陈 奇1,2, 宋永相1, 黄洪波1, 王 博1, 鞠建华1*
(1.中国科学院 热带海洋生物资源与生态重点实验室,中国科学院 海洋微生物研究中心,广东省海洋药物重点实验室,中国科学院 南海海洋研究所,广东 广州 510301;2.中国科学院大学,北京 100049;3.西南林业大学,云南 昆明 650224)
利用抗菌及卤虫致死活性模型,从中国南海海底沉积物来源的微生物中筛选到2株放线菌SCSIO WJ01和SCSIO ZJ63,其发酵产物具有较强活性,经16S rRNA基因序列分析这2株放线菌均为异壁放线菌Actinoalloteichussp.。HPLC-DAD分析显示2株放线菌能产生同一个主要的次级代谢产物,通过正相硅胶柱色谱、反相中压柱色谱、半制备高效液相色谱等手段,从SCSIO WJ01的发酵产物中分离获得了该化合物,运用ESI-MS、1H及13C NMR波谱分析鉴定为浅蓝霉素A(Caerulomycin A)。此外,还从SCSIO WJ01的发酵产物中分离鉴定了浅蓝霉素D。
海洋放线菌;异壁放线菌属;浅蓝霉素;联吡啶
天然产物来源的药物在抗感染、抗肿瘤等领域发挥着越来越重要的作用[1]。根据对1981~2010年新批准的药物的统计,抗感染领域直接或间接以天然产物为来源的药物所占比例高达77.4%;而在抗肿瘤领域,1940~2010年间上市的药物中直接或间接来源于天然产物的药物占79%[2]。相对于合成的化学分子实体,天然产物具有许多先天优势,如化学结构复杂多样、易于衍生,更多的手性中心,更多的氧而非氮、硫、卤素原子,芳香环原子比例低,更易形成氢键,成药性好等[3]。在挖掘微生物活性天然产物的研究中,陆生微生物资源经历了近一个世纪的筛选和开发,虽仍是人们努力的方向,但从中发现新的菌种资源和新的抗生素已显得日益困难。因此,人们把目光投向占地球表面70%以上的海洋。海洋具有高压、高盐、寡营养、低光照、低温等极端环境[4-5],栖息在此特殊环境中的海洋微生物进化出独特的代谢途径,有产生活性显著、结构多样的次级代谢产物的可能。中国南海蕴藏着丰富的有待开发的微生物资源,近年来课题组从中国南海筛选、发现了许多能产生独特次级代谢产物的药用放线菌资源,如能产具有抗疟原虫作用的吲哚生物碱Marinacarbolines A-D及抗菌、抗肿瘤的环肽Marthiapeptide A[6-8]的MarinactinosporathermotoleransSCSIO 00652[9],产细胞毒活性角环素Grincamycins的StreptomyceslusitanusSCSIO LR32[10],产抗感染活性环肽Marformycins的StreptomycesdrozdowicziiSCSIO 10141[11]等。
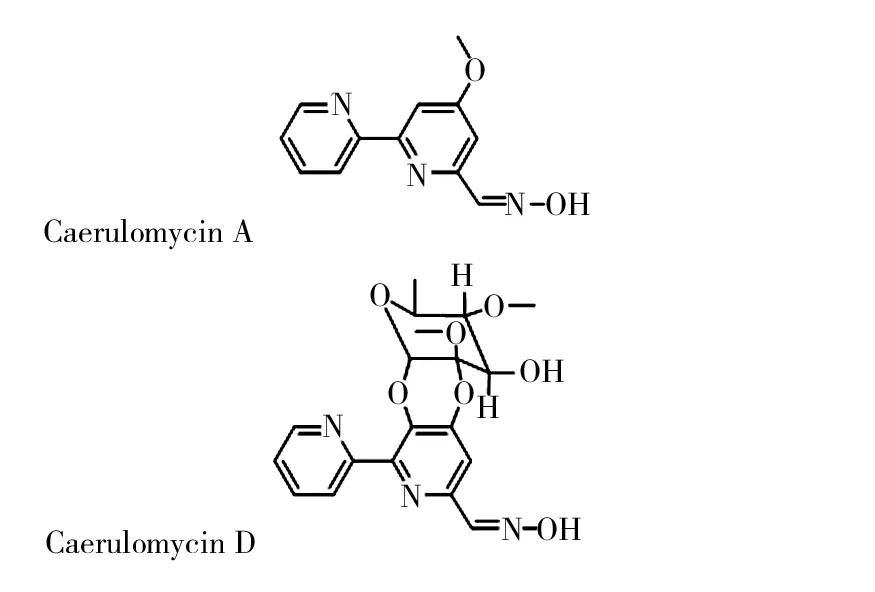
图1 浅蓝霉素A和D的结构式Fig.1 Chemical structure of caerwlomycin A and D
本研究对来源于南海海底沉积物的放线菌进行抗菌及卤虫致死活性筛选,发现2株放线菌的发酵产物有卤虫致死活性、抗大肠埃希菌和枯草芽胞杆菌的活性,经16S rRNA基因序列分析,这2株放线菌为异壁放线菌属Actinoalloteichussp. SCSIO WJ01和Actinoalloteichussp. SCSIO ZJ63;经高效液相色谱(HPLC-DAD)对2株放线菌的发酵产物进行分析,发现这2株菌都能产生一个相同的主要次级代谢产物,为联吡啶类化合物浅蓝霉素A(图1)。据文献报道,浅蓝霉素A具有显著的抗菌活性和很强的免疫抑制活性[12-14]。另外,还从SCSIO WJ01的发酵产物中分离鉴定了浅蓝霉素D。本文报道这2株海洋放线菌及其次级代谢产物浅蓝霉素的分离鉴定。
1 材料与方法
1.1 材料
1.1.1 菌株 菌株SCSIO WJ01分离自中国南海(E116°12.155′′,N22°17.985′′)50 m海底沉积物样品,菌株SCSIO ZJ63分离自中国南海(E120°0.250′′,N22°22.971′′)3 536 m海底沉积物样品,菌种保存于中国科学院海洋微生物研究中心(广州)。
1.1.2 培养基 种子培养基和发酵培养基均用M-AM2ab培养基。配方(g/100 mL):豆粉0.5,酵母粉0.5,可溶性淀粉2,细菌学蛋白胨0.2,海盐3,碳酸钙0.2,pH 7.4,121 ℃灭菌30 min备用。
1.1.3 仪器及试剂 Bruker AVANCE DRX 500核磁共振仪(500/125 MHz,TMS为内标),Bruker amaZon SL离子肼质谱仪,Varian ProStar 210和Agilent 1260 infinity高效液相色谱仪,中压制备层析系统EZ Purifier III(上海利穗化工科技有限公司);硅胶薄层层析板(HSGF254)和柱层析用硅胶(100~200目)均为烟台江友硅胶开发有限公司产品,反相中压柱填料为YMC GEL ODS-A(75 μm),半制备色谱柱为YMC-Pack ODS-A(250 mm×10 mm,5 μm);色谱纯乙腈(安徽时联),氘代甲醇、DMSO(CIL),其他化学试剂为国产分析纯试剂。
1.2 方法
1.2.1 放线菌SCSIO WJ01和SCSIO ZJ63的分离、16S rRNA基因序列分析 ①菌株分离和培养:无菌条件下取约5 g海底沉积物泥样加入20 mL灭菌水中(含30 g/L海盐+少许玻璃珠),轻轻混匀,60 ℃水浴10 min,冷却至室温,30 ℃环境下200 r/min震荡30 min,梯度稀释后吸取200 μL样品涂平板(含50 μg/mL制霉菌素),30 ℃环境下静置培养20~30 d,定期观察。根据生长情况不断转接至新的平板,直至分离到单克隆放线菌株。②16S rRNA基因序列的PCR扩增、测序:用细菌16S rDNA通用引物27F(5′-AGAGTTTGATC(AC)TGGCTCAG-3′)和1492R(5′-ACGG(CT)TACCTTGTTACGACTT-3′)进行PCR扩增。50 μL PCR反应体系:DNA模板0.5 μL,5×PCR Buffer 10.0 μL,dNTPs(各2.5 mmol/L)4 μL,27F(10 μmol/L)2 μL,1492R(10 μmol/L)2 μL,FastPfu高保真酶(5 U/μL)0.5 μL,DMSO 2 μL,补充dd H2O至50 μL。PCR条件:95 ℃预变性5 min,94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸1.5 min,30个循环,72 ℃继续延伸10 min;4 ℃保温。1%琼脂糖凝胶电泳后切胶,用凝胶回收试剂盒纯化PCR产物,加A尾纯化后连接到pCR 2.1载体并转入E.coliDH5α,经PCR验证和质粒酶切验证后,选3个质粒送深圳华大公司测序。③系统发育树的构建:放线菌SCSIO WJ01和SCSIO ZJ63的16S rRNA基因序列分别通过BLAST在线分析,获取同源性较高的菌株信息后,下载到本地通过Mega5自带的ClustalW进行多序列比对,系统发育树使用邻接法(Neighbor-Joining,Kimura 2)构建。
1.2.2 放线菌SCSIO WJ01和SCSIO ZJ63菌株的发酵培养 种子液用250 mL锥形瓶,每瓶加入50 mL培养基,从平板上接入适量菌种,于28 ℃、200 r/min的摇床上培养36 h后分别转接于1 L锥形瓶,每瓶含200 mL培养基,于28 ℃、200 r/min条件下培养7 d。
1.2.3 放线菌SCSIO WJ01发酵产物的提取与分离 发酵产物(6 L)于4 000 r/min离心10 min,分离得到上清液和菌丝体部分,上清液经丁酮萃取后减压浓缩,菌丝体用丙酮浸提后减压浓缩,通过HPLC分析后合并上清液和菌丝体提取物得到总浸膏17 g。采用正相柱层析,氯仿-甲醇梯度(V(氯仿)∶V(甲醇)分别为100∶0、98∶2、96∶4、94∶6、92∶8、90∶10、8∶2、5∶5)洗脱共得到8个组分Fr.1~8。活性追踪显示Fr.3~4为活性组分,进一步经过中压反相柱层析,甲醇-水梯度(V(甲醇)∶V(水)为0∶100~100∶0)洗脱得到亚组分Fr.A-1~A-13,通过TLC验证合并后对其中Fr.A-5~A-8进行常压正相柱层析,石油醚-乙酸乙酯梯度(V(石油醚)∶V(乙酸乙酯)分别为7∶3、6∶4、5∶5、4∶6、3∶7)洗脱,通过TLC检测后,主要组分以半制备HPLC(乙腈-水35%~95%线性洗脱30 min,流速2.5 mL/min)在tR16 min得到化合物1(75 mg),在tR17.5 min得到化合物2(7 mg)。
1.2.4 放线菌SCSIO ZJ63发酵产物的提取与分离 发酵产物(4 L)于4 000 r/min离心10 min,分离得到上清液和菌丝体部分,上清液经丁酮萃取后减压浓缩得到浸膏A;菌丝体用丙酮浸提得到浸膏B,通过HPLC分析后合并A和B得到总浸膏15 g。采用正相柱层析,氯仿-甲醇梯度(V(氯仿)∶V(甲醇)分别为100∶0、98∶2、96∶4、94∶6、92∶8、90∶10、8:2、5∶5)洗脱共得到8个组份Fr.1~8。活性追踪显示Fr.3~4为活性组分,进一步经过正向柱层析,石油醚-乙酸乙酯梯度(V(石油醚)∶V(乙酸乙酯)分别为8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8)洗脱得到亚组分Fr.B-1~B-8,HPLC结合活性追踪显示Fr.B-4为活性组分,以中压制备MPLC(甲醇-水10%~80%线性洗脱60 min,流速8 mL/min)在tR21.5 min得到化合物1(80 mg)。
2 结果与分析
2.1 放线菌SCSIO WJ01和SCSIO ZJ63菌株鉴定
16S rRNA基因序列分析表明SCSIO WJ01和SCSIO ZJ63与蓝灰异壁放线菌Actinoalloteichuscyanogriseus和斯比提异壁放线菌ActinoalloteichusspitiensisRMV-1378T相似性较高,在99.49%和99.92%之间,故菌株SCSIO WJ01和SCSIO ZJ63为异壁放线菌属成员,根据邻接法(Neighbor-Joining,Kimura 2)构建的系统发育树(图2)与最大似然法(Maximum likelihood)等构树结果一致。因此,SCSIO WJ01和SCSIO ZJ63应为蓝灰异壁放线菌A.cyanogriseus或斯比提异壁放线菌A.spitiensis的菌株,现保藏于中国科学院海洋微生物研究中心,其菌落特征如图3所示。
2.2 SCSIO WJ01和SCSIO ZJ63发酵产物的HPLC分析
SCSIO WJ01和SCSIO ZJ63菌株发酵液50 mL,用等体积丁酮萃取,蒸干丁酮,残渣溶解于1 mL甲醇中,分别取20 μL样品进行HPLC分析,结果显示SCSIO WJ01和SCSIO ZJ63在相同的保留时间tR10.8 min处,均有一个UV吸收相同的化合物,即随后鉴定的浅蓝霉素A,如图4所示。
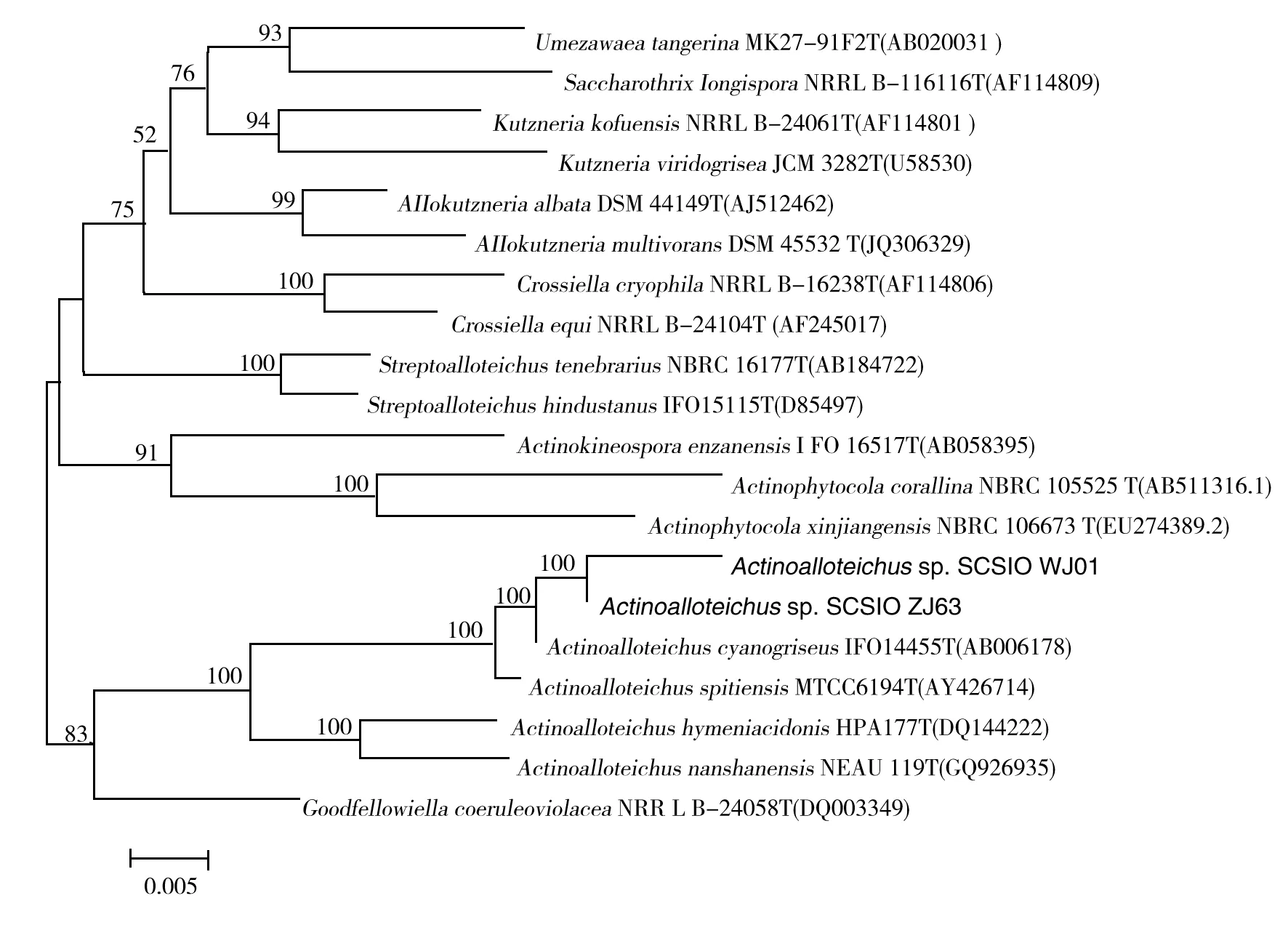
图2 基于16S rRNA基因序列构建的SCSIO WJ01和SCSIO ZJ63分子系统进化树Fig.2 Neighbour-joining tree based on 16S rRNA gene sequences showing relationship between strain SCSIO WJ01, SCSIO ZJ63 and closely related members of genus Actinoalloteichus
图3 SCSIO WJ01和SCSIO ZJ63菌落特征Fig.3 Colonies characteristics SCSIO WJ01 and SCSIO ZJ63
2.3 化合物1和2的结构鉴定
2.3.1 化合物1 白色粉末,ESI-MS(+)给出准分子离子峰m/z230.1[M+H]+,252.1[ M+Na]+,提示其分子量为229,结合氢谱和碳谱信息推测其分子式为C12H11N3O2,不饱和度为9。1H NMR高场区有一个甲氧基的质子信号,低场区有6个耦合的芳香氢信号,根据其耦合常数可分为两组:δH7.90(d,J=2.0 Hz)和7.32(d,J=2.0 Hz);8.68(d,J=7.5 Hz)、8.38(d,J=7.0 Hz)、7.94(dd,J=7.5,7.0 Hz)及7.45(dd,J=7.5,7.5 Hz),结合碳谱中的芳碳信号,以及分子中存在氮原子,提示分子中存在2个芳环体系,推测为吡啶环,占用10个芳碳;剩余的一个芳碳信号,结合1H NMR在低场区存在一个单峰芳香质子信号δH8.15(s),以及一个活泼质子信号δH11.73(1H,s),推断分子中存在醛肟的结构单元。经查阅文献[15] ,确定化合物1为浅蓝霉素A。
ESI-MS(+) (m/z):230.1[M+H]+,252.1[M+Na]+,1H NMR(DMSO-d6,500 MHz) δ:11.73(1H,s,7-N-OH),8.68(1H,d,J=7.5 Hz,H-6′),8-38(1H,d,J=7.0 Hz,H-3′),8.15(1H,s,H-7),7.94(1H,dd,J=7.5, 7.0 Hz,H-4′),7.90(1H,d,J=2.0 Hz,H-3),7.45(1H,dd,J=7.5,7.0 Hz,H-5′),7.32(1H,d,J=2.0 Hz,H-5),3.94(3H,s,4-OMe);13C NMR(DMSO-d6,125 MHz) δ:166.5(C-4),156.8(C-2),154.4(C-2′),153.3(C-6),149.1(C-6′),148.7(C-7),137.2(C-4′),124.4(C-5′),120.7(C-3′),106.4(C-3),105.5(C-5),55.5(4-OMe)。
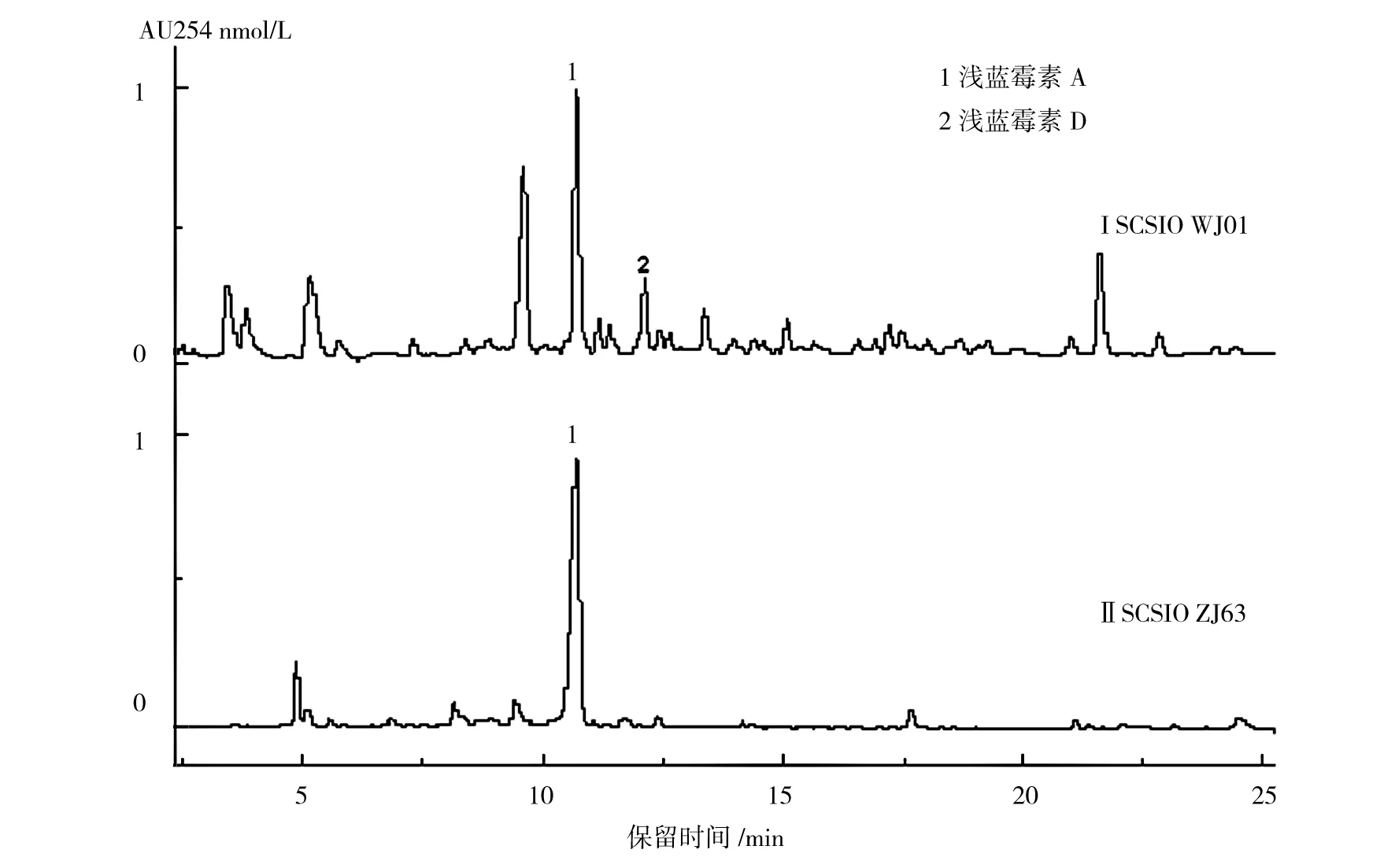
图4 菌株SCSIO WJ01和SCSIO ZJ63产生浅蓝霉素的HPLC分析Fig.4 HPLC analysis of the caerulomycin A from the culture extracts of SCSIO WJ01 and SCSIO ZJ63
2.3.2 化合物2 白色粉末,(+)ESI-MS给出准分子离子峰m/z404.0[M+H]+,提示其分子量为403,根据氢谱和碳谱信息推测其分子式为C19H21N3O7,不饱和度为11。与化合物1相比,1H NMR谱显示少一个芳香质子信号,而在δH5.27~3.17区域多出4个连氧质子信号,以及1个甲氧基质子信号,在高场区δH1.39(d,J=6.2 Hz)多出一个连次甲基的甲基质子信号。13C NMR谱的19个碳信号中,芳香区有与1相似的11个碳信号,另外还存在6个连氧碳、2个甲氧基以及1个甲基碳信号。与文献[16] 对照,数据基本一致,故确定其为浅蓝霉素D。
(+)ESI-MSm/z404.0 [M+H]+,426.4 [M+Na]+;1H NMR(CD3OD,500 MHz) δ:8.65(1H,d,J=7.5 Hz,H-6′),8.15(1H,s,H-12),7.95(1H,d,J=7.5 Hz,H-3′),7.91(1H,dd,J=7.5,7.0 Hz,H-4′),7.50(1H,s,H-6),7.43(1H,dd,J=7.5,7.0 Hz,H-5′),5.47(1H,s,H-10a),3.94(1H,dq,J=12.4,6.2 Hz,H-2),3.83(1H,d,J=8.5 Hz,H-4),3.58(3H,s,3-OMe),3.47(3H,s,4a-OMe),3.17(1H,t,J=8.5 Hz,H-3),1.39(3H,d,J=6.2 Hz,H-11);13C NMR(CD3OD,125 MHz) δ:154.5(C-2′),150.1(C-9),149.2(C-6′),149.1(C-12),147.6(C-7),146.3(C-5a),137.9(C-4′),137.7(C-9a),125.8(C-3′),124.5(C-5′),109.4(C-6),97.2(C-4a),92.4(C-10a),84.1(C-3),71.3(C-2),70.9(C-4),61.1(3-OMe),51.3(4a-OMe),17.9(C-11)。
3 讨 论
浅蓝霉素A最早是由Funk等[14]于1959年从Streptomycescaeruleus(2008年Tamura等[17]重分类为Actinoalloteichuscyanogriseus)的发酵液中分离得到,由Divekar等[18]于1966年确定其结构。随后,人们相继分离鉴定了浅蓝霉素B-K等系列化合物。该类化合物有抗真菌,抗细菌活性[14],植物细胞毒活性[13],仓鼠、大鼠和人肿瘤细胞毒性[19-21],免疫抑制等[12]广泛的生物活性。浅蓝霉素A的免疫抑制活性尤其引人关注,相对于免疫抑制剂环孢菌素、他克莫司、雷帕霉素,浅蓝霉素A能更加有效地抑制白细胞增殖[12]。本研究从中国南海海底沉积物中分离筛选得到的2株异壁放线菌SCSIO WJ01和SCSIO ZJ63,均产浅蓝霉素A,其中菌株SCSIO ZJ63的产率达到20 mg/L,为通过诱变育种和代谢工程改造进一步提高其产量,或通过生物合成技术改造其结构提供了宝贵的菌种资源。
[1] Koehn F.E., Carter G.T. The evolving role of natural products in drug discovery[J].Nature Reviews Drug Discovery,2005,4(3):206-220.
[2] Newman D.J., Cragg G.M. Natural products as sources of new drugs over the 30 years from 1981 to 2010[J]. Journal of natural products,2012,75(3):311-335.
[3] Yuliana N.D., Khatib A., Choi Y.H., et al. Metabolomics for bioactivity assessment of natural products[J]. Phytotherapy research,2011,25(2):157-169.
[4] Dharmaraj S. Marine Streptomyces as a novel source of bioactive substances[J].World Journal of Microbiology and Biotechnology,2010,26(12):2123-2139.
[5] Fenical W., Jensen P.R. Developing a new resource for drug discovery: marine actinomycete bacteria[J]. Nature chemical biology,2006,2(12):666-673.
[6] Chen Q., Ji C.T., Song Y.X., et al. Discovery of McbB, an enzyme catalyzing the β-carboline skeleton construction in the marinacarboline biosynthetic pathway[J].Angewandte Chemie,2013,125(38):10164-10168.
[7] Huang H.B., Yao Y.L., He Z.X., et al. Antimalarial β-carboline and indolactam alkaloids fromMarinactinosporathermotolerans, a deep sea isolate[J].Journal of natural products,2011,74(10):2122-2127.
[8] Zhou X, Huang H.B., Chen Y.C., et al. Marthiapeptide A, an anti-infective and cytotoxic polythiazole cyclopeptide from a 60 L scale fermentation of the deep sea-derivedMarinactinosporathermotoleransSCSIO 00652[J].Journal of natural products,2012,75(12):2251-2255.
[9] Tian X.P., Tang S.K., Dong J.D., et al.Marinactinosporathermotoleransgen. nov., sp. nov., a marine actinomycete isolated from a sediment in the northern South China Sea[J].International journal of systematic and evolutionary microbiology,2009,59(5):948-952.
[10]Huang H.B, Yang T.T., Ren X.M., et al. Cytotoxic angucycline class glycosides from the deep sea actinomyceteStreptomyceslusitanusSCSIO LR32[J].Journal of natural products,2012,75(2):202-208.
[11]Zhou X., Huang H.B., Li J., et al. New anti-infective cycloheptadepsipeptide congeners and absolute stereochemistry from the deep sea-derivedStreptomycesdrozdowicziiSCSIO 10141[J].Tetrahedron,2014,70(42):7795-7801.
[12]Agrewala J.N., Jolly R.S., Singla A.K., et al. Use of bipyridine compound′ caerulomycin A′derivatives and analogs thereof as immunosuppressive agents[P]. 2012.
[13]Chandran R., Sankaran R., Divekar P. Phytotoxic properites of caerulomycin and some of its derivatives[J]. The Journal of antibiotics,1968,21(3):243.
[14]Funk A., Divekar P. Caerulomycin, A new antibiotic fromStreptomycesCaeruleusbaldacci: I production, isolation, assay, and biological properties[J].Canadian journal of microbiology,1959,5(4):317-321.
[15]McInnes A., Smith D., Wright J., et al. Caerulomycins B and C, new 2, 2′-dipyridyl derivatives fromStreptomycescaeruleus[J].Canadian Journal of Chemistry,1977,55(24):4159-4165.
[16]McInnes A.G., Smith D.G., Walter J.A., et al. Caerulomycin D, a novel glycosidic derivative of 3, 4-dihydroxy-2, 2′-dipyridyl 6-aldoxime fromStreptomycescaeruleus[J].Canadian Journal of Chemistry,1978,56(13):1836-1842.
[17]Tamura T., Ishida Y., Otoguro M., et al. Reclassification ofStreptomycescaeruleusas a synonym ofActinoalloteichuscyanogriseusand reclassification ofStreptomycesspheroidesandStreptomyceslaceyias later synonyms ofStreptomycesniveu[J].International journal of systematic and evolutionary microbiology,2008,58(12):2812-2814.
[18]Divekar P., Read G., Vining L. Caerulomycin, a new antibiotic fromStreptomycescaeruleusBaldacci. II. Structure[J].Canadian Journal of Chemistry,1967,45(11):1215-1223.
[19]Chatterjee D., Raether W., Iyer N., et al. Caerulomycin, an antifungal antibiotic with marked in vitro and in vivo activity againstEntamoebahistolytica[J].Zeitschrift für Parasitenkunde,1984,70(5):569-573.
[20]Fu P., Liu P.P., Li X., et al. Cyclic bipyridine glycosides from the marine-derived actinomyceteActinoalloteichuscyanogriseusWH1-2216-6[J].Organic letters,2011,13(22):5948-5951.
[21]Fu P., Wang S.X., Hong K., et al. Cytotoxic bipyridines from the marine-derived actinomyceteActinoalloteichuscyanogriseusWH1-2216-6[J].Journal of natural products,2011,74(8):1751-1756.
Isolation and Identification of Two Marine-Originated Actinoalloteichus sp. Producing Caerulomycin A
JI Chang-tao1, 2, ZHOU Xiao3, CHEN Qi1, 2, SONG Yong-xiang1,HUANG Hong-bo1,WANG Bo1, JU Jian-hua1
(1.CASKeyLab.ofTrop'lMarineBio-Res. &Ecol.,GuangdongKeyLab.ofMarineMateriaMedica,RNAMCtr.forMarineMicrobiol.,S.ChinaSeaInst.ofOceanol.,ChinaAcad.ofSci.,Guangzhou510301; 2.Uni.ofChinaAcad.ofSci.,Beijing, 110049; 3.SWForestryUni.Kunming, 650224)
Two marine-originated actinobacteria strains SCSIO WJ01 and SCSIO ZJ63 isolated and screened from sediments collected in the bottom of South China Sea, using antibiotic and lethal activities model against brine shrimp (Artemiasalina), their fermentation broths possessed fairly strong activity. These two strains were identified asActinoalloteichussp. through 16S rRNA gene sequence analysis. HPLC-DAD analysis disclosed that strains SCSIO WJ01 and SCSIO ZJ63 could produce the same major secondary metabolite. These fermentation products were isolated from the fermentation extract of strain SCSIO WJ01 by means of ortho-phase silica gel column chromatography and counter-phase mid-pressure column chromatography, and semi-preparative HPLC etc and identified to be caerulomycin A using ESI-MS,1H and13C NMR spectroscopic analyses. In addition, caerulomycin D was also isolated and identified from fermentation product of strain SCSIO WJ01.
marine Actinomycetes;Actinoalloteichus; caerulomycin; dipyridines
国家自然科学青年基金项目(41106138,41206135);中国科学院知识创新工程青年人才领域前沿项目(SQ201119)
纪昌涛 男,硕士。研究方向为海洋微生物天然产物及其生物合成。Tel: 020-89108627,E-mail:jichangtao1988@163.com
* 通讯作者。男,博士,研究员,博士生导师。研究方向为海洋微生物天然产物及其生物合成。Tel: 020-89023028,E-mail:jju@scsio.ac.cn
2014-05-06;
2014-06-03
Q93
A
1005-7021(2015)01-0024-06
10.3969/j.issn.1005-7021.2015.01.005
