禽内源性反转录病毒ALVE1 LTR转录水平分析
2015-11-19胡序明朱文奇陈世豪刘洋洋耿拓宇宋成义秦爱建崔恒宓
胡序明,朱文奇,陈世豪,刘洋洋,孙 振,耿拓宇,宋成义,高 波,秦爱建,崔恒宓
(1. 扬州大学 表观遗传学及表观基因组学研究所,扬州 225009;2. 扬州大学动物科学和技术学院,扬州225009;3. 扬州大学 教育部禽类预防医学重点实验室,扬州 225009;4. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
禽内源性反转录病毒ALVE1 LTR转录水平分析
胡序明1,2,朱文奇1,2,陈世豪1,2,刘洋洋1,2,孙 振1,2,耿拓宇1,2,宋成义1,2,高 波1,2,秦爱建3,4,崔恒宓1,2
(1. 扬州大学 表观遗传学及表观基因组学研究所,扬州 225009;2. 扬州大学动物科学和技术学院,扬州225009;3. 扬州大学 教育部禽类预防医学重点实验室,扬州 225009;4. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
本研究以禽内源性反转录病毒ALVE1为研究对象,分析了ALVE1长末端重复序列(long terminal repeat,LTR)自身转录的变化规律。荧光定量PCR结果显示LTR在2日龄SPF鸡(发育早期)器官组织中转录水平高,而在35日龄SPF鸡(发育晚期)器官组织中转录水平低。焦磷酸测序和荧光定量PCR关联分析发现,ALVE1 LTR在鸡巨噬细胞系HD11和鸡T淋巴细胞系MSB1细胞中的转录水平可能受DNA甲基化调控,去甲基化处理HD11或MSB1 24 h后,LTR转录水平显著增加。通过序列分析发现ALVE1 LTR高度保守且存在先天性免疫应答激活转录因子如NF-AT、c-JUN等。本研究揭示了ALVE1 LTR自身转录的变化规律,为进一步分析ALVE1 LTR功能奠定了基础。
禽内源性反转录病毒;长末端重复序列;DNA甲基化;表观遗传学
内源性反转录病毒(Endogenous retroviruses)是基因组成分,约占基因组的5%~8%,多以其“前病毒”形式存在。内源性反转录病毒几乎在所有哺乳动物(如人、鼠、猫和羊)和脊椎动物(如鸡)基因组中存在。研究表明,内源性反转录病毒对胚胎发育、免疫应答、病毒感染以及肿瘤形成具有作用[1-5],有的与胚胎干细胞的多能性有关[4]。通常内源性反转录病毒转录依赖于病毒长末端重复序列(long terminal repeats,LTRs),而这些LTRs可以应答病毒和宿主的转录因子[5-7]。LTR具有转录内源性反转录病毒序列的启动子和增强子功能,此外还有转录子加尾作用[6,8]。
禽内源性反转录病毒ALVE1含有完整的LTR序列,其表达调控机制目前不是很清楚。本研究首先以SPF鸡器官组织分析了LTR在SPF鸡发育过程中的表达规律,并对LTR序列进行保守性分析。然后,通过焦磷酸测序分析LTR甲基化。最后通过关联分析得出LTR受DNA甲基化调控,并且去甲基化处理可以激活LTR转录。目前的研究主要是探索了ALVE1 LTR自身转录的变化规律,为进一步分析ALVE1的功能奠定了基础。
1 材料和方法
1.1 细胞 SPF白羽种鸡蛋由北京梅里亚维通实验动物技术有限公司提供,孵化至10日龄后,按常规方法制备鸡胚成纤维细胞(chicken embryo fibroblast,CEF);禽巨噬细胞系(HD11)由扬州大学焦新安教授馈赠;鸡T淋巴细胞系(MSB1)由教育部禽类预防医学重点实验室秦爱建教授馈赠。
1.2 主要试剂 全基因组提取试剂盒QIAGEN Blood& Tissue Kit、全基因DNA重亚硫酸盐处理试剂盒EpiTect Fast DNA Bisulfite Kit、焦磷酸测序分析DNA甲基化试剂盒(PyroMark Q24 Advanced CpG Kit、PyroMark Denaturation Sol、PyroMark Wash Buffer和 PyroMark®PCR Kit)购自德国QIGEN公司;总RNA小量制备试剂盒购自美国Axygen公司;反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser 和荧光染料试剂SYBR Premix Ex Taq Ⅱ购自日本TaKaRa公司;1640培养基、DMEM和胎牛血清购自GIBCO公司;其他试剂均为国产分析纯。
1.3 组织收集 将出壳后2日龄和35日龄SPF鸡随机扑杀3只,迅速剥离新鲜完整的大脑、法氏囊、胸腺、脾脏、心脏、肝脏、肾脏、肺脏和皮肤组织,用冰冷的PBS(pH7.4)清洗以除去血渍,然后迅速放入液氮保存。从液氮中取出组织后迅速转移到提前预冷清洁的研钵中,液氮环境下充分研磨后提取总RNA和基因组用于荧光定量和DNA甲基化分析。
1.4 去甲基化试剂AZA处理实验 DNA甲基化抑制剂AZA(5-Aza-2-Deoxycytidine)处理是判断基因是否受表观遗传学机制调控的依据之一。分别将鸡巨噬细胞系HD11和鸡T淋巴细胞系HD11接种在6孔细胞培养板里,AZA处理浓度为5 μmol/L,对照组用AZA溶剂DMSO处理,24 h后收集细胞,用于荧光定量PCR分析。
1.5 基因组提取和DNA甲基化分析 按照全基因组提取试剂盒操作步骤提取基因组DNA,测定浓度后用于DNA甲基化分析。LTR甲基化分析参考文献[9],简要步骤如下:首先根据ALVE1 LTR序列,用甲基化引物设计软件PyroMark Assay Design 2.0设计PCR引物和焦磷酸测序引物,检测CpG甲基化位点。然后,基因组DNA经PyroMark PCR Kit重亚硫酸盐处理后,在PCR热循环仪中扩增目的片段。最后通过实时定量焦磷酸测序分析仪PyroMark Q24进行测序。
1.6 总RNA提取、反转录和荧光定量PCR 按照Axygen总RNA小量制备试剂盒说明书操作步骤提取总RNA,然后用反转录试剂盒PrimeScript RT reagentKit with gDNA Eraser将1 μg总RNA反转录成cDNA产物。cDNA产物稀释后通过ABI 7500实时定量PCR仪进行定量分析。反应体系:cDNA 模板1 μL、ROX II 0.4 μL、SYBR Green II 10μL、上游和下游引物各2 μL、超纯水4.6 μL。反应条件:95℃预变性30 s;95℃变性5 s,60℃退火34 s,40个循环。引物序列参见文献[9],LTR为检测基因,β-actin和GAPDH基因作为内参照。
2 结果
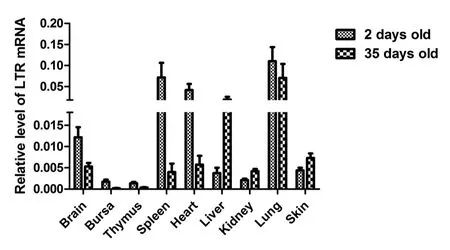
图1 ALVE1 LTR mRNA在SPF鸡组织中的相对转录水平Fig. 1 Relative level of ALVE1 LTR mRNA in SPF chicken tissues
2.1 ALVE1 LTR在SPF鸡发育过程中的转录水平规律荧光定量PCR结果显示,ALVE1 LTR在鸡大脑、法氏囊、胸腺、脾脏、心脏、肝脏、肾脏、肺脏和皮肤组织中均能表达且在发育早期转录水平很高(图1)。出壳2日龄SPF鸡脾脏、心脏和肺脏组织中,ALVE1 LTR转录水平偏高。与出壳2日龄SPF鸡相比,35日龄SPF鸡大多数组织中ALVE1 LTR转录水平偏低,而肝脏组织中LTR转录水平偏高。
2.2 ALVE1 LTR转录和甲基化关联分析 LTR基因位于ALVE1序列的两端,可能是控制病毒活性的启动子。我们通过Bisulfite-焦磷酸测序和荧光定量PCR关联分析发现禽内源性反转录病毒ALVE1 LTR在鸡巨噬细胞系HD11细胞和鸡T淋巴细胞系MSB1中的转录可能受到DNA甲基化调控(图2)。LTR在MSB1细胞中的转录明显高于其在HD11细胞,而LTR甲基化水平在MSB1细胞中明显低于HD11细胞。

图2 ALVE1 LTR转录水平与DNA甲基化关联分析Fig.2 Association analysis of transcription level and DNA methylation of ALVE1 LTR
2.3 AZA处理激活ALVE1 LTR转录 内源性反转录病毒的转录激活通常受到表观遗传调控,如DNA甲基化。由此,我们通过去甲基化处理实验观察去甲基化是否会激活LTR转录。结果显示:AZA处理鸡巨噬细胞系HD11细胞24 h后,LTR转录水平显著增加(图3A);鸡T淋巴细胞系MSB1 经AZA处理24 h后,其内源性反转录病毒ALVE1 LTR转录水平亦显著增加(图3B)。这说明ALVE1 LTR的转录可能受DNA甲基化调控。
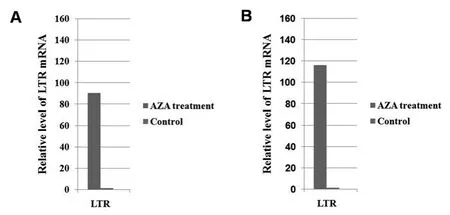
图3 AZA处理诱导LTR转录Fig.3 Transcription of ALVE1 LTR induced by AZA treatment
2.4 ALVE1 LTR序列分析 假设LTR具备调控内源性病毒的活性的能力,那么LTR序列可能存在一些调控元件或者转录因子结合位点。利用ALGGENPROMO软件分析禽内源性反转录病毒ALVE1 5'端非编码区LTR序列发现:ALVE1 LTR存在很多先天性免疫应答激活转录因子如NF-AT、c-JUN、GATA、YY1、p300、SRF等结合位点(图4),这与人内源性反转录病毒HERVK LTR存在先天性免疫应答激活转录因子结合位点的分析结果类似[5]。另外,我们也将来自SPF鸡器官组织、鸡胚成纤维细胞CEF、鸡巨噬细胞系HD11和鸡T淋巴细胞系MSB1的LTR的荧光定量PCR产物克隆测序。测序结果显示,113 bp LTR产物高度保守,序列同源性为100%(图5)。
3 讨论
研究表明,内源性反转录病毒在宿主细胞中通过重组可产生独立的LTR序列,这些LTR序列作为增强子、启动子等具有表观遗传调节基因表达的潜能[8]。本研究通过LTR转录水平和DNA甲基化关联分析发现:ALVE1 LTR受到DNA甲基化调控,并且去甲基化处理诱导LTR转录。此外,ALVE1 LTR在SPF鸡发育早期转录水平偏高,而发育晚期则偏低。然而,在肝脏组织则相反,其不一致可能与组织特异性或者表观遗传调控机制有关。

图4 ALGGEN-PROMO 软件分析ALVE1 5'LTR转录因子结合位点Fig.4 Transcription factor binding sites analysis of ALVE1 5'LTR using ALGGEN-PROMO software

图5 113 bp LTR序列分析Fig.5 Sequence analysis of 113 bp LTR
内源性反转录病毒LTR转录不仅受到DNA甲基化调控,还能与先天性免疫系统和与炎症相关的转录因子结合从而潜在调节内源性反转录病毒的转录。ALGGEN-PROMO软件分析发现禽内源性反转录病毒ALVE1 LTR存在很多先天性免疫应答激活转录因子如NF-AT、c-JUN等,这说明禽内源性反转录病毒可能涉及宿主先天性免疫的激活反应。据报道,Toll样受体配体刺激可以激活内源性反转录病毒的转录,而Nucleic Acid-Sensing Toll-样受体对控制内源性反转录病毒引起的病毒血症和诱导的肿瘤是必须的[3]。在机体受到外源性病毒如反转录病毒(HIV-1和HTLV-1)、疱疹病毒(HSV-1和EBV)感染也可以激活内源性反转录病毒转录[5,10,11]。这些病毒主要通过编码的病毒蛋白增加转录因子与内源性反转录病毒LTR序列上结合位点(如NF-κB和AP-1)的亲和力,从而反式激活内源性转录病毒转录[5,12]。
综上所述,我们认为LTR是控制禽内源性反转录病毒ALVE1转录活性的一个关键因素,其自身转录受到DNA甲基化调控。当然,ALVE1的转录活性可能还受到其他因素调控。目前的研究结果阐明了ALVE1 LTR自身转录的变化规律,为今后研究内源性反转录病毒的功能及其表观遗传学调控机制奠定了基础。
[1] Kurth R, Bannert N. Beneficial and detrimental effects of human endogenous retroviruses[J]. Int J Cancer, 2010,126(2)∶ 306-314.
[2] Weiss R A. The discovery of endogenous retroviruses[J]. Retrovirology, 2006, 3∶ 67.
[3] Yu P, Lübben W, Slomka H. Nucleic acid-sensing Tolllike receptors are essential for the control of endogenous retrovirus viremia and ERV-induced tumors[J]. Immunity, 2012, 37(5)∶ 867-879.
[4] Lu X, Sachs F, Ramsay L. The retrovirus HERVH is a long noncoding RNA required for human embryonic stem cell identity[J]. Nat Struct Mol Biol, 2014, 21(4)∶ 423-425.
[5] Manghera M, Douville R N. Endogenous retrovirus-K promoter∶ a landing strip for inflammatory transcription factors[J]Retrovirology, 2013, 10∶ 16.
[6] Khodosevich K, Lebedev Y, Sverdlov E. Endogenous retroviruses and human evolution[J]. Comp Funct Genomics, 2002, 3(6)∶ 494-498.
[7] Moyes D, Griffiths D J, Venables P J. Insertional polymorphisms∶ a new lease of life for endogenous retroviruses in human disease[J]. Trends Genet, 2007,23(7)∶ 326-333.
[8] Buzdin A. Human-specific endogenous retroviruses[J]. Scientific World J, 2007, 7∶ 1848-1868.
[9] 朱文奇, 胡序明, 陈世豪, 等. 禽内源性反转录病毒ALVE表观遗传学分析方法建立及应用[J]. 中国动物传染病学报, 25(5)∶ 15-20.
[10] Assinger A, Yaiw K C, Göttesdorfer I. H u m a n cytomegalovirus (HCMV) induces human endogenous retrovirus (HERV) transcription[J]. Retrovirology, 2013,10∶ 132.
[11] Bhardwaj N, Maldarelli F, Mellors J. HIV-1 infection leads to increased transcription of human endogenous retrovirus HERV-K (HML-2) proviruses in vivo but not to increased virion production[J]. J Virol, 2014, 88(19)∶11108-11120.
[12] Gonzalez-Hernandez M J, Cavalcoli J D, Sartor M A, et al. Regulation of the human endogenous retrovirus K (HML-2) transcriptome by the HIV-1 Tat protein[J]. J Virol,2014, 88(16)∶ 8924-8935.
TRANSCRIPTIONAL ANALYSIS OF AVIAN ENDOGENOUS RETROVIRUS ALVE1 LTR
HU Xu-ming1,2, ZHU Wen-qi1,2, CHEN Shi-hao1,2, LIU Yang-yang1,2, SUN Zhen1,2, GENG Tuo-yu1,2,SONG Cheng-yi1,2, GAO Bo1,2, QIN Ai-jian3,4, CUI Heng-mi1,2
(1. Institute of Epigenetics and Epigenomics, Yangzhou University, Yangzhou 225009, China; 2. College of Animal Science and Technology,Yangzhou University, Yangzhou 225009, China; 3. Ministry of Education Key Lab for Avian Preventive Medicine, Yangzhou University,Yangzhou 225009, China; 4. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
The long terminal repeat (LTR) of Endogenous retroviruses (ERVs) contains many regulatory sequences, such as promoters,enhancers. Thus, the endogenous LTR activity may be tightly regulated. In this study, the expression pattern of ALVE1 LTR was explored by analyzing the transcription levels of avian Endogenous retroviruses ALVE1 LTR. Real-time PCR results showed that a relative highlevel transcription of ALVE1 LTR in SPF chicken tissues at 2 days (at the early development stages) while low at 35 days(at the late development stages). Association analysis of LTR suggested that transcription of ALVE1 LTR in chicken macrophage cell line HD11 andchicken T-lymphocyte line MSB1 might be regulated by DNA methylation based on the pyrosequencing and fl uorescence quantitative PCR results. Moreover, transcription levels of LTR were signifi cantly increased in HD11 or MSB1 treated with AZA for 24 hours. The sequence of ALVE1 LTR is highly conserved and contains the activating transcription factor involved in innate immune response such as NF-AT, c-JUN, and so on. This study provided the expression pattern of ALVE1 LTR and the foundation for further research on the function of ALVE1 LTR.
Avian endogenous retroviruses; long terminal repeat (LTR); DNA methylation; epigenetics
S852.659.3
A
1674-6422(2015)05-0027-05
2015-07-16
国家973项目(2012CB517605);国家自然科学基金项目(81171965、81372237、91540117);江苏省畜牧学优势学科项目;中国博士后科学基金第57批面上资助项目(2015M571828)
胡序明,男,博士,主要从事内源性反转录病毒功能及其表观遗传学机制研究
崔恒宓,E-mail:hmcui@yzu.edu.cn;秦爱建,E-mail:aijian@yzu.edu.cn
