兔感染日本血吸虫后血浆中宿主源循环microRNAs变化研究
2015-11-19王宇清刀金威朱丽慧杜晓利刘金明程国锋
王宇清,刀金威,朱丽慧,杜晓利,陆 珂,李 浩,刘金明,程国锋
(中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海200241)
兔感染日本血吸虫后血浆中宿主源循环microRNAs变化研究
王宇清,刀金威,朱丽慧,杜晓利,陆 珂,李 浩,刘金明,程国锋
(中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海200241)
循环性microRNAs不仅参与生命体的重要活动调控,还有望成为某些疾病诊断的新型标志分子。为深入探讨宿主与血吸虫之间的相互作用机制并发现新型诊断标志分子,我们对前期获得的感染和未感染新西兰大白兔血浆小RNA的Solexia测序结果进行生物信息学分析,对差异表达的microRNAs用实时定量PCR进行验证,同时对这些差异表达的microRNAs的靶基因进行了分析。在剔除虫源性序列后,我们发现了感染和未感染日本血吸虫的新西兰大白兔体内的循环性宿主源microRNAs 173条,选取了10个差异表达的microRNAs利用实时定量PCR进行验证分析,结果表明所选取的10个microRNAs表达与Solex测序结果一致。靶基因的预测与分析结果表明感染血吸虫兔血浆中差异表达microRNAs的靶基因主要参与细胞进程、代谢调控、生命调控、发育进程等生命进程调控。本研究结果为深入开展日本血吸虫与宿主的互作及其寄生的分子机理提供了基础。
日本血吸虫;循环microRNA;靶基因;功能分析
microRNAs(miRNAs)早在1990年就在线虫体内被发现[1-4],随后大量研究表明不同物种和组织中均有miRNAs参与细胞功能调控[5,6]。最近研究表明miRNAs可在人体的血液、淋巴液和尿液中存在,且这些miRNAs可通过循环系统,递送到机体的其他组织和器官,进而发挥生物学调控功能[7-9]。因此,循环性miRNAs分子不仅可成为某些疾病诊断的新型标志分子,也可能成为疾病病理损害的关键调控分子,故而循环miRNAs本身以及其所调控的靶基因都可能作为潜在的治疗疾病的靶位点。
我们课题组前期研究表明日本血吸虫感染宿主后可在宿主血浆中检测到血吸虫特异miRNAs(Bantam、miR-3479、miR-10、miR-3096和miR-0001)[10]。随后,Hoy等[11]研究也表明感染曼氏血吸虫的小鼠血清中存在血吸虫特异的miRNAs(miR-277、miR-3479-3p和bantam)。He等[12]在感染了日本血吸虫的血清宿主中发现了miR-223表达量升高,经过药物治疗后其表达水平降低,提示了miR-223可能是日本血吸虫诊断标志物。Zhu等[13]进一步研究表明在感染了日本血吸虫的小鼠血浆中有明显的循环性miRNAs的变化,特别是miR-706以及miR-134-5p,并预测其参与Caspase-3、Creb1基因的调控,提示循环性microRNAs可能在血吸虫的病理损害中发挥重要作用。故而,针对感染日本血吸虫后宿主循环性miRNAs的研究不仅可发现血吸虫病诊断新的标志分子,而且可从miRNAs视角阐述病原与宿主相互作用机制[14]。为此,我们利用生物信息学对前期获得的新西兰大白兔感染血吸虫后血浆miRNAs的Solexia测序结果进行分析,研究在新西兰大白兔体内与血吸虫感染相关的宿主源循环性miRNAs,并预测这些miRNAs所调控的靶基因及其功能。
1 材料和方法
1.1 材料
1.1.1 实验动物以及生物耗材 本研究的动物相关实验由中国农业科学院上海兽医研究所动物保健及伦理委员会许可。本研究所用的钉螺由上海兽医研究所钉螺室提供,新西兰大白兔购自上海罗泾飞达实验动物公司。实时定量PCR所用的引物均由Sunny有限责任公司负责合成。
1.1.2 生化试剂及仪器 PCR Mix(2X)、PrimeScript RT reagent Kit(DRRO37A)和SYBR Premix Ex Taq(RR420A)购自宝生物工程(大连)有限公司(大连TaKaRa公司);血浆小RNA提取试剂盒mirVana Protein and RNA Isolation System购自Invitrogen公司;PCR扩增仪购自伯乐生命医学产品(上海)有限公司;离心机和Eppendorf 快速实时荧光定量PCR仪购自Eppendorf中国有限公司。
1.1.3 Solexia测序数据库 本文分析的感染血吸虫后新西兰大白兔血浆miRNA数据库P1和P2以及未感染血吸虫的新西兰大白兔血浆miRNA数据库为本实验室通过建库后测序获得[11],其中P1为感染后14、28 d的新西兰大白兔混合血浆中的小RNA库;P2为感染后10、14、28、32 d的新西兰大白兔混合血浆的小RNA库。
1.2 方法
1.2.1 血液收集、血浆RNA的提取和小RNA库的构建血液材料的收集、血浆的分离以及血浆RNA的提取和小RNA库的构建参照文献[11]。
1.2.2 感染和未感染新西兰大白兔宿主源循环小RNA分析 将Solexia测序数据库P1和P2以及未感染血吸虫的新西兰大白兔血浆miRNA数据库数据利用SOAP(http∶//soap.genomics.org.cn/soap1/)与家兔基因组数据库(ftp∶//ftp.ensembl.org/pub/release-65/fasta/ oryctolagus_cuniculus)进行匹配,列出与基因组完全匹配的序列。在Rfam(Version 10.1,http∶//rfam. xfam.org/)中收集的非编码RNA数据库与NCBI中GeneBank数据(http∶//www.ncbi.nlm.nih.gov/)进行BLAST分析,剔除所有与血吸虫序列同源的序列后对这些小RNA进行分类,比如rRNA,tRNA,snRNA以及snoRNA,对那些没有匹配的小RNA进一步与miRbase(http∶//www.mirbase.org/,Vision 20)进行比对,以确定其中哪些是已知的miRNA或是同源的miRNA,并将没有注释的小RNAs进行新miRNA的预测。然后将感染日本血吸虫的新西兰大白兔血浆的测序结果与未感染的大白兔血浆的小RNA测序结果进行比较分析,找到P1和P2中特有的小RNA。
1.2.3 MicroRNAs靶基因的预测和功能分析 利用miRWalk 在线工具(http∶//www.umm.uni-heidelberg. de/apps/zmf/mirwalk/)预测miRNAs的靶基因;利用DAVID(http∶//david.abcc.ncifcrf.gov/)数据库分析其靶基因的功能。
1.2.4 差异miRNAs的qRT-PCR验证分析 将新西兰大白兔感染了约1000条日本血吸虫尾蚴,参考文献[11]方法收集感染日本血吸虫后7、14、28、32 d的新西兰大白兔血液并提取血浆RNA,反转录所使用的特异性引物以及实时定量PCR引物见表1。实时定量PCR通用下游引物:5'-GCAGGGTCCGAGGTATTC-3'。逆转录所使用的反应体系:5×PrimeScriptTMBuffer (for Real Time)2μL、PrimeScriptTMRT Enzyme MixⅠ0.5 μL、Specific primer 0.5 μL、Total RNA 25 ng,然后用RNase free H2O 补充至10 μL;反应条件:42℃ 30 min,85℃ 5 s,4℃保存。实时定量PCR的反应体系:cDNA 1μL,SBYR®Premix Ex TaqTMⅡ(2X)10 μL,上游特异性引物0.5 μL,通用下游引物0.5 μL,然后用RNase free H2O 定容至20 μL;反应条件:95℃ 30 s,然后(95℃ 5 s,60.5℃ 30 s)45个循环。

表1 逆转录和实时定量PCR引物Table 1 Primers for reverse PCR and Real-Time PCR
2 结果
2.1 感染和未感染兔差异表达循环性宿主源已知小
RNA 将两个生物学重复P1和P2的Solexa数据分别与未感染的阴性对照血浆小RNA测序结果比较分析。结果表明:P1中有721条已知miRNAs,P2中有1101条。其中,在P1和P2两次实验中共有的miRNAs 为173条。进一步分析表明感染后有64个已知miRNAs在P1和P2呈现差异表达(差异倍数在两倍以上),其中12个下调,52个上调(图1)。
2.2 感染后宿主源特异性循环miRNAs分布 将P1与P2分别与未感染的家兔血浆小RNAs库进行比对,获得感染后特有的小RNAs并进行分类分析(图2A和2B)。对未注释的特异性的小RNA进行新miRNAs预测,结果表明P1有191条新miRNAs,P2中有190条新miRNAs。
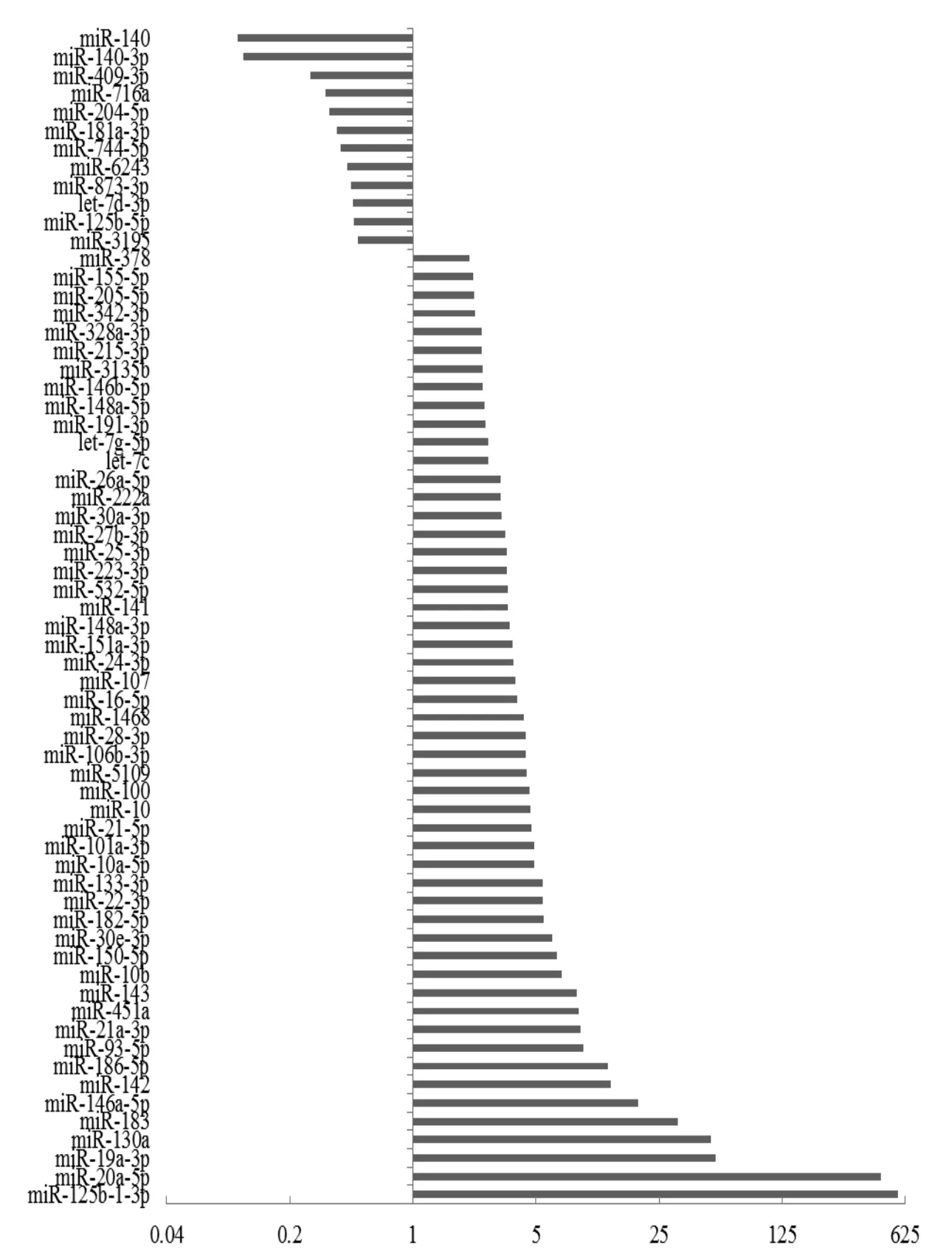
图1 宿主血浆中已知miRNAs的差异表达Fig. 1 Differential levels of circulating miRNAs associated with Schistosoma japonicum
2.3 感染兔特异性循环miRNAs靶基因预测 对感染兔特异性表达的宿主源循环miRNAs以人的数据库为参考进行靶基因预测,按五个软件都能预测到的靶基因为标准,结果在124个miRNAs中,共获得了18个miRNAs以及它们所调控的共416条靶基因(表2)。
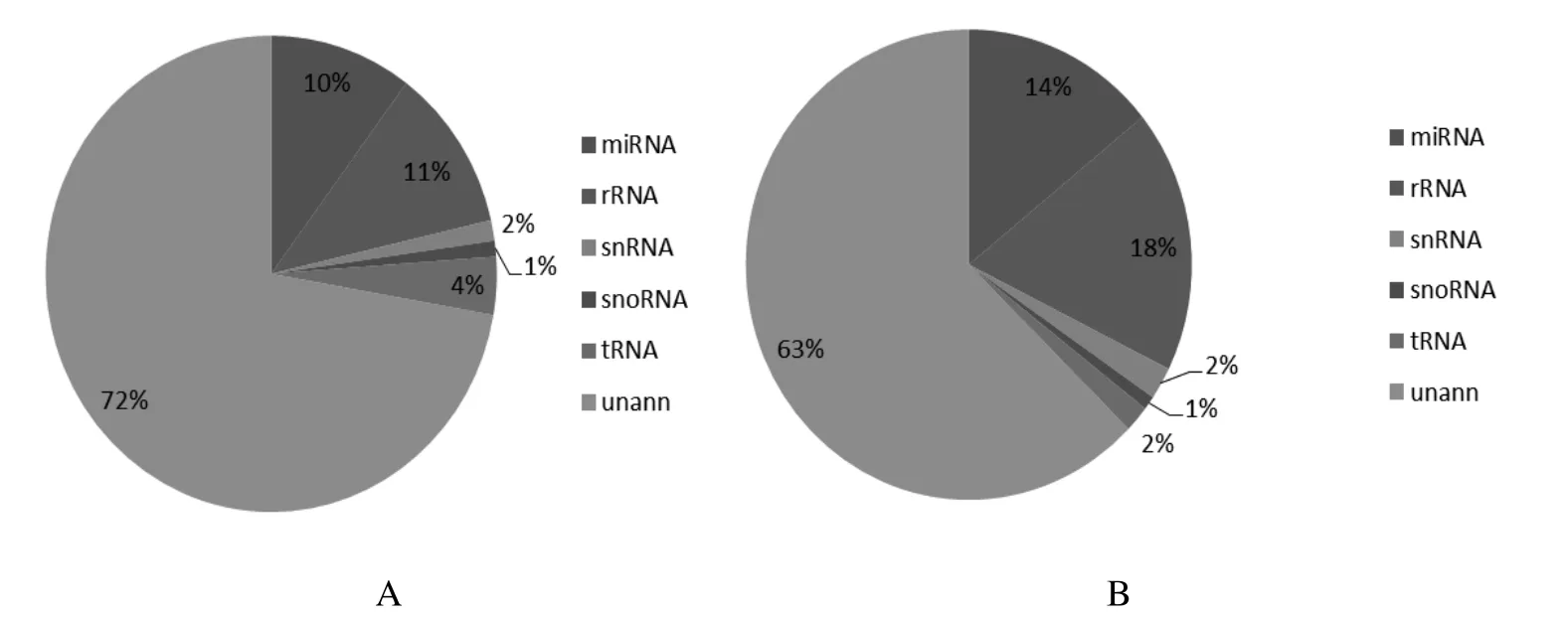
图2 P1(A)和P2(B)中宿主源特异性小RNA分布Fig. 2 The distribution of specifi c miRNAs from P1(A) and P2(B)
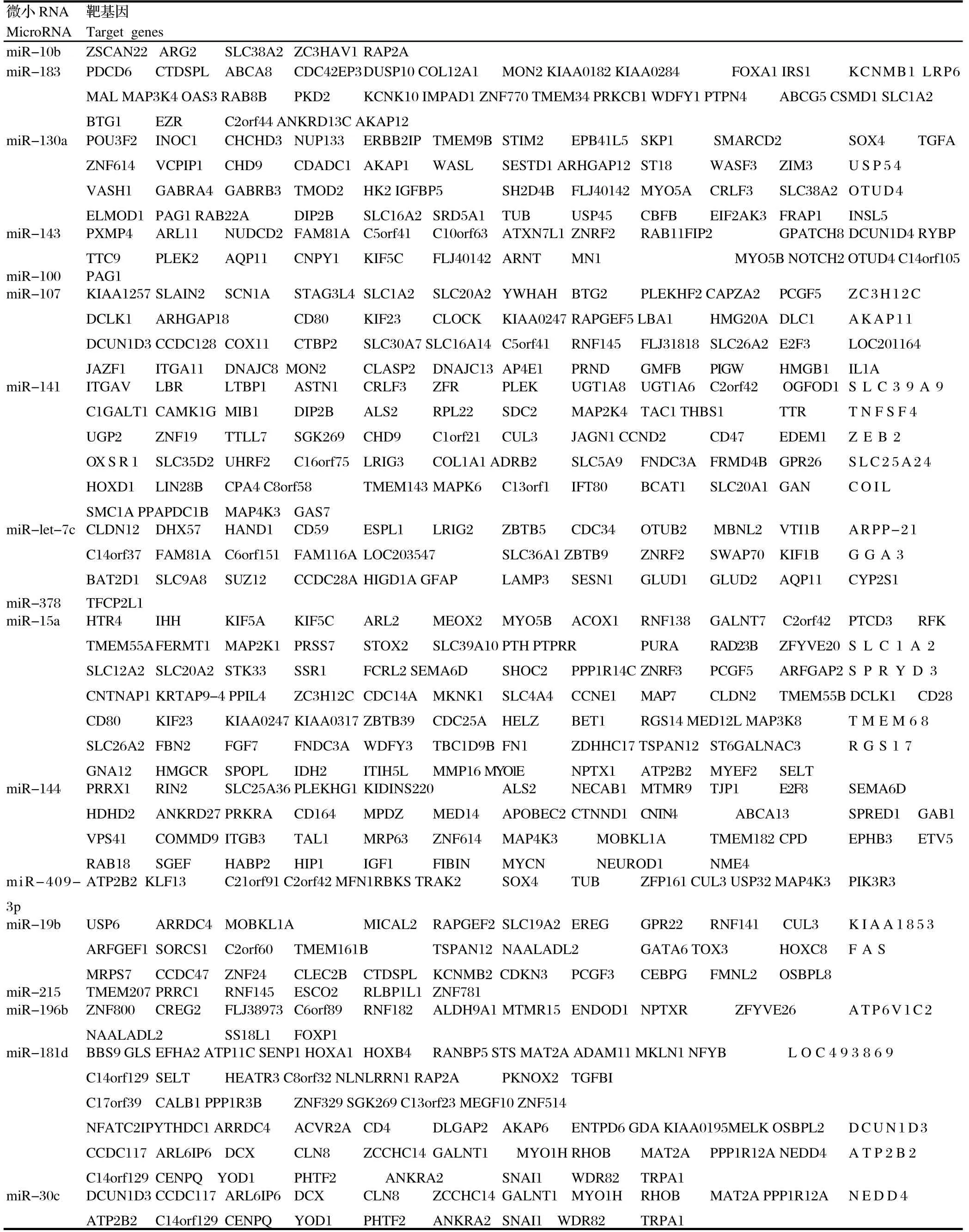
表2 差异表达的miRNAs靶基因预测Table 2 Target genes prediction for differentially expressed miRNAs
2.4 靶基因功能的生物信息学分析 利用David数据库提供的在线工具Pather进行了靶基因GO聚类分析,结果他们表明主要参与包括细胞进程、代谢调控、生命调控、发育进程等生物学进程。分子功能分析表明他们主要参与结合、催化活性等分子功能(图3A、B)。KEGG代谢调控分析表明,这些miRNAs主要与信号调节通路相关,13个靶基因参与了整联素信号通路,9个参与了p53 通路,8个参与了促性腺释放激素受体通路等(图4)。
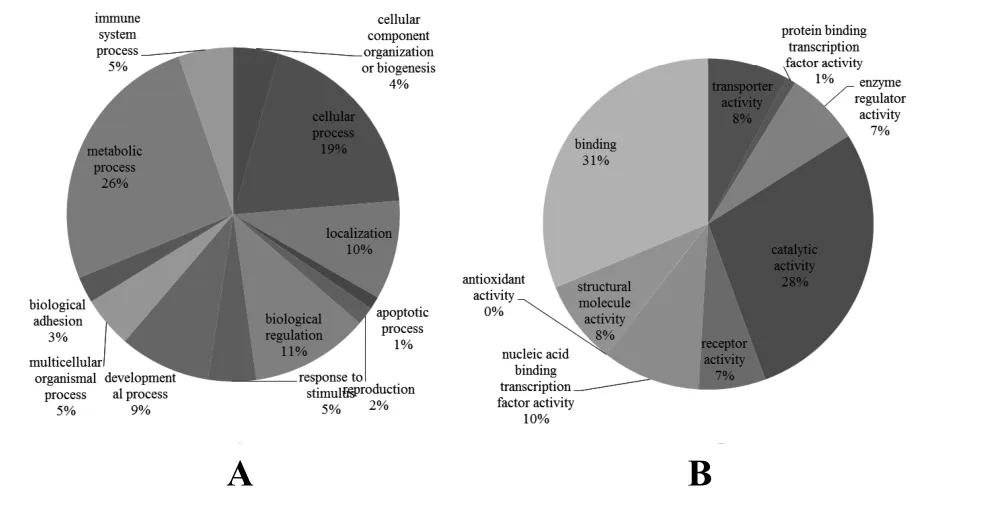
图 3 生物学进程GO聚类分析(A)和分子功能GO聚类分析(B)Fig. 3 GO analysis of biological process (A) and molecular function (B)
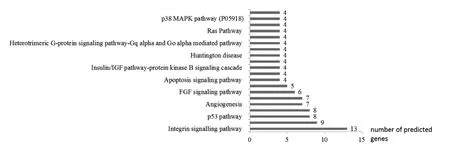
图4 KEGG代谢通路分析Fig.4 The KEGG pathway analysis
2.5 qRT-PCR的验证 将选取的10个(9个上调和1个下调miRNAs)与血吸虫感染相关的宿主源miRNAs利用qRT-PCR进行验证分析。结果表明这些miRNAs的表达变化均与Solexia测序结果相一致(图5)。
3 讨论
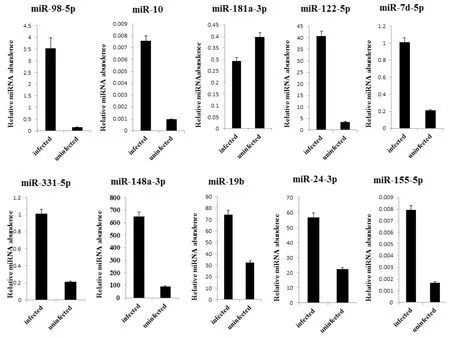
图5 差异表达的miRNAs的qRT-PCR验证分析Fig. 5 The qRT- PCR result of selected differentially expressed miRNAs
宿主在感染了日本血吸虫之后其体内会发生一系列的变化,其中宿主体内循环miRNA的变化就是其中之一[12,15]。通过生物信息学分析我们筛选出感染兔和未感染兔差异表达的miRNAs以及特异表达的miRNAs,总共64条miRNAs,其中上调52条,下调12条。通过实时定量PCR,进一步验证了一些miRNAs的确在感染后宿主体内存在差异表达。对这些miRNAs进行了靶基因的预测,发现其中18个miRNA的预测靶基因共416个。Zhu等[13]研究了感染日本血吸虫后小鼠体内循环性miRNAs的变化,发现总共有11个miRNAs下调,25个miRNAs上调,其中miR-125b-1-3p在感染后上调,但本研究发现它在感染血吸虫的新西兰大白兔中为下调,二者刚好相反,提示宿主感染血吸虫后循环性miRNAs可能存在宿主间的差异性,这有待后续研究进一步查明。
为了更好的推测这些miRNAs的功能,我们预测了miRNAs的靶基因并进行了KEGG代谢通路分析,发现这些差异表达的循环性miRNAs主要参与许多重要的信号传导调控,比如p38 MAPK、P53 pathway等,这些信号通路与多种疾病的发展进程密切相关。测序结果和qRT-PCR验证均表明在感染日本血吸虫的新西兰大白兔的循环性miRNAs中miR-10是上调的,有研究指出在多种癌症病理过程中miR-10是上调的,比如miR-10a在结肠癌中被发现,miR-10b在胰腺癌和乳腺癌中被发现[16]。因此对感染日本血吸虫的宿主体内循环microRNAs的研究,不仅为发现血吸虫病的新标志物提供线索,进而被应用于诊断,同时也加深了我们对宿主与寄生虫之间相互作用机制的理解。
[1]Lee R C, Feinbaum R, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5)∶843-854.
[2]Lagos-Quintana M, Rauhut R, Lendeckel W, et al. Identification of novel genes coding for small expressed RNAs[J]. Science, 2001, 294(5543)∶ 853-858.
[3]Lau N C, Lim L P, Weinstein E G, et al. An abundant class of tiny RNAs with probable regulatory roles in Caenorhabditis elegans[J]. Science, 2001, 294(5543)∶858-862.
[4]Ambros V, Lee R C, Lavanway A, et al. MicroRNAs and other tiny endogenous RNAs in C. elegans[J]. Curr Biol,2003, 13(10)∶ 807-818.
[5]Bartel D P. MicroRNAs∶ genomics, biogenesis,mechanism, and function[J]. Cell, 2004, 116(2)∶ 281-297.
[6]Friedman R C, Farh K K, Burge C B, et al. Most mammalian mRNAs are conserved targets of microRNAs[J]. Genome Res, 2009, 19(1)∶ 92-105.
[7]Taylor D D, Gercel-Taylor C. MicroRNA signatures of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer[J]. Gynecol Oncol, 2008, 110(1)∶ 13-21.
[8]Valadi H, Ekström K, Bossios A. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J]. Nat Cell Biol, 2007,9(6)∶ 654-659.
[9]Denzer K, Kleijmeer M J, Heijnen H F, et al. Exosome∶from internal vesicle of the multivesicular body to intercellular signaling device[J]. J Cell Sci, 2000,113Pt19∶ 3365-3374.
[10]Cheng G, Luo R, Hu C, et al. Deep sequencing-based identification of pathogen-specific microRNAs in the plasma of rabbits infected with Schistosoma japonicum[J]. Parasitology, 2013, 140(14)∶ 1751-1761.
[11]Hoy A M, Lundie R J, Ivens A, et al. Parasite-Derived MicroRNAs in Host Serum As Novel Biomarkers of Helminth Infection [J]. Plos Negl Trop Dis, 2014, 8(2)∶85-88.
[12]He X, Sai X, Chen C, et al. Host serum miR-223 is a potential new biomarker for Schistosoma japonicum infection and the response to chemotherapy [J]. Parasit Vectors, 2013, 6∶ 272.
[13]Zhu L, Dao J, Du X, et al. Altered levels of circulating miRNAs are associated Schistosoma japonicum infection in mice[J]. Parasites Vectors, 2015, 8∶196.
[14]Xue X, Sun J, Zhang Q, et al. Identification and characterization of novel microRNAs from Schistosoma japonicum[J]. PLoS One, 2008, 3(12)∶ e4034.
[15]Liu F, Lu J, Hu W, et al. New perspectives on hostparasite interplay by comparative transcriptomic and proteomic analyses of Schistosoma japonicum[J]. PLoS Pathog, 2006, 2(4)∶ e29.
[16]Lund A H. miR-10 in development and cancer[J]. Cell Death Differ, 2010, 17(2)∶ 209-214.
STUDIES ON RABBIT CIRCULATING MICRORNAS ASSOCIATED WITH SCHISTOSOMA JAPONICUM INFECTION
WANG Yu-qing, DAO Jin-wei, ZHU Li-hui, DU Xiao-li, LU Ke, LI Hao,LIU Jin-ming, CHENG Guo-feng
(Key Laboratory of Animal Parasitology, Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
Circulating microRNAs are not only involved in the regulation of many life processes, but also considered to be a novel class of biomarkers for diagnosis of diseases. To better understand the interaction mechanisms between hosts and Schistosoma japonicum,the microRNA populations in infected New Zealand rabbits were further analyzed based on our previous Solexia data from infected and uninfected rabbits. Total 173 rabbit microRNAs associated with Schistosoma japonicum infection were obtained, from which 10 microRNAs different between infected and uninfected rabbits were verifi ed in a qRT-PCR. Bioinformatical analysis also indicated that the target genes of these altered microRNAs were putatively involved in many biological processes such as cellular process, metabolic process, biological regulation, developmental process and catalytic activity. The results obtained here provided a basis for further research on interaction between hosts and schistosomes.
Schistosoma japonicum; circulating microRNAs; target genes; functional analysis
S852.735
A
1674-6422(2015)05-0058-07
2015-05-22
国家自然科学基金(30901068)
王宇清,男,硕士研究生,预防兽医学专业
程国锋,E-mail:chenggfeng@yahoo.com.cn
