平滑肌细胞与小肠黏膜下层体外复合培养分析*
2015-04-15魏红芳胡成栋张恩录高爱芹李东风
王 飞,魏红芳,胡成栋,张恩录,高爱芹,王 瑞,李东风
(河北省邯郸市中心医院:1.骨二科;2.麻醉科 056001)
·临床研究·
平滑肌细胞与小肠黏膜下层体外复合培养分析*
王 飞1,魏红芳2,胡成栋1,张恩录1,高爱芹1,王 瑞1,李东风1
(河北省邯郸市中心医院:1.骨二科;2.麻醉科 056001)
目的 对平滑肌细胞与小肠黏膜下层体外复合培养进行分析研究。方法 将平滑肌细胞与小肠黏膜下层培养方式作为实验组,将传统平滑肌细胞培养方式作为对照组,通过内皮细胞与平滑肌细胞分离与培养、种植与拟生态环境下培养以及组织工程化血管的自体移植等步骤,对比分析两组培养出的细胞数量情况。结果 实验组培养细胞的数量为(36.42±11.01)×105,明显高于对照组中培养细胞的数量(28.16±10.14)×105,差异有统计学意义(P<0.05)。结论 应用平滑肌细胞与小肠黏膜下层体外复合培养技术对平滑肌细胞进行培养后,其细胞数量明显高于常规培养方法,可以在临床上广泛应用。
平滑肌细胞; 小肠黏膜下层; 外复合培养
目前全世界每年大约有20万例周围血管移植,自体血管移植是迄今最理想的替代物,但其应用受到一定限制[1]。小肠黏膜下层(SIS)是天然细胞外基质类生物衍生材料,通常由猪小肠制备,人工处理后的SIS主要由Ⅰ、Ⅲ型胶原蛋白及少量Ⅴ、Ⅵ胶原构成,制备的SIS厚度约80 μm,具有无免疫原性、抗微生物活性、优良的生物力学性能,并能促进组织再生,是组织工程细胞外基质很有前途的生物材料[2-3]。以异种SIS为细胞外基质预构成三维管道,将内皮细胞与平滑肌细胞在三维管道上联合培养,复合构建组织工程化血管的设想,其可行性值得探索。
1 材料与方法
1.1 试剂与仪器 本研究中采用的胎牛血清、高糖DMEM培养基及胰蛋白酶等材料均由美国Gibco公司生产,北京中杉金桥生物技术有限公司生产的鼠抗人A-肌动蛋白单克隆抗体,日本Sanyo公司生产的CO2培养箱,日本Olympus公司生产的倒置相差显微镜,日本Hitach公司生产的透射电镜等仪器。
1.2 方法
1.2.1 猪SIS的制备与检测 (1)制备:取健康猪的空肠长约10 cm,冲净,机械法去除外面的浆膜层与肌层,翻转后去除黏膜层,纵向切开黏膜下层基质,浸泡于100 mmol/L乙二胺四乙酸与10 mmol/L氢氧化钠(pH11~12)溶液中,去离子水冲净,再浸泡于1 mol/L盐酸与1 mol/L氯化钠(NaCl)溶液中6~8 h,去离子水冲净,在含1 mol/L NaCl的磷酸盐缓冲液(PBS)(pH7.0~7.4)中浸泡16 h,去离子水冲净,在PBS中浸泡2 h,去离子水冲洗2 h,0.2%过氧乙酸(含5%无水乙醇)消毒30 min,在含0.05%叠氮化钠的PBS溶液清洗2 h,用2.5×10-1Gyγ射线照射。(2)光化学交联剂固定处理后[3],进行光镜、扫描电镜及免疫组化检测,验证其脱细胞情况。(3)由于SIS黏膜面较浆膜面有更低的孔隙率,因此将SIS黏膜面朝内包绕在细玻璃棒上,于显微镜下应用9/0无创线缝合出直径为2 mm长约20 mm管状基质,在体外检测其生物力学性能,包括平均破裂压、弹性模量及纵向的屈服应力。处理后的管状脱细胞基质以玻璃化法保存。
1.2.2 猪SIS基质抗原性检测 将处理后的猪小肠黏膜细胞基质,切取1 cm2植入家兔皮下组织,7 d后取材,于光镜、免疫组化检测脱细胞基质在家兔体内的免疫反应情况。如有条件可行单克隆抗体检测家兔单核淋巴细胞黏附蛋白(CD18)。
1.2.3 内皮细胞与平滑肌细胞分离与培养 (1)无菌条件下取家兔自体大隐静脉,去污,胶原酶灌流消化,采集内皮细胞进行传代培养,应用荧光显微镜或细胞流式仪进行细胞鉴定;(2)类似方法对平滑肌细胞进行分离、培养与鉴定。
1.2.4 内皮细胞与平滑肌细胞种植与拟生态环境下培养 (1) 取传代培养2~3代的内皮细胞,胰蛋白酶消化、离心漂洗后,种植内皮细胞于1 cm2的猪SIS基质上,培养鉴定内皮细胞能否在此基质上成活。(2)拟生态环境动态旋转反应器的制备:血管细胞在生理条件下,受到流体切变应力、管壁舒缩产生的牵张应力及静水压等应力,这些应力环境对于血管细胞的形态、增殖、极性及基质构成与结构有重要影响。参考相关资料,制备简便有效、适于血管灌注培养的动态旋转反应器。(3)内皮细胞与平滑肌细胞种植:取2 cm制备好的直径为2 mm的管状SIS基质置于反应器内,接种内皮细胞,在37 ℃与5% CO2条件下孵化,动态培养液灌注,第2天用微型注射器将平滑肌细胞多点随机注射入管状脱细胞基质内,继续动态培养四周。培养期间定期进行细胞计数器计数、光镜、电镜及免疫组化检测基质内细胞量及活性。
1.2.5 组织工程化血管生物学及生物力学性能检测 (1)应用乙酰胆碱、氯化钾、硝普钠等药物,比较正常股动脉与工程化血管间生物学方面的差别。(2)检测正常股动脉与工程化血管平均破裂压、弹性模量及纵向的屈服应力,比较SIS基质、正常股动脉、工程化血管三者间生物力学方面的差别。(3)通过光镜、电镜及免疫组化检测,比较正常股动脉与工程化血管二者形态学方面的差别。
1.2.6 组织工程化血管的自体移植 (1)管状SIS基质种植细胞后2周,经鉴定细胞成活后,分别取自体股动脉及管状SIS基质作为对照,行工程化血管移植(均不行全身抗凝药物治疗),于1、2、4、8周定期取材,应用乙酰胆碱、氯化钾、硝普钠等药物,比较正常股动脉与工程化血管间生物学方面的差别;并行大体、光镜、电镜及免疫组化检测,观察其血管通畅率、形态学及免疫相容性,以确定其可行性。(2)取管状SIS基质行血管替代,以自身作为对照(均不行全身抗凝药物治疗),定期取材检测,在血管通畅率、形态学及免疫相容性等方面,与组织工程血管相比较。
1.3 观察指标 分别观察两组培养方式和培养细胞的数量,并记录分析。
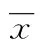
2 结 果
分别对细胞进行培养,实验组培养细胞的数量为(36.42±11.01)×105,明显高于传统平滑肌细胞培养方式培养细胞的数量(28.16±10.14)×105,差异有统计学意义(P<0.05)。
3 讨 论
近几年来,随着医学技术水平的不断发展与提高,人们对生物细胞培养技术的要求日益增加,平滑肌细胞是人体十分重要的细胞之一,其临床上应用十分广泛,但在平滑肌细胞的培养过程并不是十分简单[4]。因此,本研究采用的SIS管状基质与平滑肌细胞培养相结合的复合培养过程,是经三维拟生理环境培养,复合构建组织工程化血管,故其临床效果十分显著,明显弥补了传统平滑肌细胞培养过程中的不足之处,是一种十分有效的细胞培养方法[5-6]。用猪SIS管状基质作为细胞种植与培养的三维支架,其优良的组织结构相似性与低廉的价格,是人工材料所难以比拟的,探索其可行性,为小管径血管支架寻找一种新材料[7]。异种SIS管状基质与自体内皮细胞、平滑肌细胞复合构建组织工程化血管,在动物体内、外对其生物学及生物力学特性进行对比研究,探索其作为小血管移植的可行性[8]。寻找口径小于4 mm小血管的移植替代物,已成为骨科研究的一个难点,通过研究异种SIS管状基质在体外拟生态环境下,预内皮化培养复合构筑组织工程化血管的可行性,以探索适于小血管移植的替代物[9-10]。临床上SIS血管较ePTFE有更强的抗感染力,其提取液能够抑制多种细菌生长,与此同时,SIS有比自体血管更强的再生能力。虽然血管顺应性无明显变化,但相应的时间后SIS移植物壁厚较原来增厚10倍以上,随着SIS蜕变与吸收的同时,应按照血管生理与力学的要求不断改造[11-12]。
本研究结果显示,分别对细胞进行培养,平滑肌细胞与SIS培养方式培养细胞的数量为(36.42±11.01)×105,明显高于对照组中培养细胞的数量(28.16±10.14)×105,差异有统计学意义(P<0.05)。研究结果表明,在应用平滑肌细胞与SIS培养复合培养的过程中,明显提高了平滑肌细胞的培养数量,临床意义十分重大[13]。
综上所述,临床上采用平滑肌细胞与SIS体外复合培养技术对平滑肌细胞进行培养后,其细胞数量明显高于常规培养方法,较大程度地提高了平滑肌细胞的培养数量,安全可靠,可以在临床上广泛应用。
[1]Campbell JH,Campbdi GR.Feasibility of small intestinal submucosa acellular matrix as vaginal smooth muscle cell carrier[J].J Clini Rehabilita Tissue Engineer Res,2010,14(47):8741-8746.
[2]黄晓雷,罗仪,李元涛,等.丙泊酚对人子宫平滑肌细胞Ca2+跨膜内流和肌浆网钙释放功能的影响[J].华中科技大学学报:医学版,2011,40(3):357-360.
[3]王军胜,王栓科,陈兴礼,等.骨髓间充质干细胞与小肠黏膜下层复合构建组织工程骨膜[J].中国组织工程研究与临床康复,2011,15(21):3801-3804.
[4]张开伟,肖睿,段宏,等.碱性成纤维细胞生长因子对许旺细胞在小肠黏膜下层支架上黏附及增殖的影响[J].中国组织工程研究与临床康复,2010,14(21):3827-3831.
[5]Wang JJ,Liu XY,Li XS.In vivo osteogenesis of bionic periosteum constructed by adipose-derived stem cells seeded onto small intestinal submucosa[J].Chinese J Tissue Engineer Res,2012,16(3):426-430.
[6]李燕,张春来,卢峰,等.高同型半胱氨酸血症对平滑肌细胞的氧化损伤[J].首都医科大学学报,2012,33(2):251-254.
[7]杨安宁,王菊,杨晓玲,等.同型半胱氨酸引起平滑肌细胞LDLR启动子区DNA甲基化改变的位点分析[J].中国药理学通报,2012,28(11):1507-1510.
[8]兰海,黄富国,杨志明,等.前脂肪细胞在小肠黏膜下层的生长与增殖[J].中国组织工程研究与临床康复,2010,14(25):4599-4602.
[9]张开刚,张月东,王玫.脂肪干细胞与小肠黏膜下层构建仿生骨膜的体内成骨[J].中国组织工程研究,2012,16(3):426-430.
[10]符培亮,张雷,吴宇黎,等.小肠黏膜下层与滑膜间充质干细胞的组织相容性[J].中国组织工程研究,2013,17(47):8202-8208.
[11]王鸾,王效杰.小肠黏膜下层用作诱导组织再生及应用[J].沈阳医学院学报,2013,15(2):118-119.
[12]杨浩,朱晓松,李世和,等.脂肪基质干细胞小肠黏膜下层双面复合的体外成软骨诱导[J].中国组织工程研究与临床康复,2011,15(16):2871-2876.
[13]何艳中,王震宇,郑景浩,等.小肠黏膜下层复合骨髓间充质干细胞体外构建心肌组织薄片的实验研究[J].上海交通大学学报:医学版,2012,32(1):53-58.
河北省邯郸市科技计划项目(1223108090-3)。
10.3969/j.issn.1672-9455.2015.03.039
A
1672-9455(2015)03-0383-02
2014-08-09
2014-10-12)
