亚热带天然林4 种树木细根生物量垂直分布和主要功能性状的差异1)
2015-04-03邹斌蔡飞郑景明戴伟
邹斌 蔡飞 郑景明 戴伟
(北京林业大学,北京,100083)
细根在土壤养分、水分和碳循环中扮演重要角色,森林生态系统中约20%的碳循环发生在地上部分,超过50%的碳循环发生在地下细根的快速周转中[1-4]。以往生态学研究中,对细根的定义为:根直径≤2 mm 或者≤1 mm 的根被称为细根。这种分级方法往往忽略了树种间的差异和细根作为主要吸收器官的功能特性。按照根序分级可以较好的反应细根的功能特性,不同级序的细根因解剖结构差异,在养分吸收、传导等方面有很大差异,在生物地球化学循环中的作用也有所不同[5]。D. Guo et al[6]对中国温带23 个树种的解剖研究发现,1 级根具有完整皮层,是典型的吸收根,4~5 级根则具有连续的次生木质部和木栓层,是典型的运输根,而2 ~3 级根则属于过渡阶段的根。一些的研究也发现不同序级的细根元素含量等性状差异显著[7-8]。因此,采用根序分级研究细根的垂直分布和功能性状更为合理。
与叶片类似,细根的功能性状对植物的生长和分布具有重要意义。根长是细根性状的一个重要指标,根长对细根吸收水分和养分功能有重要影响。细根直径可能对细根寿命有一定的影响。Gu J et al[9]发现,在温带森林中,细根直径、根序与细根的寿命呈现出正相关关系。而J. M. Withington et al[10]对温带树种的研究中,没有发现细根直径与细根寿命的相关关系。细根表面积是代表细根吸收功能的一个重要指标。植物的比根长和组织密度可以反映植物的生理和生长策略。较短的细根寿命可以代表植物的快速生长,而较高的组织密度则代表细根的寿命较长[11-12]。M. G. Tjoelker et al[13]在草地根系的研究指出,根系直径和组织密度的增加表明植物将更多的碳投入到单位面积的根系组织中,延长了根系的寿命。
亚热带天然林是独特的森林生态系统类型,亚热带天然林中有不同种类、年龄、物候型的物种共存,而各类植物的地下根系性状是否存在差异,这种差异能否有助于解释物种共存机制?随着树木年龄的增长,细根的生物量和其他功能性状是否会有变化?这些问题尚没有很好的解答。目前对亚热带地区不同树种和群落类型的细根研究主要集中在对细根时间动态的跟踪监测。廖丽平等[14]对火力楠和杉木的研究表明,细根生物量和地上部分生长的节律一致。李树战等[15]对四种人工林群落的细根的生物量和时空动态进行了研究,发现活细根生物量在一年中的变化趋势呈现出“单峰型”,死细根生物量则呈不规则波动。黄锦学等[16]对细柄阿丁枫和米槠群落细根的研究也得到相似的结果。探讨亚热带天然常绿落叶混交林中树种和树龄对细根垂直分布和功能性状的影响尚少。为此,本研究以亚热带天然常绿落叶混交林为研究区域,对不同树龄的刨花楠(常绿,Machilus pauhoi)、山矾(常绿,Symplocos sumuntia)、山乌桕(落叶,Sapium discolor)和油桐(落叶,Vernicia fordii)的细根生物量的垂直分布以及细根根长、直径、表面积和组织密度进行研究。为了解亚热带地区植被的细根动态和细根生物量的估测提供依据。
1 试验地概况
试验样地设置在江西省分宜县大岗山自然保护区(东经114°30′~114°45′,北纬27°30′~27°50′)内。该地区属亚热带湿润气候区,具有日照充足、雨量充沛的特点。年平均气温16.7 ℃;1 月气温最低,平均气温-5.3 ℃;7 月气温最高,平均气温26.5 ℃。年降水量为1 591 mm,降水主要集中在4—6 月份。本地区土壤属地带性低山丘陵红壤、黄壤类型及其亚类的分布区,其中黄壤分布最广,分布海拔为300~700 m。植物区系组成和地理成分相当丰富,以天然常绿阔叶林为地带性植被,其他植被类型有:落叶阔叶林、各类针阔混交林、毛竹林以及大面积杉木人工林。
2 研究方法
2013 年8—9 月,在常绿落叶混交林中,设定20 m×30 m 的固定样地,选取地带性树种刨花楠、山矾、山乌桕和油桐作为研究对象。按照树龄大小,每个树种选取6 棵,共24 棵,对不同树种不同树龄的样木进行细根取样(见表1)。
细根的分级采用K. S. Pregitzer et al[5]的方法:最远端的具根尖的根定义为1 级根,其母根定义为2 级,2 级根的母根定为3 级,依次类推区分至5 级根。细根生物量的获取采用土钻法。2013 年的8—9 月用内径71 mm 的土钻,在距树0.5 ~1.0 m 处随机钻取3 个土芯,土芯分为4 层(0 ~10、>10 ~20、>20~30 和>30 ~40 cm),共取72 个土芯。实验室中,小心收集各个土芯中较为完整的侧根,将1 级和2 级细根剪下,选取10 根进行性状分析,其余的细根在80 ℃烘箱中烘48 h 至恒质量,后用电子天平(±0.000 1 g)称质量。
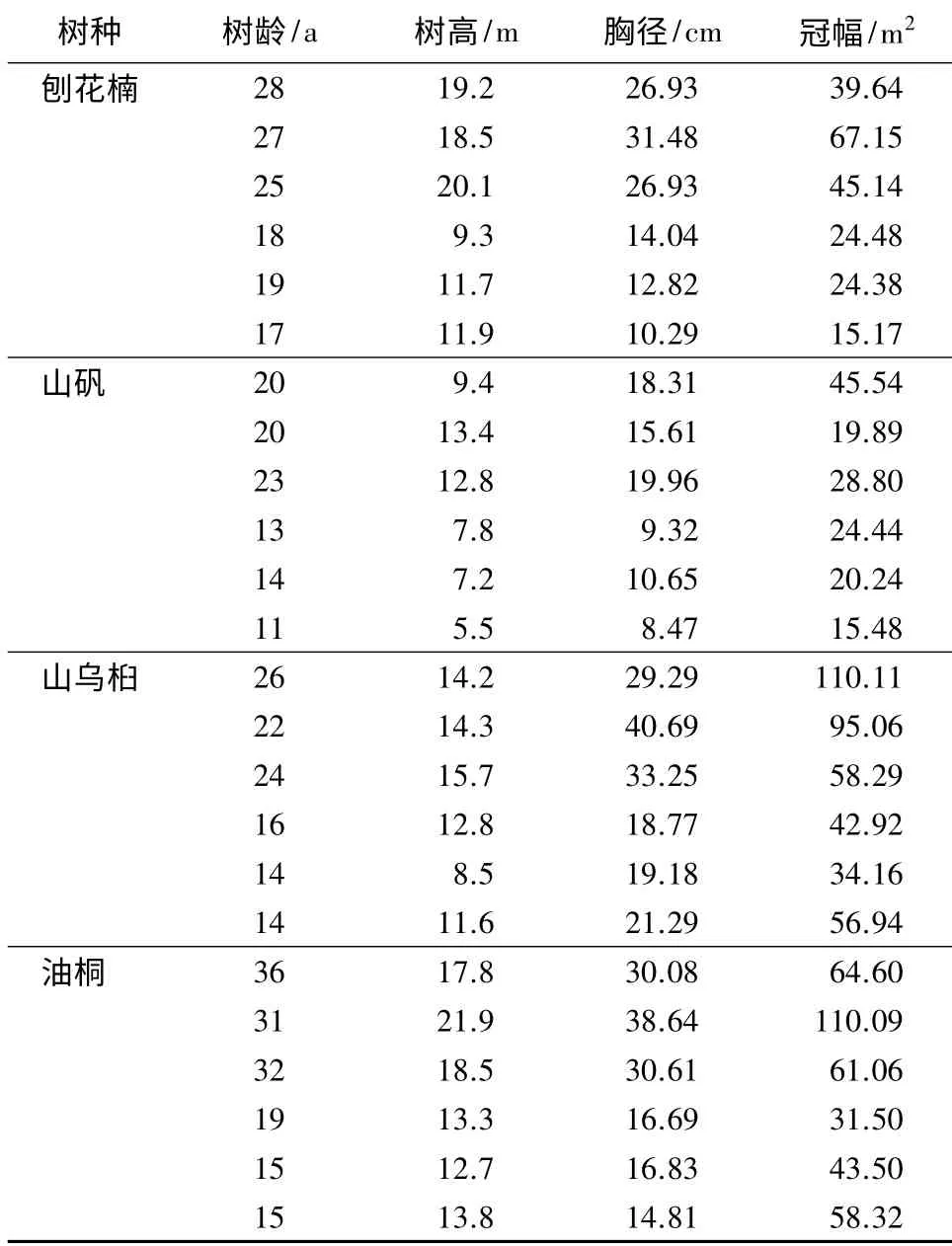
表1 样木的基本特征
在各层土芯中随机选取10 个新鲜完整有代表性的细根,用扫描仪对选取的细根进行扫描,扫描完成后用WinRHIZOTron(MF 2009)根系图像分析系统软件进行分析,得到细根的性状指标:根长、直径、表面积、比根长、细根的组织密度(单位长度质量/平均断面积)。
采用多因素方差分析法,分析树种、年龄、土层深度对细根生物量和功能性状指标的影响。每种树种土壤深度对细根生物量的影响及树龄对细根功能性状影响采用单因素方差分析。数据分析用R 软件完成。
3 结果与分析
3.1 细根生物量的垂直分布
为了探讨树龄对细根生物量的影响,将四个树种按照树龄大小分为大树和小树两组。多因素方差分析表明,树种和土层深度是影响细根生物量的一个主要因素(p<0.001),而树龄及树种和树龄的交互作用对细根生物量的影响并不显著(见表2)。所以合并大树和小树的生物量数据,对树种和土层深度分别进行单因素方差分析。
由表3 可知,4 个树种的细根的生物量均随土壤深度的增加呈现出下降的趋势,4 个树种在表层(0~10 cm)的细根生物量均显著大于其他各个土层,在0~20 cm 土层的细根生物量占到总生物量的68.63%~79.62%。其中,刨花楠在0 ~10 cm 的生物量最大,达到183.66 g·m-2,山乌桕在>30 ~40 cm的生物量达到最小值18.11 g·m-2。
常绿树种(刨花楠、山矾)细根生物量平均值大于落叶树种(山乌桕、油桐)的细根生物量。其中,刨花楠在0~10 cm 土层中,细根生物量显著大于其他3 个树种;>20~30 cm 土层中,显著大于山乌桕和油桐。在0~10 cm 土层中,山矾与山乌桕、油桐的差异并没有达到显著水平;在>10 ~20 cm 土层中,刨花楠和山矾的细根生物量显著高于山乌桕和油桐。油桐的细根生物量与山乌桕类似,只是在>30 ~40 cm 土层中高于山乌桕。
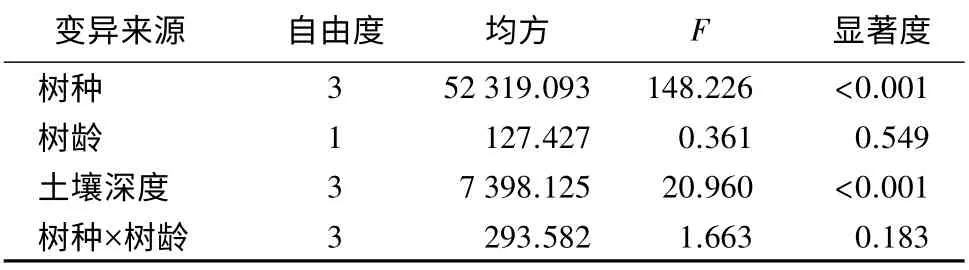
表2 树种、树龄、土壤深度及树种、树龄的交互作用对细根总生物量的影响
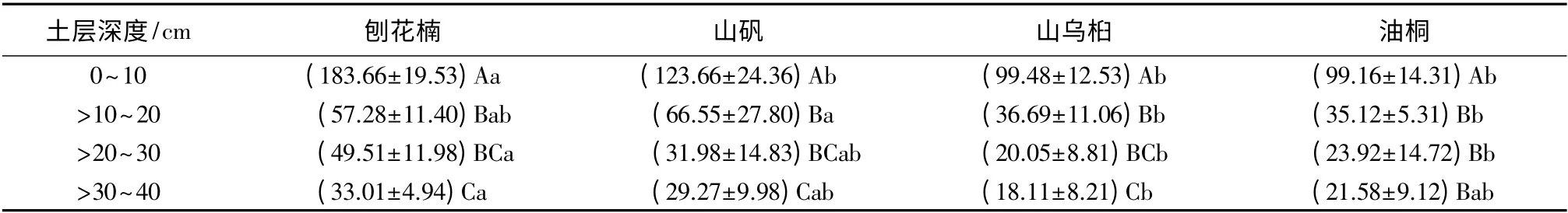
表3 4 种树种细根生物量的垂直分布 g·m-2
3.2 4 个树种的细根性状
除了单位面积和不同土层深度细根生物量外,还对4 个树种细根的根长、直径、表面积、比根长和组织密度进行了测定。从表4 可知,4 种树种的细根指标,刨花楠除了比很长外,其它各项指标均大于山矾、山乌桕、油桐;山乌桕的根长、表面积和组织密度都小于其他树种;刨花楠和山矾的组织密度均大于山乌桕和油桐。
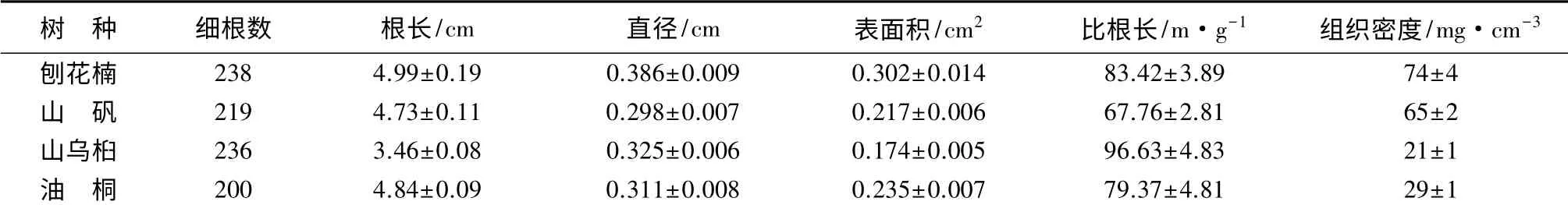
表4 4 种树种的细根功能性状
多因素方差分析的结果表明,树种对细根的性状有极显著的影响(p<0.01)。树龄对4 个树种细根的直径和比根长有显著影响;树种和树龄的交互作用对细根的直径、表面积和组织密度影响显著(p<0.05);树种和树龄的交互作用对根长和比根长的影响不显著。土壤深度对4 个树种的细根性状指标则没有达到显著水平。采用单因素方差分析,进一步分析每个树种的树龄对细根性状的影响。结果表明,树龄则对油桐的细根直径、细根表面积和细根组织密度均有极显著影响(p<0.05),对山乌桕的比根长和组织密度的影响也达到了显著水平(见表5)。
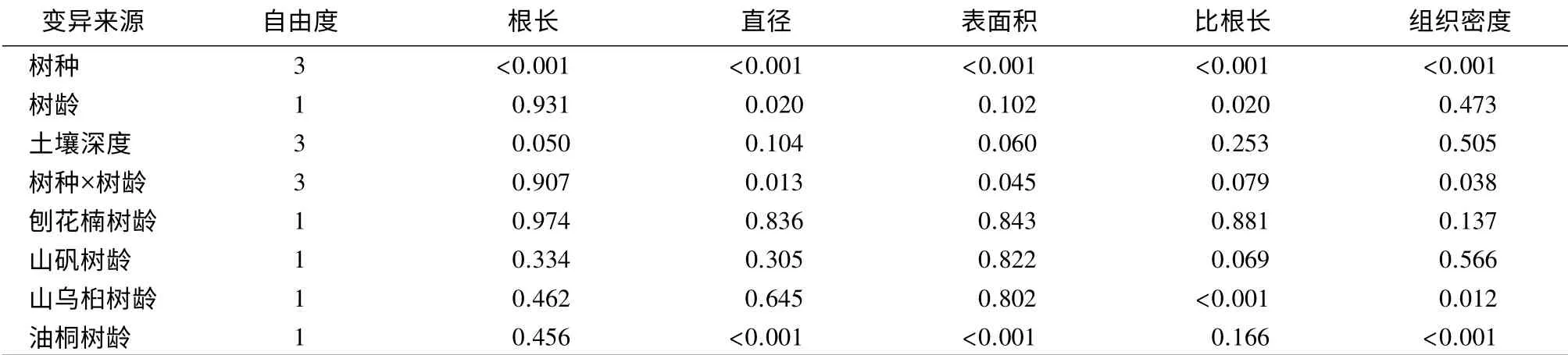
表5 树种和树龄及树种、树龄的交互作用对细根功能性状影响的检验
4 结论与讨论
通过对4 个树种细根的研究表明,树龄对细根的生物量的垂直分布并没有显著影响,细根生物量随土壤深度的增加而减小;各树种的细根单位面积的生物量和比根长等功能性状有显著差异,但土壤深度对不同细根功能性状的影响不显著。
细根生物量与森林类型、季节、土壤类型、立地条件和生长发育阶段等因素有关。常绿和落叶树种细根生物量均小于已报道的亚热带地区植物细根生物量,其中:常绿树种平均值为802 g·m-2,落叶树种为309 g·m-2[17]。造成这种差异的主要原因是各研究对细根的定义不同,降低了可比性。依据一些生理和形态学的研究,扮演吸收功能的细根根直径很少超过1 mm,89%的细根根直径在0.5 mm 以下,68%的细根根直径在0.3 mm 以下[18-19]。本研究中,4 个树种1 ~2 级的细根直径很少超过0.5 mm,与上述结果一致。
4 个树种在各层土壤中的生物量各有不同,土壤表层(0~10 cm)细根的生物量超过了50%,并且随着深度的增加呈现出下降的趋势。可能与表层的营养物质较多及根难易渗透进深层土壤有关[20]。同时,细根生物量在深层土壤的减少,也说明了深层土壤的细根对生态系统碳资源循环贡献较小[21]。这与其他温带、亚热带研究细根垂直分布的研究结果一致[21-22]。与地上部分的叶片功能性状不同,根的功能性状往往能被局部环境中的资源异质性和微生物共生关系等显著影响,导致吸收功能强、寿命较短的细根往往集中在表层营养较丰富的土层中[19]。
树种对细根生物量的影响达到了极显著水平(p<0.01),而树龄对4 个树种细根生物量的影响并不显著,说明细根生物量在树木的生命周期内是一个相对稳定的功能性状。在亚热带的常绿落叶林中,为了避免对资源的竞争,常绿和落叶两种生活型物种会采取不同生态策略,常绿树种多为深根系,而落叶树种则以浅根系为主,但细根的生长可能还与地上部分的能量分配和土壤异质性有一定关系[23]。R. L. Hendrick et al[24]提出“物候过程”理论认为:当树冠吸收碳水化合物充足且土壤水分、温度适宜时,树木可以大量的产生细根。J. D. Joslin et al[25]认为根的生长受新生叶产生的碳水化物的刺激。亚热带地区水热充足,日照时长和降水量可能不是限制植物生长的主要因素,常绿树种全年都可以进行光合作用,碳水化合物的增加又促进了细根的发展[26]。但本文对不同物候型的树种比较发现,常绿树种细根的单位面积总生物量并没有显著的大于落叶树种细根的生物量(p=0.091),这与我们预期结果不同。原因可能在与不同物候的树种其根系总生物量与地上生物量更相关,但细根的性状和垂直分布则可能存在很大差异。
细根是一个高度异质的构件混合体,它是在形态、生理和寿命上差异巨大的个体所组成。细根性状对环境中资源异质性的适应有多种方式,如细根的直径或组织密度的增加可能会导致其生物量增大,细根根长会显著下降[27-28]。结果表明,树种对于根长、细根直径、表面积及组织密度均有极显著的影响(p<0.001),遗传因素应该是造成细根总生物量差异的主要原因[15]。同时,树木作为一个水分、养分运输的“管道”系统,其地上部分的生长发育应该会影响到地下细根系统。本研究中,土壤深度并不是影响细根性状的一个主要因素,而树龄只是对个别树种的一些性状指标(如山乌桕的比根长和组织密度)有显著影响。若把树龄和树种结合考虑,其交互作用对细根的直径、表面积和组织密度均有显著的影响。因为不同年龄的树木次生维管组织发育进程差异及其根系所处土壤资源的异质性环境等方面的综合响应[29]。
植物细根的比根长和组织密度是反映植物的生理和生长策略的重要指标。对不同树种的细根比根长研究发现,其范围在1.05 ~101.57 m·g-1,且随着根序的升高,比根长减小[8,30]。本研究中,4 个树种的比根长均在范围之内,且由于选取1 ~2 级根序的细根,比根长较大。4 个树种的组织密度均小于之前的研究,这可能是由于选择细根的标准不同造成的。同时,两个落叶树种的树龄均对细根的组织密度产生了显著影响。K. Rosenvald et al[31]对欧洲桦细根研究结果表明,随着树龄的增加细根的组织密度也随之增加,欧洲桦幼林中细根的形态变异较大。熊德成等[32]提出,处于根系尖端的细根离地上碳源较远,碳水化合物供给相对困难,因此,在增加直径的同时必然会降低细根组织密度。这可能与树种的物候差异有关,还有可能是由于细根的组织密度和直径存在一种权衡关系,有待进一步研究。
[1] Santantonio D,Hermann R K. Standing crop,production and turnover of fine roots on dry,moderate and wet sites of mature douglas fir in western oregon[J]. Ann Sci For,1985,42(2):113-142.
[2] Vogt K A,Grier C C,Gower S T,et al. Overestimation of net root production:A real or imaginary problem[J]. Ecology,1985,67:577-579.
[3] Vogt K A,Grier C C,Vogt D J. Production,turnover and nutrient dynamics of above-and belowground detritus of world forests[J].Adv Ecol Res,1986,15:303-377.
[4] Jackson R B,Mooney H A,Schulze E D. A global budget for fine root biomass,surface area,and nutrient contents[J]. Ecology,1997,94(14):7362-7366.
[5] Pregitzer K S,Deforest J L,Burton A J,et al. Fine root architecture of nine north american trees[J]. Ecological Monographs,2002,72(2):293-309.
[6] Guo D,Mitchell R J,Withington J M,et al. Endogenous and exogenous controls of root life span,mortality and nitrogen flux in a longleaf pine forest:root branch order predominates[J]. Journal of Ecology,2008,96(4):737-745.
[7] Guo D L,Mitchell R J,Hendricks J J. Fine root branch orders respond differentially to carbon source-sink manipulations in a longleaf pine forest[J]. Oecologia,2004,140(3):450-457.
[8] 蔡飞,邹斌,郑景明,等.亚热带常绿阔叶林11 个树种的细根形态及碳氮含量研究[J].西北农林科技大学学报:自然科学版,2014,42(5):45-54.
[9] Gu J,Yu S,Sun Y,et al. Influence of root structure on root survivorship:an analysis of 18 tree species using a minirhizotron method[J]. Ecological Research,2011,26(4):755-762.
[10] Withington J M,Reich P B,Oleksyn J,et al. Comparisons of structure and life span in roots and leaves among temperate trees[J]. Ecological Monographs,2006,76(3):381-397.
[11] Reich P B,Walters M B,Ellsworth D S. Leaf life-span in relation to leaf,plant,and stand characteristics among diverse ecosystems[J]. Ecological Monographs,1992,62(3):365-392.
[12] Metcalfe N. Growth versus lifespan:perspectives from evolutionary ecology[J]. Experimental Gerontology,2003,38(9):935-940.
[13] Tjoelker M G,Craine J M,Wedin D,et al. Linking leaf and root trait syndromes among 39 grassland and savannah species[J].New Phytologist,2005,167(2):493-508.
[14] 廖利平,陈楚莹,张家武,等.杉木、火力楠纯林及混交林细根周转的研究[J].应用生态学报,1995,6(1):7-10.
[15] 李树站,田大伦,王光军,等.湖南4 种主要人工林群落的细根生物量及时空动态[J].中南林业科技大学学报,2011,31(5):63-68.
[16] 黄锦学,凌华,杨智杰,等.中亚热带细柄阿丁枫和米槠群落细根的生产和死亡动态[J].生态学报,2012,32(14):4472-4480.
[17] 张小全,吴可红.森林细根生产和周转研究[J].林业科学,2001,37(3):126-138.
[18] Xia M,Guo D L,Pregitzer K S. Ephemeral root modules in fraxinus mandshurica[J]. New Phytologist,2010,188(4):1065-1074.
[19] McCormack M L,Adams T S,Smithwick E A H,et al. Predicting fine root lifespan from plant functional traits in temperate trees[J]. New Phytologist,2012,195(4):823-831.
[20] Hutchings M J,John E A. Distribution of roots in soil,and root foraging activity. root ecology[M]. New York:Springer,Berlin Heidelberg,2003.
[21] John A B,Watson C A. Influences of root diameter,tree age,soil depth and season on fine root survivorship in prunusavium[J]. Plant and Soil,2005,276(1/2):15-22.
[22] Fukuzawa K,Shibata H,Takagi K,et al. Vertical distribution and seasonal pattern of fine-root dynamics in a cool-temperate forest in northern Japan:implication of the understory vegetation,Sasa dwarf bamboo[J]. Ecol Res,2007,22(3):485-495.
[23] Sobrado M A. Aspects of tissue water relations and seasonal changes of leaf water potential components of evergreen and deciduous species coexisting in tropical dry forests[J]. Oecologia (Berlin),1986,68(3):413-416.
[24] Hendrick R L,Pregitzer K S. The relationship between fine root demography and the soil environment in northern hardwood forests[J]. Ecoscience,1997,4(1):99-105.
[25] Joslin J D,Wolfe M H,Hanson P J. Factors controlling the timing of root elongation intensity in a mature upland oak stand[J].Plant Soil,2001,228(2):201-212.
[26] Negi G S. Leaf and bud demography and shoot growth in evergreen and deciduous trees of central Himalaya[J]. Trees,2006,20(4):416-429.
[27] Eissenstat D M,Yanai R D. The ecology of root lifespan[J]. Advance in Ecological Research,1997,27:1-60.
[28] Pregitzer K S,King J S,Burton A J,et al. Responses of tree fine roots to temperature[J]. New Phytologist,2000,147(1):105-115.
[29] Zadworna A B,Byczyk J,Eissenstat D M,et al. Avoiding transport bottlenecks in an expanding root system:xylem vessel development in fibrous and pioneer roots under field conditions[J]. American Journal of Botany,2012,99(9):1417-1426.
[30] Makita N,Hirano Y,Dannoura M,et al. Fine root morphological traits determine variation in root respiration of quercus serrate[J]. Tree Physiology,2009,29(4):579-585.
[31] Rosenvald K,Ostonen I,Uri V. et al. Tree age effect on fine-root and leaf morphology in a silver birchforest chronosequence[J].European Journal of Forest Research,2013,132(2):219-230.
[32] 熊德成,黄锦学,杨智杰,等.亚热带6 种树种细根序级结构和形态特征[J].生态学报,2012,32(6):1888-1897.
