高温胁迫对杜仲幼苗部分生理指标的影响1)
2015-04-03杨雨华宗建伟王健胜刘沛松杨风岭
杨雨华 宗建伟 王健胜 刘沛松 杨风岭
(平顶山学院低山丘陵区生态修复重点实验室,平顶山,467000) (中国林业科学研究院) (平顶山学院)
植物在长期的进化过程中,为了适应环境变化,逐渐形成了一套完整的对外界刺激的反应机制(包括对外界刺激的感受、信号的放大、传输及应答),从而引起相应的生理指标变化[1]。在众多胁迫因子中,温度对植物的生长发育有着十分重要的影响,也是植物自然地理分部的主要限制因素。适宜的温度是植物生长的必要条件,而过高或过低的温度会对植物的发育过程产生不利影响。研究植物对温度胁迫的生理生化响应(如渗透物资的积累、抗氧化酶系统的变化、光合性能的调节等),能够揭示植物适应温度逆境的生理机制,为植物的引种栽培、良种选育提供理论支持[2-3]。
杜仲(Eucommia ulmoides)是我国特有的孑遗树种,单属单种,具有重要的开发利用价值[4]。国内外学者对杜仲品种选育、生理生化、遗传特性及栽培技术做了大量工作,其中对生理生化的研究多集中在杜仲胶及有效药用成分等方面[5-9],而关于环境因子尤其是温度因素对杜仲生理特性影响的研究较少。本研究以杜仲的3 个无性系为材料,研究高温胁迫下渗透物质和保护酶系统以及光合参数的变化,探讨高温条件下不同无性系的抗逆性差异,为筛选优良杜仲品种提供生理依据。
1 材料与方法
试验在西北农林科技大学苗圃大棚温度控制室进行。2010 年3 月利用营养杯播种育苗(营养土为腐殖质、生土和沙子,三者比例为1 ∶1 ∶1),2012 年3 月选择长势良好的植株进行嫁接,每盆3 株,每个无性系嫁接10 盆;2012 年9 月选取高约30 cm、长势一致的3 个无性系(无性系1、无性系2、无性系3)放入恒温培养箱中进行不同的温度处理。3 个无性系均设置高温(无性系1-1、无性系2-1、无性系3-1)处理(昼/夜温度为45 ℃/35 ℃)和对照(无性系1-2、无性系2-2、无性系3-2)处理(昼/夜温度为25 ℃/15 ℃),时长均为12 h/12 h[10]。在处理期间,对各无性系每天18:00 浇水至透,控制光合有效辐射为1200 μmol·m-2·s-1,空气湿度为60%。
生理指标的测定:分别在0、2、4、6、8、10 d 时,取各无性系叶片进行生理指标的测定,主要包括脯氨酸(Pro)质量分数、丙二醛(MDA)质量分数、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性等。每个无性系选择3 株取样,测量3 次,取平均值。利用陈建勋[11]的方法测定脯氨酸和丙二醛的质量分数,利用高俊凤[12]的方法测定超氧化物歧化酶和过氧化物酶的活性。
利用Li-6400 光合仪进行光合参数的测定,主要包括净光合速率(Pn)、气孔导度(Gs)、胞间CO2摩尔分数(Ci)、蒸腾速率(Tr)等光合指标[13]。每个无性系选择3 株,每株选择顶端以下的第5 片完整叶子进行活体测量,每片叶子测量10 次,取平均值。试验数据利用EXCEL2007 和SPSS18.0 进行分析。
2 结果与分析
2.1 高温胁迫对杜仲幼苗Pro 和MDA 质量分数的影响
由图1 可知,高温胁迫会使杜仲幼苗叶片中的脯氨酸的质量分数显著提高(P<0.05),但是不同无性系提高幅度不同。在前2 d 的高温处理中,各无性系脯氨酸的质量分数略有提高,但并不明显。2 d后,3 个无性系脯氨酸的质量分数迅速增加,几乎呈现线性增长趋势,各对照的脯氨酸质量分数分别为高温条件下的61.8%、63.3%和56.6%。不同无性系之间,脯氨酸的质量分数在相同温度下差异不显著。当植物遭遇高温胁迫时,植株为防止细胞脱水而受损,会提高体内脯氨酸的质量分数;同样,为防止遭受冷害或冻害的侵袭,植株也通过增加脯氨酸的质量分数适应环境温度变化。但低温条件下,植株生理生化活动减弱,脯氨酸的质量分数比高温条件下的低。
图2 表明,不同无性系的杜仲幼苗在高温胁迫下,丙二醛的质量分数呈显著增加(P<0.05),但不同无性系间有较大差异。在处理的前4 d 中,各无性系的丙二醛的质量分数稍有增加,变化幅度不大。第4 d 后,无性系1 在高温条件下,丙二醛的质量分数迅速增加,但在第6 d 开始出现下降趋势,第8 d达到一个波谷,然后又迅速增加;各对照中的丙二醛的质量分数变化趋势与高温处理基本一致,但丙二醛的质量分数远低于高温胁迫,第8 d 后增幅不明显。无性系2 和无性系3 在高温胁迫下,丙二醛的质量分数均不断增加,但无性系3 在处理后期增幅不显著。在处理第10 d 时,3 个无性系对照植株的丙二醛的质量分数分别为高温条件下的42.9%、79.4%和70.5%。可以推测,高温胁迫会使杜仲幼苗细胞膜受损,不利于植株的生长。

图1 高温胁迫下Pro 质量分数的变化趋势
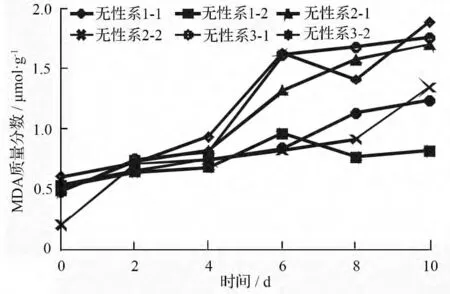
图2 高温胁迫下MDA 质量分数的变化趋势
2.2 高温胁迫对杜仲幼苗SOD 和POD 活性的影响
图3 表明,不同无性系在高温胁迫下,超氧化物歧化酶活性变化差异较大(P<0.05)。无性系1 在高温处理下,超氧化物歧化酶活性迅速增加,到第6 d 开始下降,第8 d 又开始上升,对照无性系则一直处于增长趋势。无性系2 在高温处理中,超氧化物歧化酶活性呈现先降后增的趋势,第4 d 达到最低值,而对照中超氧化物歧化酶活性一直上升。无性系3 在高温处理中,超氧化物歧化酶活性的变化趋势与无性系2 类似,但其最低点提前,在第2 d 达到波谷位置,对照则呈现稳定地增长趋势,在4~6 d 有一个小幅度的下降过程。在第10 d,对照中的3 个无性系超氧化物歧化酶活性均高于高温处理。
由图4 可知,高温胁迫使杜仲幼苗过氧化物酶活性发生显著变化(P<0.05)。高温胁迫下,3 个无性系叶片过氧化物酶活性呈下降趋势。对照处理中,3 个无性系过氧化物酶活性先降后升,其中无性系1 和无性系2 在第2 d 开始上升,而无性系3 的过氧化物酶活性的下降趋势持续到第6 d 才开始上升。第10 d,各无性系高温条件下过氧化物酶活性远低于对照处理。说明温度过高会抑制植株体内过氧化物酶的活性。
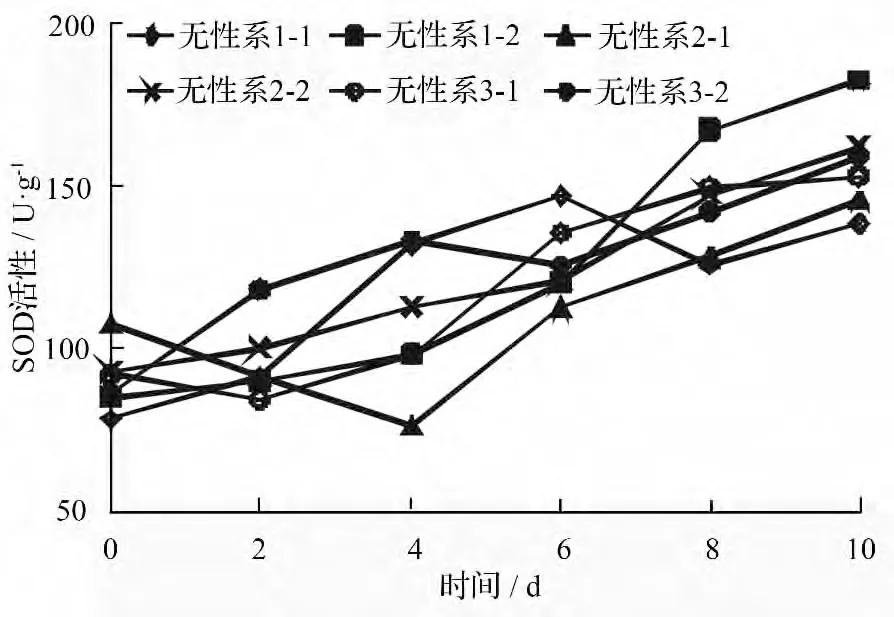
图3 高温胁迫下SOD 活性的变化趋势

图4 高温胁迫下POD 活性测定
2.3 温度胁迫对杜仲幼苗光合作用的影响
由表1 可知,无论是高温胁迫还是对照,处理后杜仲幼苗光合速率均会显著下降(P<0.05)。相对于处理前,高温条件下3 个无性系的净光合速率分别下降了37.6%、33.3%和30.2%,对照的3 个无性系的净光合速率分别降低了43.2%、47.9%和55.6%。说明杜仲幼苗在高温条件下的光合能力略高于对照条件。
高温处理会使杜仲幼苗气孔导度减小。相比于处理前,高温胁迫条件下3 个无性系的气孔导度下降幅度不大(P>0.05),分别为11.2%、9.8%和12.1%,而对照各无性系的气孔导度下降幅度较大(P<0.05),分别为40.1%、32.5%和49.1%。这与不同温度下杜仲幼苗的净光合速率变化趋势基本一致。
高温处理均会使杜仲幼苗胞间CO2的摩尔分数增大。相比于处理前,高温胁迫条件下3 个无性系的胞间CO2的摩尔分数的均显著增高(P<0.05),增大幅度分别为7.01%、8.18%和7.71%,而对照各无性系的胞间CO2的摩尔分数同样显著增高(P<0.05),增大幅度分别为15.1%、13.6%和6.38%。说明高温会对杜仲幼苗的光合作用有一定得抑制作用,而对照条件则会严重阻碍杜仲幼苗光合作用的进行。
不同温度处理均会使杜仲幼苗蒸腾速率产生不同的变化。相比于处理前,高温胁迫条件下各无性系的蒸腾速率显著上升(P<0.05),增长幅度分别为58.3%、78.3%和40%,而对照则会使蒸腾速率减弱(P<0.05),3 个无性系降幅分别为28.4%、33.3%和38.0%。说明高温会加快植株的蒸腾速率,而对照条件下植株的蒸腾速率降低。
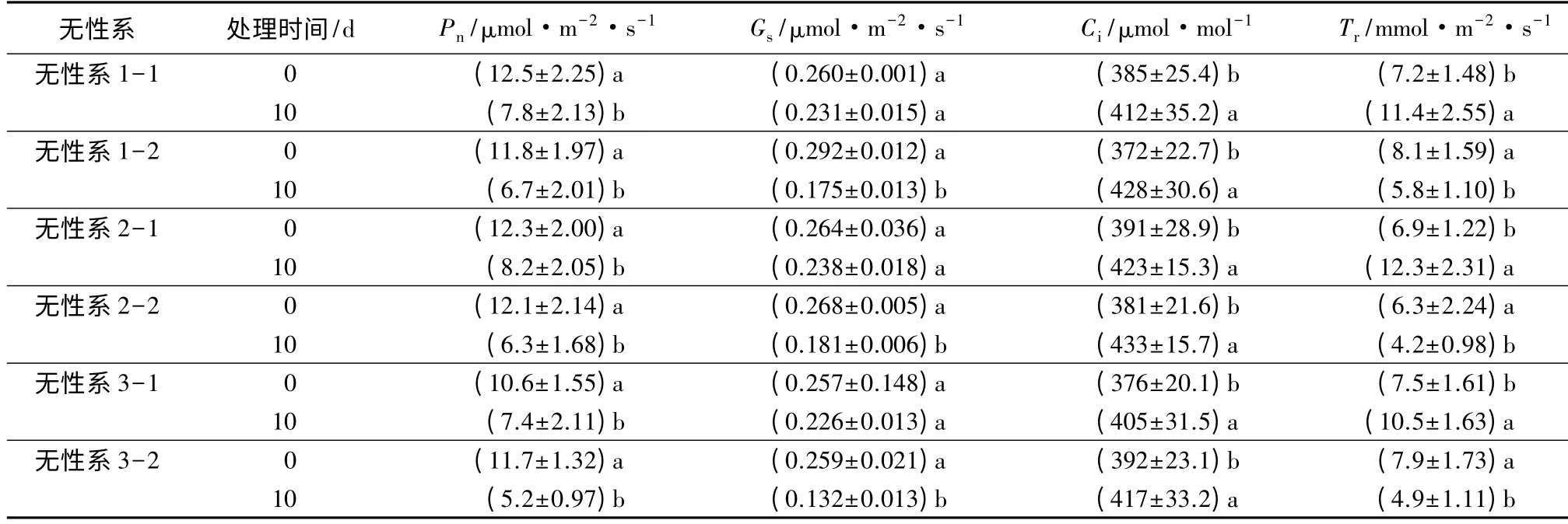
表1 杜仲光合参数对温度胁迫的响应
3 结论与讨论
植物处于不同温度时,代谢机制可能发生相应的变化[14-15],比如,通过增大细胞膜透性、增加活性氧及抗氧化酶质量分数等,以应对不利环境。
在渗透调节物质中,游离脯氨酸是植物抵抗和防御逆境胁迫的重要生理机制,脯氨酸可以促进蛋白质水合作用,增加蛋白亲水面积,进而增加可溶性蛋白[16-17]。大多数植物为了抵御逆境,体内脯氨酸的质量分数会迅速增加,以增强植物的抗逆性。本试验中,杜仲幼苗在高温胁迫下,叶片中的脯氨酸的质量分数均会提高,且呈现线性增长趋势,这与李招弟[18]和曾德静[19]的研究结果一致。杜仲在面临不同的温度胁迫时,均会以增加脯氨酸的质量分数的方式度过不利环境,防止细胞脱水或者遭受冷害或冻害的侵袭。丙二醛是膜脂过氧化的主要产物之一,可以反映膜损伤的程度[20]。丙二醛的质量分数越高,质膜受损越严重[21]。不同无性系的杜仲幼苗在不同温度处理下,丙二醛的质量分数均呈增加趋势,但不同无性系之间有较大差异。无性系1 在高温条件下,丙二醛的质量分数呈起伏变化趋势,且基本保持较高水平。孟聪睿[22]在研究高温胁迫对樱桃的影响时也得出相似结论。由此可知,高温胁迫会使杜仲幼苗细胞膜受损,透性改变,不利于植株的生长。
在逆境胁迫下,植物体内活性氧代谢失调、自由基逐步积累,引起生理代谢紊乱,损伤细胞结构[23]。超氧化物歧化酶和过氧化物酶是植物重要的保护酶系统[24-25]。不同无性系在高温胁迫下,超氧化物歧化酶活性变化差异较大。3 个无性系叶片中,在高温处理条件下,过氧化物酶活性均呈下降趋势。说明植株体内过氧化物酶的活性易受高温影响,温度过高会严重抑制其活性,甚至使过氧化物酶失活。研究表明,植物抗逆性的大小与保护酶的抗氧化能力密切相关。高温胁迫下月季品种超氧化物歧化酶、过氧化物酶活性下降,但耐热品种活性比不耐热品种高,不耐热品种抗氧化酶活性下降更为明显[26],与本研究的结果一致。
净光合速率能够直接体现植物光合系统的功能大小,是植株光合作用能否正常进行的指标[27]。植物以气孔为通道与大气交换水和CO2,决定着植物的光合速率和蒸腾速率[28]。高温和对照处理均会使杜仲幼苗光合能力降低,但杜仲幼苗在高温条件下的光合能力略高于对照。杜仲幼苗通过关闭气孔、减弱光合作用度过不良环境。
综上所述,在高温胁迫下杜仲幼苗会产生一系列生理响应(如渗透调节物质、保护酶活性和光合参数发生相应的变化),以减轻温度胁迫对幼苗的伤害[29]。脯氨酸和丙二醛的质量分数、超氧化物歧化酶和过氧化物酶活性以及光合参数,在不同无性系之间具有一定程度的差异性,可以为杜仲抗逆性选择育种提供一定的参考。
[1] 吴能表,钟永达,肖文娟.零上低温对甘蓝幼苗逆境指标的动态影响[J].西南师范大学学报:自然科学版,2005,30(3):525-528.
[2] 郭淑红,薛立,张柔,等.4 种幼苗对低温胁迫的光合生理响应[J].华南农业大学学报,2012,33(3):373-377.
[3] 何跃君,薛立,任向荣,等.低温胁迫对六种苗木生理特性的影响[J].生态学杂志,2008,27(4):524-531.
[4] 张康健.杜仲[M].北京:中国林业出版社,1990.
[5] 张凯,慕小倩,孙晓玉,等.温度变化对油菜及其伴生杂草种苗生长和幼苗生理特性的影响[J].植物生态学报,2013,37(12):1132-1141.
[6] 张博勇,张康健,张檀,等.秦仲1-4 号优良品种选育研究[J].西北林学院学报,2004,19(3):18-20.
[7] 魏永成,李周岐,李煜,等.杜仲杂交子代苗期表型性状的遗传分析[J].西北农林科技大学学报:自然科学版,2012,40(8):137-143.
[8] Hattori M,Che Q M,Gewali M B,et al. Studies on Du-Zhong leaves (III):Constituents of the leaves of Eucommia ulmoides(1)[J]. Shoyakugzku Zasshi,1988,42(1):76-80.
[9] Hsieh C L,Yen G C. Antioxidant actions of Duzhong (Eucommia ulmoides Oliv.)toward oxidative damage in bimolecular[J]. Life Sciences,2000,66(15):1387-1400.
[10] Tangpakdee J,Tanaka Y,Shiba K,et al. Structure and biosynthesis of transpolyisoprene from Eucommia ulmoides[J]. Photochemistry,1997,45(1):75-80.
[11] 陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002.
[12] 高俊凤.植物生理学实验技术[M].西安:世界图书出版西安公司,2000.
[13] 黄秦军,黄国伟,丁俊昌,等.美洲黑杨杂种不同生长势无性系光合特征[J].林业科学,2013,49(3):56-62.
[14] 王树刚,王振林,王平,等.不同小麦品种对对照胁迫的反应及抗冻性评价[J].生态学报,2011,31(4):1064-1072.
[15] 李文娆,张岁岐,丁圣彦,等.干旱胁迫下紫花苜蓿根系形态变化及与水分利用的关系[J].生态学报,2010,30(19):5140-5150.
[16] Zhu X C,Song F B,Xu H W. Arbuscular mycorrhizae improves low temperature stress in maize via alterations in host water status and photosynthesis[J]. Plant and Soil,2010,331(1):129-137.
[17] Gall A,Haldimann P,Feller U. Photosynthetic performance and water relations in young pubescent oak (Quercus pubescens)trees during drought stress and recovery[J]. New Phytologist,2007,174(4):799-810.
[18] 李招弟.红花玉兰幼苗光合特性及其对温度胁迫的生理响应[D].北京:北京林业大学,2009.
[19] 曾德静,王铖,刘军,等.高温胁迫对海州常山形态和生理特性的影响[J].东北林业大学学报,2013,41(3):90-94.
[20] 陈少裕.膜脂过氧化对植物细胞的伤害[J].植物生理学通讯,1991,27(2):84-90.
[21] 高媛,齐晓花,杨景华,等.高等植物对对照胁迫的响应研究[J].北方园艺,2007(10):58-61.
[22] 孟聪睿.干旱高温胁迫对樱桃的生理影响[D].太谷:山西农业大学,2009.
[23] 彭素琴,刘郁林,谢双喜.干旱胁迫对不同金银花水分利用效率及细胞膜透性的影响[J].北方园艺,2011(10):156-158.
[24] Mittler R,Vanderauwera S,Gollery M,et al. Reactive oxygen gene network of plants[J]. Trends in Plant Science,2004,9(10):490-498.
[25] Arnon D I. Copper enzymes in isolated chloroplasts poly Phenol oxidizes in Beta vulgarisms[J]. Plant Physiology,1949,24(1):1-15.
[26] 蒋昌华,胡永红,秦俊,等.高温胁迫对月季品种部分生理指标的影响研究[J].种子,2008,27(6):31-34.
[27] 欧立军,陈波,邹学校.干旱对辣椒光合作用及相关生理特性的影响[J].生态学报,2012,32(8):2612-2619.
[28] 高丽,杨劼,刘瑞香.不同土壤水分条件下中国沙棘雌雄株光合作用、蒸腾作用及水分利用效率特征[J].生态学报,2009,29(11):6025-6034.
[29] 潘瑞炽.植物生理学[M].5 版.北京:高等教育出版社,2004.
