黑米花青素体内抗氧化研究
2015-03-24张曼莉孙汉巨陈晓燕娄秋燕
石 娟,张曼莉,孙汉巨,陈晓燕,娄秋燕,刘 宁,王 霄
(合肥工业大学生物与食品工程学院,安徽合肥 230009)
黑米花青素体内抗氧化研究
石 娟,张曼莉,孙汉巨*,陈晓燕,娄秋燕,刘 宁,王 霄
(合肥工业大学生物与食品工程学院,安徽合肥 230009)
本文研究了黑米花青素对小白鼠的抗氧化及免疫调节作用。以生理盐水为载体,维生素C作为阳性对照,分别采用高、中、低三种剂量的黑米花青素粗提物及其纯化物,灌胃喂养小白鼠30d后,测定小白鼠的脾和胸腺指数,血清、肝脏、心脏和肾脏中总抗氧化力(T-AOC)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化酶(GSH-Px)的活力,丙二醛(MDA)和羟自由基含量。研究结果表明:该花青素能增加小白鼠的脾和胸腺指数,显著提高其体内T-AOC水平和SOD、GSH-Px的活性,降低MDA和羟自由基的含量。因此,黑米花青素具有提高小白鼠的体内抗氧化及免疫调节作用。
黑米,花青素,小白鼠,抗氧化
黑米是一种特殊的稻种,属于糯米类,俗称“药米”、“长寿米”、“神仙米”及“补血米”[1]。在我国广西、广东、云南等地较为集中,近年来其种植范围已扩展到陕、浙、苏、川、鄂、湘等省。黑米中含有丰富的营养及功效成分,含有人体所必需的氨基酸、不饱和脂肪酸、蛋白质、VB1、VB2及VC,以及铁、锌、铜、钙等矿物营养元素[2]。值得一提的是,其含有大量的花青素[3]。古农医书记载:黑米有“滋阴补肾,健身暖胃,明目活血,清肝润肠,滑湿益精,补肺缓筋”功效。
花青素(Anthocyanin),又叫花色素,是自然界中广泛存在于植物中的一类水溶性天然色素,属于酚类化合物中的类黄酮类物质[4]。其基本结构中含两个苯环,形成典型的C6-C3-C6共轭体系,是2-苯基苯并吡喃的衍生物[5]。现代研究表明,花青素具有抗氧化,清除自由基,改善贫血,降低血脂和预防动脉粥样硬化,保护血管内皮以及抗疲劳、抗缺氧、抗癌及抗肿瘤等作用。其对眼疾、血液循环失调、冠心病、发炎性等疾病有一定的疗效[6]。
目前,国内外关于黑米花青素的抗氧化及免疫特性方面的报道较少。本研究拟以黑米为原料,采用水浸提、膜分离及大孔树脂等提取和纯化方法得到花青素[7]。以小白鼠为实验对象,考察该花青素对动物的体内抗氧化及免疫调节作用的影响,为其产业化开发提供技术支撑。
1 材料与方法
1.1 材料与仪器
黑米 安徽省合肥中科小陶食品有限公司提供;黑米花青素 制备纯化前的粗花青素粉和纯化后的纯花青素粉(记为粗花青素和粗花青素纯化物),提取及纯化方法参照石娟[7]的方法;小白鼠,昆明种,6~8周龄,体重20±2g 安徽医科大学实验动物饲养中心购买,实验动物生产许可证号:SCXK(皖)2011-002,实验动物使用许可证号:SYXK(皖)2011-002;T-AOC、SOD、MDA、GSH-Px以及羟自由基试剂盒 南京建成生物工程研究所;考马斯亮蓝G250 中国医药上海试剂公司;牛血清蛋白 厦门星隆达公司。
JM型胶体磨 上海爱思杰制泵有限公司;600×16mm层析柱 北京瑞达恒辉科技发展有限公司;JY601型电子天平 上海民桥精密科学仪器有限公司;TDL-50B高速离心机 上海仪器厂;722E可见分光光度计 上海光谱仪器有限公司;HH-2数显恒温水浴锅 江苏金坛市杰瑞尔电器有限公司;PHS-2C精密pH计 上海精密科学仪器有限公司;KRT-NT-2-1多功能膜设备 合肥科瑞特环保工程有限公司;LGJ-12冷冻干燥机 北京松源华兴科技发展有限公司。
1.2 实验方法
1.2.1 水溶性蛋白测定 考马斯亮蓝法[8]。
1.2.2 花青素测定 分光光度法[9]。
1.2.3 实验小白鼠的分组和饲养方式 小白鼠在22℃和50%相对湿度环境下饲养,每天保持12h光照,12h黑夜,自由饮食和饮水[10]。随机分成10组,每组10只。黑米花青素粗品、粗品纯化物和维生素C分别溶解在生理盐水中,灌胃生理盐水作为空白对照组,维生素C作为阳性对照组[11]。根据沙棘原花青素胶囊推荐人体摄入量0.043g/kg·BW[12],设置低、中、高剂量组分别为50、100、200mg/kg·BW,采用灌胃的方式,喂养相应浓度的维生素C、花青素粗品和纯化物各三组,对照组则灌胃同样剂量的生理盐水,连续30d。
1.2.4 实验血清和组织的制备 在小白鼠末次灌胃后,禁食一夜。然后,眼眶取血,收集血液,离心,得上清液即为血清[13]。收集脾脏、胸腺、肾脏、肝脏和心脏。其中,脾和胸腺分别称重,肾脏、肝脏和心脏组织分别与冷却的0.9%氯化钠溶液,按1∶9的比例(m/v),加入匀浆器中,制成匀浆,在4000r/min及4℃下,离心10min,收集上清液备用。
1.2.5 脾指数和胸腺指数的测定

(1)

(2)
由于VC是作为体内抗氧化实验的阳性对照,所以胸、脾脏指数实验就没有以VC另作对照。
1.2.6 小白鼠体内抗氧化指标的测定 T-AOC、SOD、GSH-Px、MDA及羟自由基测定的具体操作见试剂盒说明。
2 结果与分析
2.1 蛋白质的标准曲线
水溶性蛋白测定:采用考马斯亮蓝法[8]。取0.1mL小鼠血清,加入到5mL考马斯亮蓝溶液中,混匀,静置3min,在595nm波长下测其吸光度:根据蛋白质标准曲线回归方程A=6.54C+0.0267(R2=0.9932)计算水溶性蛋白的含量。蛋白质的标准曲线如图1所示。

图1 蛋白质标准曲线Fig.1 Standard curve of protein
2.2 花青素含量测定结果
以矢车菊素-3-葡糖苷为标品,测得粗花青素中花青素含量为367.9mg/g,粗花青素纯化物中花青素的含量为638.7mg/g。
2.3 花青素对小白鼠胸腺和脾脏指数的影响
由表1可见,与对照组相比,粗花青素及其纯化物使胸腺和脾(除粗花青素低剂量组)指数均有提高。其中,中、高剂量组与对照组相比,脾指数都有显著差异,但中、高剂量组间没有显著性差异。胸腺指数结果中,粗花青素高剂量组及纯化物各组与对照组相比有显著差异,但粗花青素高剂量组及纯化物之间没有显著性差异。研究表明,该花青素使小白鼠的胸腺和脾脏指数增加,具有免疫调节功能。
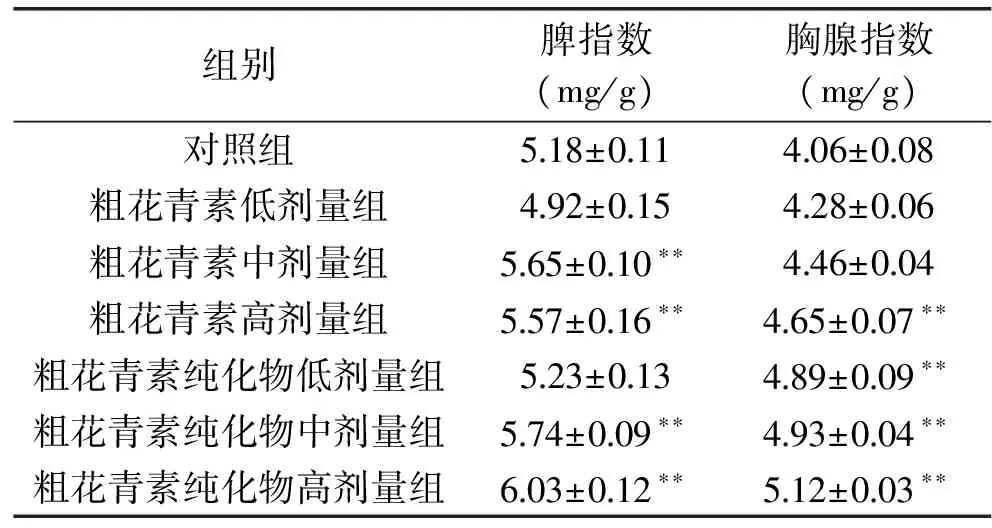
表1 花青素对胸腺和脾脏指数的影响Table 1 Effect of anthocyanins on thymic and splenetic indexes
注:*与对照组比较,p<0.05;**与对照组比较,p<0.01,图2~图6同。
2.4 花青素对T-AOC的影响

表2 花青素对总抗氧化力的影响Table 2 Effect of anthocyanins on total antioxidant capacity(T-AOC)
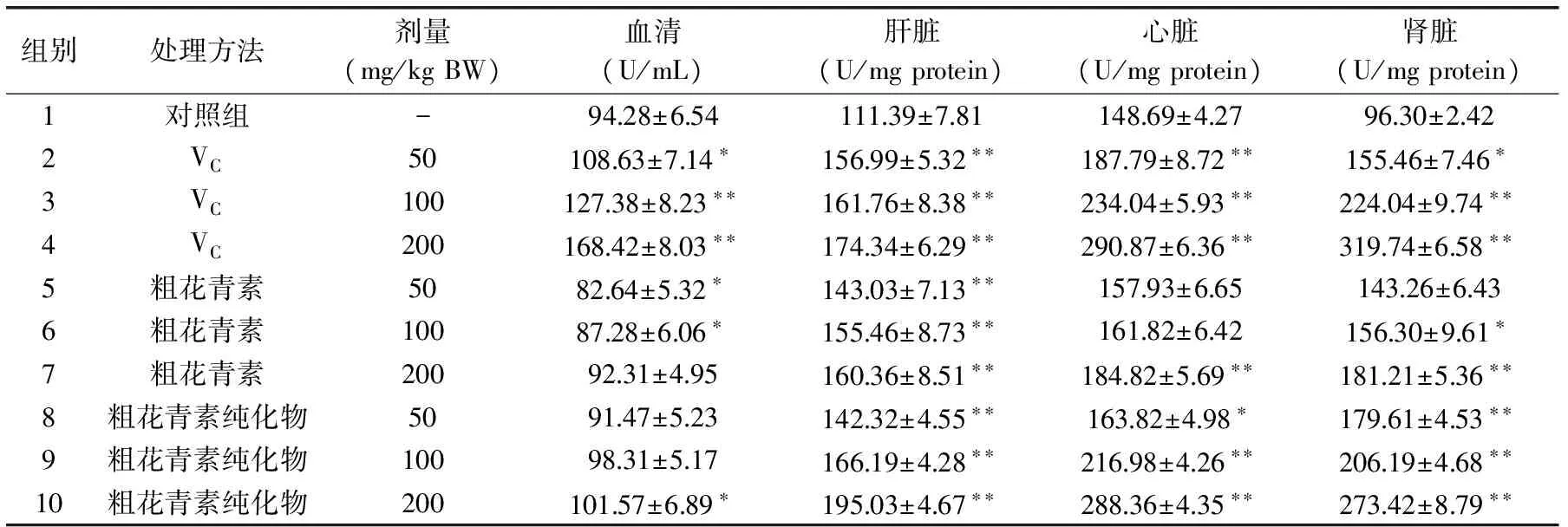
表3 花青素对超氧化物歧化酶活性的影响Table 3 Effect of anthocyanins on SOD activity
如表2所示,与对照组相比,灌胃粗花青素及其纯化物组中,小白鼠血清、肝脏、心脏和肾脏中T-AOC水平大都得到增加。特别是粗花青素纯化物高剂量组中T-AOC水平增加最为显著。另外,与同等剂量的粗花青素组相比,粗花青素纯化物组中T-AOC水平提高更为显著。
花青素能够提高非酶体系的T-AOC原因可能为:第一,其直接与活性氧类物质和自由基发生反应来保护生物体免受氧化损害;第二,花青素是多酚类物质,具有多个羟基,其三环形成的共轭体系属于多共轭芳香体系,有很高的生物活性[15]。由于产生共轭效应,酚羟基上的氢原子活性明显提高,尤其是邻位-OH脱氢产生自由基后,使得分子内氢键较稳定,抗氧化活性提高,除此之外,邻位羟基的自由基通过共振作用形成邻苯醌,有利于酚式向醌式转化,形成酚醌平衡,成醌后的C=O和邻位的羟基形成分子内的氢键更加稳定。因此,机体的T-AOC更高[16]。
2.5 花青素对SOD活性的影响
表3反映了VC、粗花青素及其纯化物对小白鼠血清、肝脏、心脏和肾脏中SOD的影响。很显然,随着花青素剂量的增加,该酶的活性逐渐增加。与VC组相比,花青素也能较显著地提高该酶的活性。另外,与同等剂量的粗花青素组相比,粗花青素纯化物组能更显著地提高SOD的活性。研究结果表明该花青素具有较好的提高SOD活性的效果。
2.6 花青素对GSH-Px活性的影响
黑米花青素对GSH-Px活性的影响如表4所示。随着剂量的增大,血清、肝脏、心脏和肾脏中GSH-Px的活力逐渐增高。与对照组相比,粗花青素纯化物组中GSH-Px的活力增加显著。并且,GSH-Px的活力与花青素的剂量成正相关性。很显然,花青素能明显地促进小白鼠中GSH-Px的活性。

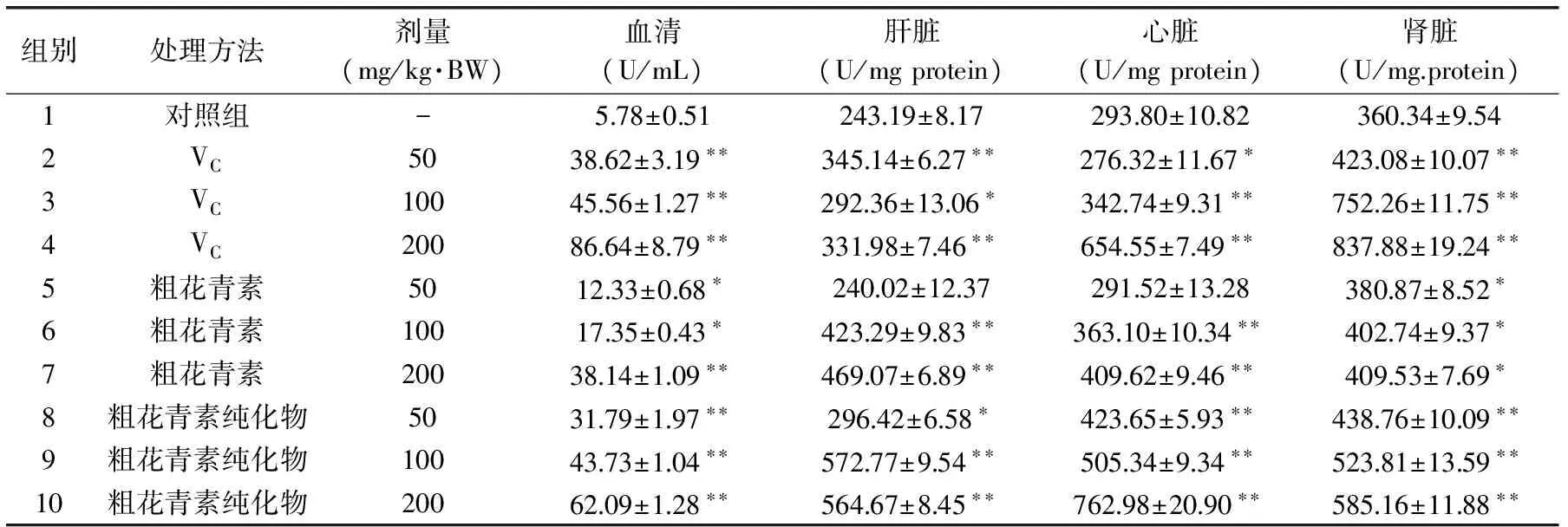
表4 花青素对谷胱甘肽过氧化酶活性的影响Table 4 Effect of anthocyanins on GSH-Px activity
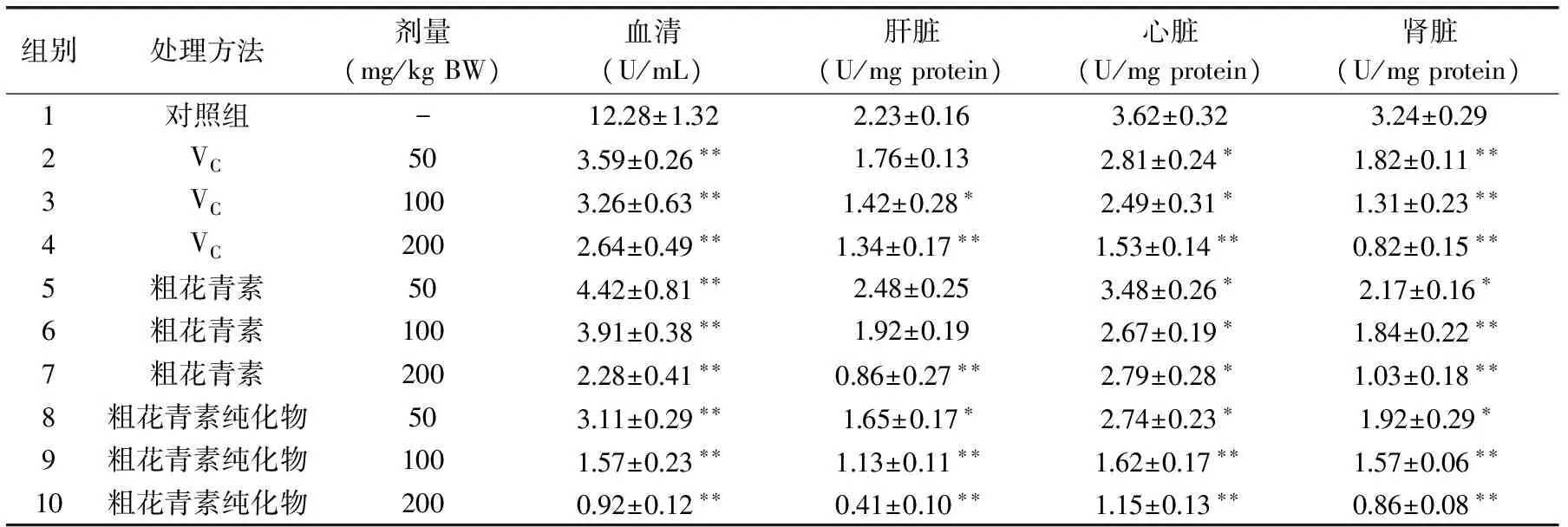
表5 花青素对脂质氧化的抑制作用Table 5 Effect of anthocyanins on lipid peroxidation

表6 花青素对羟自由基的抑制作用Table 6 Effect of anthocyanins on hydroxy radical
2.7 花青素对脂质氧化的抑制作用
过氧化脂质降解产物中的丙二醛(MDA)可与硫代巴比妥酸(TBA)缩合,形成红色产物,在532nm处有最大吸收峰。花青素对小白鼠体内脂质氧化(以MDA含量计)的影响如表5所示。显而易见,VC组、粗花青素及其纯化物组的3个剂量组中,小白鼠血清、肝脏、心脏和肾脏中MDA的含量均低于对照组。另外,与VC组和粗花青素组相比,粗花青素纯化物组中血清MDA的含量更低,粗花青素纯化物组中肝脏和心脏中MDA含量的降低也有同样的效果。
其可能原因可分析如下为:第一,花青素能够直接与酶和非酶系统产生的氧自由基发生反应,避免其攻击生物膜中的多不饱和脂肪酸(PUFA)而产生脂质过氧化反应,从而形成脂质过氧化物;第二,从结构上分析,张名位等[16-17]从黑米中分离纯化并鉴定了4种黑米花色苷类化合物,其中矢车菊素-3-葡萄糖苷的含量最高。王金亭等[18]在这4种花色苷化合物的基础上,进一步证明了矢车菊素-3-葡萄糖苷的抗氧化活性最高,发挥主要的抗氧化作用。矢车菊素-3-葡萄糖苷是多酚类物质,有邻位羟基且羟基数目较多,形成酚醌平衡的稳定特性,使其生物活性提高;第三,花青素由于产生共轭效应,氧原子上的不成对电子不固定于氧,而是靠近苯环,从而削弱了氢氧键,使酚羟基上氢原子的活性提高,易于脱氢而成为氢供体,氢供体可以和脂类化合物自由基发生反应,转变成酚自由基,酚自由基氧上的不成对的电子分散于整个共轭体系中非常稳定,从而降低了自动氧化链反应的传递速度,抑制脂类的进一步氧化[19]。由于花青素的喂养,小白鼠体内血清、肝脏、心脏和肾脏中MDA的含量显著降低,小白鼠较好地免受氧化损害。因此,花青素对小白鼠体内脂质的氧化有一定的抑制作用。
2.8 花青素对羟自由基的抑制作用
黑米花青素对羟自由基的抑制作用如表6所示。随着花青素剂量的增加,抑制羟自由基的能力基本上呈逐渐提高趋势。与对照组相比,粗花青素中等剂量和纯化物组能显著地抑制羟自由基产生;三种药物的高剂量组相比,对心脏中羟自由基抑制效果由大到小是:粗花青素纯化物>VC>粗花青素。花青素有较强的抑制羟自由基能力主要原因可能是,其C6-C3-C6三环共轭体系使得酚羟基上的氢原子更为活跃,有利于脱氢形成氢供体,当机体在氧化还原反应中生成过量的羟自由基时,花青素提供氢能与之相结合,从而保护机体免遭羟自由基的损伤。
3 结论
用黑米花青素连续灌胃30d后,小白鼠的脾和胸腺指数都得到增加,肝脏、肾脏、心脏和血清中T-AOC、SOD和GSH-Px活性显著地增加,羟自由基的清除能力明显提高,而且MDA含量有所下降。在高剂量组中,与VC相比,粗花青素纯化物对肝脏和心脏中羟自由基抑制能力提高最为显著,SOD活性也显著地提高;与同等剂量的粗花青素相比,其纯化物对SOD活性的提高效果更显著。粗花青素纯化物对小白鼠T-AOC的提高效果与VC相似。因此,黑米花青素具有体内抗氧化及免疫调节作用,且纯化后的花青素体内抗氧化及免疫调节效果更好。
[1]赵腾芳.黑糯稻品种资源的考察和研究[J].农业考古,1984,2:296-298.
[2]雷永烨.黑稻的开发利用价值[J].上海农学院学报,1988,6(4):325-328.
[3]高如嵩.陕西黑米的主要营养成分及其利用价值[J].西北农学院学报,1984,6(1):97-101.
[4]Pourrat H. Drogues a anthocyanes et maladies vassculaires[J].Plant Med Phytother,1997,11(9):143.
[5]Vincieri F,Romani A,Baldi A,et al. Analysis HPLC of anthocyanins present in fluid extracts from Malya sylvestris L.flowers and leaves[J]. Bull Liaison-Groupe Polyphenols,1992,16(1):339-342.
[6]高爱红,童华荣.天然食用色素-花青素研究进展[J].保鲜与加工,2001(3):25-27.
[7]石娟.黑米中花青素的提取、纯化及其体内抗氧化活性研究[D].合肥:合肥工业大学,2011.
[8]余冰宾.基础生物化学实验指导[M].北京:清华大学出版社,2004:131-141.
[9]张泽生,林纪伟,王志平,等. 比色法测定不同产地黑豆皮中花青素含量[J].食品研究与开发,2012,33(5):143-145.
[10]孙汉巨.菜籽多糖的分离、纯化及特性研究[D].合肥:合肥工业大学,2009.
[11]Sun H,Jiang S,Mu P,et al.Invivoantioxidative capacities of rapeseed meal polysaccharides[J]. Journal of Food,Agriculture & Environment,2009,7(2):97-102.
[12]邹元生,徐瑞,温中平,等.沙棘籽原花青素提取物对小白鼠免疫调节实验研究[J].国际沙棘研究与开发,2012,10(1):5-11.
[13]孙汉巨,姜绍通,赵荣敏.菜籽饼粕多糖对小白鼠免疫功能的影响[J].食品科学,2008,29(11):567-571.
[14]Sun H,Jiang S,Zi M,et al. Purification,chemical composition andinvitroantioxidant activity of two protein-bound polysaccharides from rapeseed meal[J]. Food Science and Biotechnology,2009,18(6):1386-1391.
[15]成绍鑫.腐植酸分子结构与生物活性的关系[J].腐植酸,2002,3:38-43.
[16]张名位,郭宝江,张瑞芬,等. 黑米抗氧化活性成分的分离纯化和结构鉴定[J].中国农业科学,2006,39(1):153-160.
[17]张名位,张瑞芬,郭宝江,等.黑米皮提取物的抗氧化与降血脂作用及其成分分析[J].中国农业科学,2006,39(11):2368-2373.
[18]王金亭,杨敏一.黑米色素苷化学结构与抗氧化活性的关系[J].重庆文理学院学报:自然科学版,2007,26(6):59-61.
[19]张甘良,王钊,鄢洪德.生物类黄酮化合物的结构与生物活性的关系[J].生物学杂志,2005,22(1):4-7.
Study oninvivoantioxidation of anthocyanins from black rice
SHI Juan,ZHANG Man-li,SUN Han-ju*,CHEN Xiao-yan,LOU Qiu-yan,LIU Ning,WANG Xiao
(College of Biotechnology and Food Engineering,Hefei University of Technology,Hefei 230009,China)
This paper studied theinvivoantioxidation and immune modulation functions of anthocyanins from black rice. Saline solution was used as carriers,while vitamin C was used as positive control. Mice were fed with crude and pure anthocyanins at high,medium and low doses,respectively. After feeding for 30 days by mean of irrigation,the spleen and thymus indexes were detected,while T-AOC,SOD,GSH-Px,MDA and hydroxyl radical contents of serum,liver,heart and kidney were also determined. The results indicated that the anthocyanins could increase the spleen and thymus indexes,significantly increase the level of T-AOC,the activity of SOD and GSH-PX,and reduce the contents of MDA and hydroxyl radical. Therefore,the anthocyanins have the functions ofinvivoantioxidation and immune modulation.
black rice;anthocyanins;mouse;antioxidation
2014-05-14
石娟(1986-),女,硕士,研究方向:食品科学。
*通讯作者:孙汉巨(1966-),男,博士,教授,研究方向:农产品的综合利用。
2011年国家自然科学基金项目“31171787”;2012年安徽省长三角联合攻关项目“1201c0602005”。
TS201.4
A
1002-0306(2015)05-0348-05
10.13386/j.issn1002-0306.2015.05.065
