双波长分光光度法测定新鲜怀山药中直链与支链淀粉的含量
2015-03-24王丽霞杨事维曹金丽刘相花
王丽霞,李 彬,杨事维,曹金丽,刘相花,张 凯
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
双波长分光光度法测定新鲜怀山药中直链与支链淀粉的含量
王丽霞,李 彬,杨事维,曹金丽,刘相花,张 凯
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
以新鲜怀山药为原料制备山药粉,通过石灰水浸泡工艺提取山药淀粉。以碘为显色剂,扫描直链淀粉和支链淀粉与碘形成复合物的全波长吸收光谱。利用不同浓度的直链与支链淀粉标准品分别与碘形成复合物从而得到淀粉含量与吸光度差值之间的线性关系制作出标准曲线,根据标准曲线计算出样品中直链淀粉与支链淀粉的含量。根据双波长选择原理和扫描光图谱,确定直链淀粉的测定波长为560nm,参比波长为659nm;支链淀粉的测定波长为600nm,参比波长532nm。实验说明直链淀粉与支链淀粉的测定相对标准偏差分别为0.27%与0.63%、回收率也分别达到了96.18%与97.89%,检出限分别为0.09mg/L与1.58mg/L,再经准确性分析验证了用双波长法测定山药淀粉中直链淀粉与支链淀粉的含量的检测方法具有较为准确的效果。
山药,双波长,直链/支链淀粉
山药为薯蓣科植物薯蓣(DioscoreaoppositaThunb.)的块茎,具有补脾养胃、补肺益肾的功效,对于预防治疗脾虚久泄、慢性肠胃、肺虚咳喘、糖尿病等疾病有重要作用[1]。山药块茎中含多糖、淀粉、蛋白质、游离氨基酸等[2]。山药中含大量淀粉,是重要的淀粉来源,然而当前对于植物淀粉的研究大都数都集中于马铃薯和玉米淀粉上,对于山药淀粉却研究较少。这些都影响了山药淀粉的应用及其深加工的发展[3-5]。
淀粉是植物世界中储备碳水化合物的物质,人类可以利用其中70%~80%的热量,淀粉通常以1~100μm或者更大直径的颗粒状形式存在。淀粉是由脱水葡萄糖通过α-D-(1-4)糖苷键连接而形成的高分子碳水化合物。虽然淀粉的精细结构还没有得到阐述,但是已经确定了淀粉是由支链淀粉与直链淀粉两种异构物质按照不同比例构成的。直链淀粉基本上是由脱水葡萄糖通过α-D-(1-4)糖苷键组成的线性聚合物而支链淀粉却是由α-D-(1-4)糖苷键连接的分支状聚合物,在O-6的位置上有周期性的分支[6]。
山药淀粉中直链淀粉和支链淀粉含量因山药品种不同以及种植地区的不同而有所差异,决定着山药淀粉的品质,并影响着山药淀粉的加工特性与应用。所以测量山药淀粉中直链淀粉与支链淀粉的含量有着重要的现实意义。
1 材料与方法
1.1 材料与仪器
新鲜怀山药 产自河南温县。
直链、支链淀粉标准品 购于Sigma公司;石油醚、无水乙醇、氢氧化钙、氢氧化钾、盐酸、碘、碘化钾、正丁醇等均为分析纯。
DF-101S恒温水浴锅 山东甄诚嘉德仪器厂;ESJ205-4电子分析天平 沈阳龙腾电子称量仪器有限公司;UV-2550PC紫外-可见分光光度计 日本岛津(中国)仪器公司;DFG801电热鼓风箱 湖北省黄石市医疗器械厂;G10S紫外可见分光光度计 美国赛默飞公司。
1.2 实验方法
1.2.1 山药淀粉的提取山药粉的制备工艺:山药→清洗→去皮→切片→烘干→粉碎→过筛→山药粉。将得到的山药粉用pH8的Ca(OH)2按照固液比1∶7浸泡,浸泡时间2h并重复4次;将沉淀用90%乙醇浸泡2h后烘干;利用索氏抽提对所得到的山药淀粉进行脱脂处理[7]。
1.2.2 直链淀粉与支链淀粉的分离纯化 采用正丁醇反复结晶法,称取10g淀粉,加入到500mL的烧杯中,加入少量无水乙醇和蒸馏水使样品湿润,再加入0.5mol/L的NaOH 350mL,沸水浴中加热搅拌20~30min至完全分散,冷却后离心(4000r/min,20min)去沉淀,再以2mol/L的HCl调节pH至中性,加入100mL正丁醇-异戊醇(3∶1体积比)混合液,然后在沸水浴中加热搅拌至溶液透明后冷却至室温,于4℃冰箱中静置24h后离心(4000r/min,20min),离心后得到的上清液即为粗支链淀粉溶液(Ap),得到的沉淀为粗直链淀粉(Am)。
支链淀粉的纯化:上清液中加入20mL正丁醇于沸水浴中加热搅拌至溶液分散透明后冷却至室温。在4℃冰箱中静置24h后离心(4000r/min,20min)弃去沉淀并重复以上操作5次。将收集到的上清液按照2倍体积加入无水乙醇进行沉淀,再以无水乙醇洗涤沉淀5、6次,所得到的沉淀在45℃的烘箱中干燥即为支链淀粉(Ap)样品。
直链淀粉的纯化:向粗直链淀粉中加入240mL的正丁醇-水(体积比为1∶8)溶液,在沸水浴中加热搅拌使其溶解至透明,冷却后于4℃冰箱中静置24h,取出后离心(4000r/min,20min)得到的沉淀,重复以上操作5次后将收集到的沉淀用无水乙醇洗涤5~6次,将样品于45℃烘箱中干燥即得到直链淀粉(Am)样品。
1.2.3 淀粉标准液的配制 分别称取0.1000g支链淀粉和直链淀粉置于100mL的烧杯中,加入1mol/L的KOH溶液10mL,于80℃水浴中充分搅拌15min,再用蒸馏水定容至50mL为支链淀粉和直链淀粉标准液。采用1mol/L的KOH溶液在80℃水浴下分散溶解15min效果最好[8]。
1.2.4 直链淀粉标准曲线的绘制 分别取直链淀粉标准液0.2、0.4、0.6、0.8、1.0、1.2mL于100mL烧杯中,加蒸馏水25mL,以0.1mol/L的HCl溶液调pH至3.0,加0.5mL碘试剂后定容至50mL,静置30min。
1.2.5 支链淀粉标准曲线的绘制 分别取支链淀粉标准液2.0、3.0、4.0、5.0、6.0 mL于100mL烧杯中,加蒸馏水25mL,以0.1mol/L的HCl溶液调pH3.0,加0.5mL碘试剂后定容至50mL,静置30min。
1.2.6 直链淀粉、支链淀粉含量的测定 称取0.1000g的脱脂淀粉,加1mol/L的KOH溶液10mL于100mL烧杯中,将烧杯置于80℃水浴中充分搅拌10min,然后用蒸馏水定容到50mL的容量瓶中,摇匀后静置。取3mL上清液于100mL烧杯中,以加蒸馏水25mL,以0.1mol/L的HCl溶液调节pH至3.0,加0.5mL的碘试剂后转移溶液到50mL的容量瓶中,用蒸馏水加至刻度摇匀后静置。
1.3 山药淀粉中直链淀粉与支链淀粉含量的双波长标准曲线
以蒸馏水为空白,将1.2.4中的支链淀粉标准溶液,用紫外-可见分光光度计分别在波长λ1和参比波长λ3下相应的吸光值A1和A3。以ΔA支=λ1-λ3为纵坐标,支链淀粉质量浓度ρ1(mg/L)为横坐标作图,利用excel绘制双波长支链淀粉标准曲线。采用同样方法,将1.2.5中的直链淀粉标准溶液,用紫外-可见分光光度计分别在波长λ2和参比波长λ4下测定吸光度A2和A4,以ΔA直=A2-A4为纵坐标,直链淀粉质量浓度ρ2(mg/L)为横坐标作图,绘制双波长直链淀粉标准曲线。
1.4 重复性实验
对同一样品进行重复测定,验证该实验方法的稳定性以及可行性。
1.5 准确性与准确度评价方法
在已测得直链淀粉和支链淀粉含量的样品中,添加准确称量的自制直链和支链淀粉纯品,按照上述方法测定直链和支链淀粉的含量,通过以下公式计算回收率和平均回收率。
回收率(%)=混合后测得量-样品中直链淀粉或支链淀粉含量/淀粉纯品的加入量×100
准确度主要是通过回收率来反映,分别称取标准品直链淀粉与支链淀粉5份,记录数据后按照上述方法分别测定其含量,将实测值与理论值比较,计算回收率。并计算出平均回收率以及相对标准偏差(RSD)。
1.6 检出限实验

式(1)
式(2)
根据下式求得检出限:
DL=k·s1
式(3)
式中:DL-检出限,mg/L或%;s1-浓度或含量测定结果的标准差,mg/L或%;k-2或3。
2 结果与分析
根据双波长比色原理[11],若试样溶液在两个波长处均有吸收,则两个波长处的吸光值差值与溶液中待测物质的浓度存在线性关系,从样品溶液中的直链、支链淀粉分别与碘生成络合物的吸收光谱中,可以确定测定波长和参比波长。
2.1 直链、支链淀粉测定波长的确定
直链淀粉与碘作用产生纯蓝色,支链淀粉与碘作用生成紫红色。用这两种淀粉的标准溶液分别碘反应,用紫外可见分光光度计对其分别进行全波长扫描,扫描结果见图1。选择波长需要具备两个基本条件,一是同存组分在这两个波长应具有相同的吸收值,使其浓度变化不影响到测定值,二是待定组分在这两个波长的差值应足够大[12]。因此,根据上述原理和扫描的图谱,确定直链淀粉的测定波长λ2=560nm,参比波长λ4=659nm。支链淀粉的测定波长λ1=600nm,参比波长λ3=532nm。
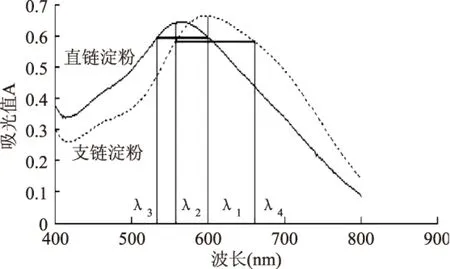
图1 淀粉全波长图Fig.1 Full wavelength figure of starch
2.2 双波长标准曲线绘制结果
2.2.1 直链淀粉标准曲线 使用紫外可见分光光度计在测定波长560nm、参比波长659nm下分别测定吸光值,以直链淀粉浓度为横坐标,以吸光值的差值为纵坐标绘制标准曲线,得到标准曲线的方程:y=0.0069x+0.0042,R2=0.9990。

图2 直链淀粉标准曲线Fig.2 Standard curve of amylose
2.2.2 支链淀粉标准曲线 使用紫外可见分光光度计在测定波长600nm、参比波长532nm下分别测定吸光值,以支链淀粉浓度为横坐标,以吸光值的差值为纵坐标绘制标准曲线,得到标准曲线的方程:y=0.0010x+0.0068,R2=0.9989。
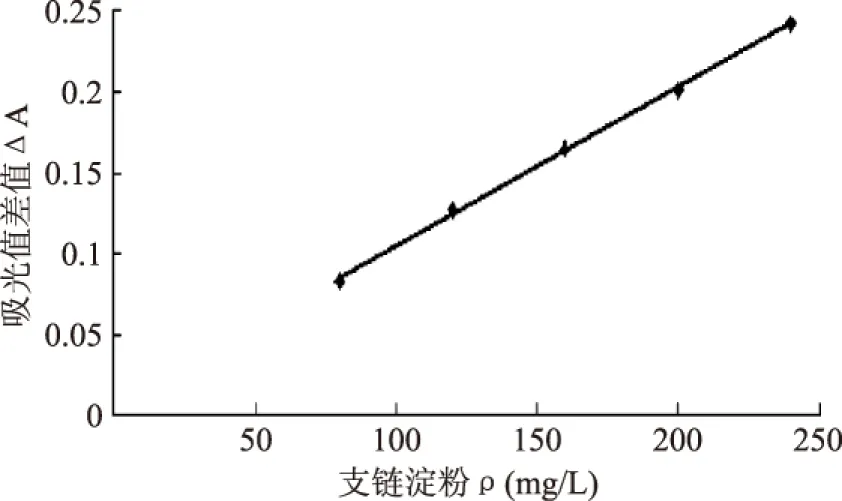
图3 支链淀粉标准曲线Fig.3 Standard curve of amylopectin
2.3 重复性实验
对同一样品进行重复四次测定,结果如表1所示。

表1 重复性实验结果Table 1 Repetitive experimental result
由表1可以看出,通过四次实验测得怀山药中直链、支链淀粉含量,相加后求百分比可以得出怀山药中直链淀粉约占23.96%,支链淀粉约占76.04%,且相对标准偏差不超过1%,实验方法重复性良好。
2.4 双波长测定方法的准确性与准确度实验结果分析
取已测知直链淀粉和支链淀粉含量的山药淀粉,分别在其中添加一定量的直链淀粉或支链淀粉的纯品,按照1.2.6所述的实验方法,计算回收率,结果见表2。

表2 样品回收率测定结果Table 2 Recovery rate determination result of sample

表3 准确度分析Table 3 Accuracy analysis
由表2可知:无论是直链淀粉还是支链淀粉,其平均回收率均在96%~98%之间,同时在表3中可以看出,平均回收率在98%到102%之间,且回收率的相对标准偏差也小于2%,在可接受范围内。说明该分析方法具有较高的准确度,适用于测定山药中的直链淀粉和支链淀粉含量。
2.5 检验限实验分析
分别直链淀粉和支链淀粉的样品重复测定12次,结果如下:

表4 检验限测定结果Table 4 Result of detection limit
根据1.6中的式(3)分别计算出直链淀粉的DL=0.09mg/L,支链淀粉的DL=1.58mg/L。证明该方法实用性很强,可检测范围较大。
3 结论
双波长分光光度法作为淀粉含量的快速测定方法,具有准确性高、重复性和稳定性好的特点,可以应用于不同品种的山药以及其他类型的淀粉的测定,根据吸收光谱特性分析结果,新鲜山药直链淀粉的测定波长为560nm,参比波长为659nm。支链淀粉
的测定波长为600nm,参比波长为532nm。实验表明,显色反映在pH3~5范围内影响不大。
[1]赵彦青,王爱凤. 山药的药理研究进展[J].中医研究,2000,13(5):49-50.
[2]袁丽菊. 不同生长期山药中多糖含量的研究[J].应用化工,2011,40(9):1575-1584.
[3]Wang Shujun,Gao Wenyuan,Chen Haixia,et al.Characterization of new starches separated from different Chinese yam(Dioscoreaopposita Thumb)cultivars[J]. Food Chemistry,2006(99):30-37.
[4]MaliS,Beleia A P,Grosamann MVE,et al.Influence of pH and hydrocolloids addition on yam(Dioscoreaalata)starch pastes stability[J].Lebensmittel-Wissenschaft and Technology,2003(36):475-481.
[5]Chien-Chun Huang,Mei-Chen Lin,Chiun-C.R.Wang.Changes in morphological,thermal and pasting propertiesof yam(Dioscoreaalata)starch during growth[J]. Carbohydrate Polymers,2006(64):524-531.
[6]R A Freitas,R C Paula,J P A Feitosa,et al.Amylose contents,rheological properties and gelatinization kinetics of yam(Dioscoreaalata)and cassava(Manihotutilissima)starches[J]. Carbohydrate Polymers,2004(55):3-8.
[7]李昌文,刘延奇,李延涛. 怀山药淀粉性质研究[J].中国粮油学报,2010,25(8):23-26.
[8]金玉红,张开利,张兴春. 双波长法测定小麦及小麦芽中直链、支链淀粉含量[J]. 中国粮油学报,2009,24(1):137-140.
[9]李海峰.检出限几种常见计算方法的分析和比较[J].光谱实验室,2010,27(6):2465-2469.
[10]Boqué,Ricard;Heyden,Yvan Vander. The limit of detection[J].LC-GC Europe,2009,22(2):82-85.
[11]林美娟,宋江峰,李大婧,等. 用双波长分光光度法测定鲜食玉米中直链淀粉与支链淀粉含量[J].江西农业学报,2010,22(12):117-119.
[12]王文超,贺帆,宋朝鹏,等. 双波长分光光度法测定烟草中的直链淀粉和支链淀粉[J]. 烟草化学,2013,6(311):50-52.
Determination of amylose and amylopectin content infresh yam by dual-wavelength spectrophotometry
WANG Li-xia,LI Bin,YANG Shi-wei,CAO Jin-li,LIU Xiang-hua,ZHANG Kai
(Key Laboratory of Food Nutrition and Safety,Ministry of Education;Tianjin University of Science & Technology,Tianjin 300457,China)
Yam starch was extracted through soak process by whitewash with yam powder which was from fresh yam as raw material. A standard curve was got based on the line relationship between absorption difference and content of starch,which the concentration cycle of standard amylose and amylopectin were used. This research had finally got 560nm for measure wavelength while 659nm for reference wavelength of amylase,600nm for measure wavelength while 532nm for reference wavelength of amylopectin according to the amylose and amylopectin complex full wavelength absorption spectra with iodine as chromogenic agent. The research about content of amylose and amylopectin in the sample with the standard curve had been worked out. According to the experiment,the RSD were 0.27% and 0.63% respectively,recovery data were 96.18% and 97.89%,while detection limit were 0.09mg/L and 1.58mg/L based on the amylose and amylopectin test. Appending accuracy analysis,allconfirmed that the dual-wavelength determining the content of amylose and amylopectin had more accurate effect.
yam;dual-wavelength;amylose/amylopectin
2014-03-24
王丽霞(1966-),女,硕士,研究员,研究方向:农产品加工与功能食品。
河北省省级省校科技合作开发项目。
TS255.1
A
1002-0306(2015)05-0292-04
10.13386/j.issn1002-0306.2015.05.053
