微波杀青制备桑茶及其细胞抗氧化作用研究
2015-03-24刘淑贞孙文静李成龙周才琼
刘淑贞,孙文静,李成龙,周才琼
(西南大学食品科学学院暨重庆市特色食品工程技术研究中心,重庆 400715)
微波杀青制备桑茶及其细胞抗氧化作用研究
刘淑贞,孙文静,李成龙,周才琼*
(西南大学食品科学学院暨重庆市特色食品工程技术研究中心,重庆 400715)
以桑鲜叶为原料,采用微波杀青工艺制备桑茶,并通过建立细胞模型研究微波杀青桑茶不同溶剂提取物抗氧化作用。结果显示:微波杀青桑茶不同溶剂提取物主要抗氧化成分多酚和黄酮类含量分别为26.53~37.67mg/g提取物和18.56~24.89mg/g提取物,细胞抗氧化活性大小为50%乙醇提取物>75%乙醇提取物>95%乙醇提取物>沸水提取物,且桑茶不同溶剂提取物的细胞抗氧化作用均存在剂量-效应关系;显著性分析表明50%~75%乙醇提取物细胞抗氧化能力显著高于沸水提取物和95%乙醇提取物(p<0.05)。细胞内抗氧化活性与提取物中多酚类和黄酮类含量相关性较弱,相关系数分别为0.216、0.129。表明不能用多酚类和黄酮类含量来衡量桑茶提取物细胞抗氧化能力。
微波杀青,桑茶,细胞抗氧化作用
桑叶是一种药食两用天然植物资源,富含多酚类、黄酮甙、桑多糖及生物碱等生物活性物质[1-2]。当机体衰老或长期处于应激状态,机体代谢过程中产生过多活性氧,可引起细胞的氧化损伤,进而引发多种慢性疾病及炎症。日常生活中多摄入一些天然抗氧化物质有助于延缓衰老,预防慢性疾病。目前,多采用化学方法研究植物功能性成分的抗氧化作用[3-4],但化学方法不能模拟复杂的人体环境,抗氧化剂进入人体后的代谢及生理活性会产生变化,因此不能确定抗氧化功能成分的体内抗氧化能力及抗氧化机制。目前有报道采用细胞抗氧化评价体系来研究植物化学素的抗氧化能力[5-7]。
考虑桑叶功能成分特点、我国传统医学对桑叶的利用及茶饮在我国民间的普及,本研究拟采用桑鲜叶为原料制备桑茶。目前,桑茶加工常用的杀青方式有滚筒杀青和蒸汽杀青,这两种杀青方式存在杀青时间长、杀青不均等弊端。有研究发现采用微波杀青,具有升温快、受热均匀的特点,可以快速钝化鲜叶中酶的活性[8]。本实验采用微波杀青工艺制备桑茶,同时针对桑叶富含抗氧化成分多酚类物质等特点,对微波杀青桑茶不同溶剂提取物细胞抗氧化作用及与主要抗氧化成分多酚类相关性进行研究。
1 材料与方法
1.1 材料及处理
桑鲜叶及处理 西南大学桑园基地,选择新鲜、成熟度适中、色泽光亮、深绿、无病虫害的完整桑叶为原料。将新鲜桑叶切分大小为3cm×2cm长条形,以利后续揉捻成型。
新鲜鸡血及处理 北碚天生市场购买健康公鸡,活体采血。取新鲜鸡血10mL进行连续的离心分离,用预冷的PBS冲洗,除去血浆、血小板、血沉黄层,得到的血红细胞用PBS稀释100倍。
1.2 试剂与仪器
茚三酮,丙酮、蔗糖、石油醚(60~90℃)、甲醇、三氯化铁,三氯乙酸,过硫酸钾,铁氰化钾,无水乙醇等 均为分析纯;芦丁标准品 中国医药上海化学试剂公司;2′,7′-二氯荧光二乙酸(DCFH-DA)、2,2,-偶氮异丁基脒二盐酸盐(ABAP)Sigma公司。
电子天平 上海精天电子仪器公司;722型分光光度计 上海菁华科技仪器有限公司;Synergy H4多功能荧光分析仪 德国BIO-TEK公司;台式离心机TDLB80-2B 上海安亭科学仪器厂;超声波清洗仪 昆山市超声仪器有限公司;等。
1.3 实验方法
1.3.1 微波杀青桑茶工艺处理 工艺处理[9-10]:将按1.1处理后的桑叶于25℃室温下摊放,厚度1.5cm,每小时翻动1次,摊放5h后取样→微波杀青(微波功率300W,杀青时间2.5min,投叶量90g)→杀青叶在铁锅中揉捻,锅内温度保持微热→揉捻后的桑茶放入鼓风干燥箱中干燥1.5h,干燥温度108℃,每隔15min取出一次,在室温下摊放10min。干燥和摊放交替进行,直至桑茶含水量在10%以下。
1.3.2 桑茶不同溶剂提取物的制备及得率 微波杀青桑茶磨碎过40目筛,得桑茶粉,于-18℃冰箱中备用。
沸水提取物制备[11]:精确称取桑茶粉10g于具塞三角瓶,加入150mL蒸馏水,100℃沸水提取30min,过滤,相同条件第二次提取,合并两次滤液,真空浓缩后冻干。
不同浓度乙醇提取物的制备[12]:精确称取桑茶粉10g置于具塞三角瓶中。提取条件料液比1∶15,60℃下提取30min,过滤后相同条件进行第二次提取,合并两次滤液,离心,提取液减压真空浓缩至一定体积,经冷冻干燥后得提取物。置于-18℃冰箱备用。
1.3.3 理化指标检测 多酚类[13],黄酮类[14],可溶性糖[15],叶绿素[16]。
1.3.4 桑茶不同溶剂提取物细胞抗氧化作用 细胞模型测定桑茶不同溶剂提取物的细胞内抗氧化能力(CAA-RBC)。
实验原理[5-7]:CAA-RBC法基本原理是利用荧光探针DCFH-DA检测细胞内活性氧的变化。用抗氧化剂混合物及无荧光的DCFH-DA处理鸡血红细胞,二者进入细胞后,在细胞酯酶的作用下,DCFH-DA被分解成还原型二氯荧光素(DCFH)。DCFH不能透过细胞膜到达细胞外。ABAP处理细胞,ABAP进入细胞后自发降解形成过氧化自由基,从而诱发细胞产生活性氧。细胞内的DCFH极易被活性氧氧化成荧光物氧化型二氯荧光素(DCH),荧光物DCH可通过分光光度法测定。抗氧化剂能结合细胞中活性氧,从而阻断有绿色荧光的DCF生成。细胞荧光物质的减少量能反映该化合物的抗氧化能力。荧光值越小,抗氧化剂抗氧化能力越高。
供试液配制:将1.3.2所得的提取物配制成浓度为20mg/mL的桑叶茶不同溶剂提取物。
DCFH-DA荧光探针工作液:用甲醇溶解DCFH-DA,配成浓度为5mmol/L的溶液,-20℃保存备用,实验前用PBS进行稀释。
ABAP工作液:用PBS溶解ABAP,配成浓度为180mmol/L的溶液,-20℃保存备用,实验前PBS进行稀释。
鸡血红细胞处理:按1.1方法得到血红细胞。
取75μL细胞悬液,加入10μmol/L的DCFH-DA溶液和桑茶不同溶剂提取物溶液,37℃培养箱中继续培养2h,每个浓度设3个平行。孵育结束后,用预冷的PBS溶液清洗细胞2次,充分去除细胞表面的样品提取物和DCFH-DA。冲洗完成后在预冷的PBS中重新悬浮。然后转移至96孔板中,在细胞悬液中加入ABAP工作液,使ABAP终浓度为300μmol/L,立即启动多功能酶标仪,测定激发波长为485nm,发射波长为580nm下的荧光值,每5min测定一次,测定50min,CK组用DCFH-DA和ABAP处理,不加桑茶提取物。槲皮素标准品为阳性对照。
细胞内抗氧化活性值(CAA)的计算:荧光值-时间曲线下的积分面积用origin 8.0软件计算处理,按如下公式计算细胞内抗氧化活性值(CAA)。
式中:Area C表示空白对照组荧光值-时间曲线积分面积;Area T表示加入不同浓度桑茶提取物后的荧光值-时间曲线的积分面积;Area Q表示阳性对照组荧光值-时间曲线的积分面积。


表1 微波杀青优化工艺制备桑茶主要品质成分(干基)Table 1 Analysis of main quality ingredients of mulberry tea by microwave fixation optimizing process(dry basis)
注:“-”表示文献中没有收录。

表2 桑茶不同溶剂提取物抑制活性氧氧化DCFH的EC50Table 2 EC50 values of inhibiting ROS-induced DCFH oxidation by different solvents extracts of mulberry tea
注:字母不同代表本列数据之间存在显著性差异(p<0.05);字母相同代表无显著性差异(p>0.05)。

表3 桑茶不同溶剂提取物多酚和黄酮含量及与EC50的相关性分析Table 3 Correlation analysis between contents of polyphenols and flavonoidsin different solvents extracts of mulberry tea and EC50 value
2 结果与分析
2.1 微波杀青制备桑茶主要品质成分及抗氧化成分分析
经对微波杀青工艺制备桑茶主要品质成分进行分析,结果如表1,桑茶叶绿素含量较高,远高于报道的绿茶叶绿素含量,构成了桑茶汤清汤绿叶的基础,桑茶鲜、甜品质成分游离氨基酸和可溶性总糖含量和报道的绿茶相当,表明桑茶茶汤鲜甜风味和绿茶相当,而具有抗氧化作用及轻涩味感的多酚类含量则远远低于绿茶,表明桑茶品质特征为清汤绿叶及滋味鲜甜回甘。
2.2 微波杀青桑茶不同溶剂提取物的细胞抗氧化(CAA-RBC)能力
2.2.1 微波杀青桑茶不同溶剂提取物对细胞内荧光强度的影响 DCFA-DA工作液浓度的测定:选取一系列不同浓度的荧光探针工作液进行预实验测试,结果表明当DCFH-DA浓度低于30μmol/L,荧光猝灭率高,不太稳定;浓度高于100μmol/L,会减小实验的灵敏度,以50μmol/L的DCFA-DA溶液的实验结果最为理想。
ABAP工作浓度的测定:适宜浓度的ABAP能够将DCFH氧化成有绿色荧光的DCF,浓度太高会使生成的荧光太强,浓度太低不能产生足够的荧光强度。预实验中当ABAP浓度为300μmol/L时,桑茶不同提取物能够使荧光值降到比较合适的水平。
血红细胞中荧光强度的动力学曲线见图1。桑茶不同溶剂提取物都能够抑制DCF的荧光强度,且存在剂量-效应关系,在一定浓度范围内,荧光强度随浸出物浓度的增加而减小。荧光强度越小,提取物的抗氧化能力越高,一定范围内,抗氧化能力随浸出物浓度的增加而增强。
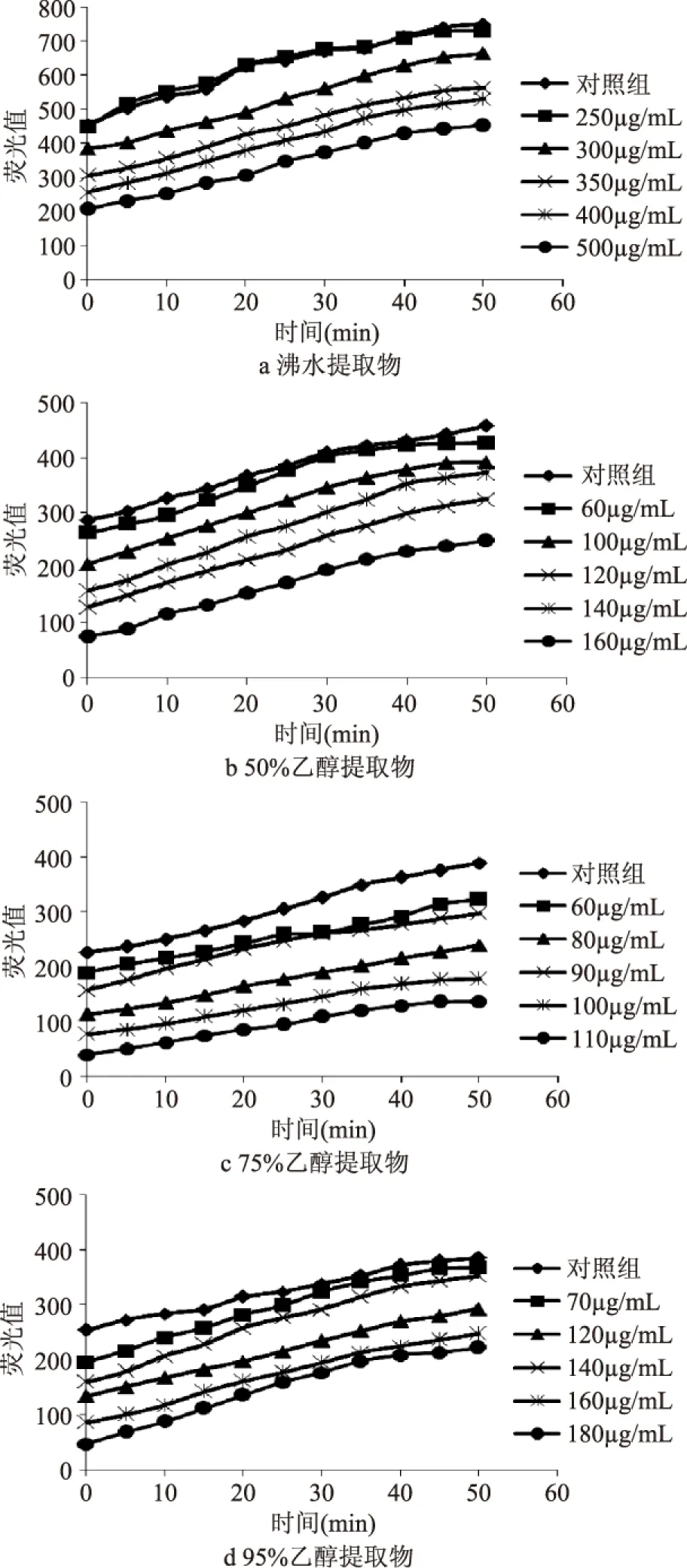
图1 桑茶不同溶剂提取物 对鸡血红细胞细胞内荧光强度的影响Fig.1 Effect of different solvents extracts of mulberry tea on fluorescence of Chicken red blood cells
2.2.2 微波杀青制备桑茶不同溶剂提取物EC50的计算 桑茶不同溶剂提取物的CAA值与其浓度的对数曲线如图2。其细胞抗氧化活性大小为50%乙醇提取物>75%乙醇提取物>95%乙醇提取物>沸水浸出物,以沸水提取物细胞内抗氧化活性最小;显著性分析表明50%~75%乙醇提取物细胞抗氧化能力显著高于沸水提取物和95%乙醇提取物(p<0.05)(表2)。水和亲水性有机溶剂乙醇提取能够得到大部分植物化学成分,如多糖、生物碱、黄酮类、皂苷、蒽醌类等,同时不同浓度的乙醇具有不同的极性,提取物中辅助抗氧化的有效成分和含量有所不同,这些都将影响桑茶提取物的抗氧化能力。

图2 桑茶不同溶剂提取物抑制活性氧氧化DCFH的 剂量效应的对数回归曲线Fig.2 Logarithm regression curves of dose-response of inhibiting ROS-induced DCFH oxidation by different solvents extracts of mulberry tea
2.2.3 微波杀青桑茶不同溶剂提取物多酚和黄酮含量与EC50的相关性分析 微波杀青桑茶不同溶剂提取物总酚和黄酮类含量见表3,经对提取物中多酚和黄酮类化合物与其细胞内抗氧化活性的相关性分析显示细胞内抗氧化活性与多酚和黄酮含量相关性较弱,相关系数分别为0.216、0.129。表明桑茶中重要的抗氧化成分多酚类物质不是影响其细胞抗氧化能力的主要因素。
3 结论与讨论
桑茶50%~75%乙醇提取物细胞抗氧化能力显著高于沸水提取物和95%乙醇提取物(p<0.05),细胞抗氧化能力与提取物中主要抗氧化成分多酚类和黄酮类含量无相关性,相关系数分别为0.216、0.219。于善凯等[18]研究了不同品种杭白菊中酚类物质含量和清除自由基活性的关系,发现菊花中酚类物质的含量高低与抗自由基活性强弱无明显对应关系。Velioglu等[19]对28种植物材料的抗氧化活性和其酚类含量进行比较,结果发现两者间没有明显相关性,并认为是酚类以外的物质在其抗氧化方面起主要作用。这表明不能用多酚类或黄酮类含量衡量桑茶提取物细胞抗氧化能力。这与刘瑞海等[20-21]报道没食子酸、抗坏血酸、咖啡酸和儿茶酸的细胞抗氧化能力很弱,EC50分别是槲皮素的11、11.4、16、49倍,表儿茶素、花旗松素和阿魏酸的细胞抗氧化活性极低,无法计算EC50,染料木素、大豆苷元、芹菜素、柚皮素、柯因、芦丁没有细胞内抗氧化性等有相似之处。同时,有大量多酚及黄酮类等植物化学素具有较强的清除各种自由基等的报道[22-24]。这表明化学抗氧化能力很强的物质不一定就能够进入细胞内清除自由基,即单独用化学抗氧化方法评价某物质的抗氧化能力有误差,建议通过建立细胞模型综合评价食物的抗氧化性。
本实验中还发现低浓度桑茶提取物有促氧化活性,能刺激细胞产生ROS,氧化DCFH使其生成的绿色荧光增强,甚至比只加入ABAP的空白对照的荧光值还要大,见图1a;同时,在预实验中,其它三种溶剂提取物在低浓度时也能够增大细胞内荧光值,这说明低浓度桑茶提取物有促氧化活性,可能桑茶提取物中富含的黄酮类化合物会刺激细胞内与ROS有关的机制,或者被细胞内的多酚氧化酶氧化产生H2O2,也有研究报道黄酮类物质具有这种双重特性[25-26],故研究细胞内抗氧化能力必须考虑剂量-效应关系。
考虑本实验50%~75%乙醇提取物细胞抗氧化能力相对最佳,后续研究需要针对该提取物有关成分进行分提并对其进行深入研究。
[1]Doi K,Kojima T,Makino M,et al. Studies on the constituents of the leaves of Morus alba L[J].Chemical & pharmaceutical bulletin,2001,49(2):151-153.
[2]杨超英,董海丽,纵伟.桑叶的化学成分及在食品工业中的应用[J].食品研究与开发,2003,24(2):8-11.
[3]赵艳红,李建科,李国秀.天然抗氧化物体外活性评价方法的优选与优化[J].食品科学,2008,29(6):64-69.
[4]Prior Ronald L,Wu Xianli,Schaich Karen. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J].Journal of Agricultural and Food Chemistry,2005,53(10):4290-4302.
[5]Angelino Donato,Gennari Lorenzo,Blasa Manuela,et al.Chemical and cellular antioxidant activity of phytochemicals purified from olive mill waste waters[J].Journal of Agricultural and Food Chemistry,2011,59(5):2011-2018.
[6]Serem June C,Bester Megan J. Physicochemical properties,antioxidant activity and cellular protective effects of honeys from southern Africa[J]. Food Chemistry,2012,133(4):1544-1550.
[7]Yokomizo Atsushi,Moriwaki Masamitsu. Effects of uptake of flavonoids on oxidative stress induced by hydrogen peroxide in human intestinal Caco-2 cells[J].Bioscience,Biotechnology,and Biochemistry,2006,70(6):1317-1324.
[8]周天山,余有本,李冬花,等.微波杀青对绿茶品质的影响[J].中国茶叶,2010,32(2):20-21.
[9]倪德江,陈玉琼.加工工艺对名优绿茶主要品质化学成分的影响[J].华中农业大学学报,1998,17(1):84-88.
[10]郭丽,谭俊峰,王力,等.花香型绿茶加工工艺的研究[J].浙江农业科学,2009(5):946-948.
[11]杨普香,黎小萍. 桑叶黄酮类化合物的侧定方法研究[J].食品科学,2001,22(10):81-82.
[12]陈菁菁.桑叶总黄酮的分离纯化和降血脂作用[D].杭州:浙江大学,2006.
[13]雷桂兰,吴中华,刘世旺,等.苦荆茶中多酚类物质的含量测定[J].长江大学学报:自然科学版,2005,2(1):37-39.
[14]何书美,刘敬兰.茶叶中总黄酮含量测定方法的研究[J].分析化学,2007,35(9):1365-1368.
[15].曹建康,玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.
[16].唐晓波,刘晓军,师大亮,等.茶叶中叶绿素含量的季节性差异研究[J].浙江农业科学,2009(3):502-503.
[17]黄建琴,丁勇,徐奕鼎,等.鲜叶摊放对条形绿茶品质的影响研究[J].浙江农业科学,2009(3):502-503.
[18]于善凯,张英.不同品种杭白菊中酚类物质含量和清除自由基活性的比较[J].食品科学,2001,22(4):84-87.
[19]Velioglu Y S,Mazza G,Gao L,et al. Antioxidant activity and total phenolics in selected fruits vegetables and grain products[J].Journal of Agriculrural and Food Chemistry,1998,46(10):4113-4117.
[20]Wolfe Kelly L,Liu Rui Hai. Cellular antioxidant activity(CAA)assay for assessing antioxidants,foods,and dietary supplements[J].Journal of Agricultural and Food Chemistry,2007,55(22):8896-8907.
[21]Wolfe Kelly L,Liu Rui Hai. Structure-activity relationships of flavonoids in the cellular antioxidant activity assay[J]. Journal of Agricultural and Food Chemistry,2008,56(18):8404-8411.
[22]Pazos M,Gallardo J M,Torres J L,et al. Activity of grape polyphenols as inhibitors of the oxidation of fish lipids and frozen fish muscle[J]. Food Chemistry,2005,92(3):547-557.
[23]RiceEvans C,Miller N J,Bolwell P G,et al. The relative antioxidant activity of plant-derived polypheneolic flavonoids[J]. Free Radical Research,1995,22:375-383.
[24]RiceEvans C,Miller N J. Antioxidant activities of flavonoids as bioactive components of food[J].Biochemical Society Transactions,1996,24:790-795.
[25]Fukumoto L R,Mazza G. Assessing antioxidant and prooxidant activities of phenolic compounds[J].Journal of Agricultural and Food Chemistry,2000,48(8):3597-3604.
[26]董捷,张红城,李慧,等.八种蜂花粉醇提物的体外抗氧化能力研究[J].营养学报,2010,32(3):309-312.
Study on the cell antioxidant activity ofmulberry tea by microwave fixation
LIU Shu-zhen,SUN Wen-jing,LI Cheng-long,ZHOU Cai-qiong*
(Engineering and Technology Research Centre of Characteristic Food & Food Science College,Southwest University,Chongqing 400715,China)
Mulberry leaf is a kind of natural plant resources,which is rich in bioactive substance including polyphenols,flavonoid glycoside,polysaccharides and alkaloidals. Fresh mulberry leaves served as raw material to process mulberry tea by microwave fixation. The main quality and antioxidant ingredients including chlorophyll,free amino acids,soluble sugar,polyphenols and flavones of mulberry tea were analyzed. Cell antioxidant activity of different solvent extracts from mulberry tea by microwave fixation was investigated by establishing cell model in this experiment,which called CAA-RBC method for short. The contents of polyphenols and flavones of different solvent extracts of mulberry tea by microwave fixation were 26.53~37.67mg/g and 18.56~24.89mg/g,respectively. The ability of cell antioxidant activity of different solvent extracts of mulberry tea was 50% ethanol extract>75% ethanol extract>95% ethanol extract>boiling water extract and existed dose effect. Significance analysis showed that the cell antioxidant activity of 50%~75% ethanol extracts were higher than boiling water extract and 95% ethanol extract(p<0.05). The correlation between cell antioxidant activity and contents of polyphenols and flavones was weak. The coefficient correlation were 0.216,0.129,respectively. So the contents of polyphenols and flavones could not be measured cell antioxidant activity of extracts of mulberry tea.
microwave fixation;mulberry tea;cell antioxidant activity
2014-06-12
刘淑贞(1990-),女,在读硕士研究生,研究方向:食品化学与营养学。
*通讯作者:周才琼(1964-),女,博士,教授,研究方向:食品化学与营养学。
TS272.5
A
1002-0306(2015)05-0103-05
10.13386/j.issn1002-0306.2015.05.013
