脱二氧喹赛多在大鼠血浆及组织的药代动力学研究
2015-03-18赵东豪周宇峰方炳虎刘雅红
杨 雪,赵东豪,于 洋,周宇峰,时 伟,方炳虎,刘雅红
(华南农业大学兽医学院,广东 广州 510642)
喹赛多(Cyadox)属喹噁啉类药物,是一种新型的饲料添加剂,由于它具有较低的毒性和良好的促生长作用,因此应用前景广阔[1-2]。喹赛多在动物体内可迅速代谢成多种化合物,已有喹赛多的主要代谢途径及代谢物的相关报道[3-5]。其中脱二氧喹赛多(1,4-bisdesoxycyadox)是喹赛多的主要代谢产物之一,已有研究认为其可能为喹赛多的残留标志物[6],但目前针对脱二氧喹赛多在大鼠血浆及组织的药动学研究尚未开展。因此了解脱二氧喹赛多在动物体内的处置过程非常重要。Yan 和He 等建立了高效液相串联质谱检测喹赛多及脱二氧喹赛多的方法[7-8]。国内外相继报道了喹赛多及其代谢物在猪、鸡、鱼的药动学及残留消除研究[9-14],为药物在动物上的合理使用奠定了基础。本研究探讨了单剂量口服喹赛多后,其主要代谢物脱二氧喹赛多在健康大鼠血浆及各组织中的药物动力学过程,通过分析药动学参数,掌握其药动学特征,深入了解脱二氧喹赛多在大鼠体内的分布和消除情况。
1 材料与方法
1.1 主要材料 药品:喹赛多原料药,含量98%,由华中农业大学兽药研究所合成。脱二氧喹赛多,含量98%,由中国农业大学兽医药理研究室提供。仪器:Agilent 1200 高效液相色谱仪,购自美国安捷伦公司;API 4000 电喷雾-串联四级杆质谱仪,购自美国应用生物系统公司;试验动物:Wistar 雌性大鼠150 只,体重250±30 g,购自南方医科大学。150 只大鼠被随机分为15 组,每组10只,其中1 组为空白对照组,其他14 组口服喹赛多(200 mg/kg 体重)后,分别在预设的14 个时间点采集样品。
1.2 给药及样品采集 大鼠在给药前称重和编号。取喹赛多原料药,用0.5%羧甲基纤维素钠配成50 mg/mL 的混悬液,现用现配。大鼠保定好后,以200 mg/kg 体重的剂量口服给药。给药后分别在0.25、0.5、1、2、3、5、6、7、8、10、12、16、24 h 和48 h 将对应的大鼠处死,采集血液及组织,同时从空白组采集空白样品。将收集的1.5~2.0 mL 血液,置于含肝素钠的塑料离心管中,3 000 r/min 离心10 min,分离血浆。采集的组织样品重2 g 左右,经生理盐水清洗后,用滤纸吸干,装入已编号的样品袋中。所有样品均在-20 ℃保存,并予1 周内检测完毕。
1.3 血浆及组织样品处理[7-8]取血浆样品0.25 mL,置于离心管中,加入0.25 mL乙腈,旋涡振荡1 min后于12 000 r/min离心10 min,上清液经0.22 μm滤膜过滤后,备检。取组织样品0.5 g,用5 mL乙酸乙酯提取两次,合并上清液于40 ℃下N2吹干,残留物用6 mL甲醇/水(1/5)复溶,过Oasis MAX固相萃取小柱,最后用1 mL甲酸/乙腈(2/98)进行洗脱。洗脱液12 000 r/min离心5 min,经0.22 μm滤膜过滤,上机检测。
1.4 色谱及质谱工作条件 色谱柱:Luna C18(150×2.0 mm id,5 μm),购自美国Phenomenex 公司。流动相包括0.1%甲酸水(A)和乙腈(B),流速0.2 mL/min。梯度洗脱程序如下:0~4.5 min 98~20%A,4.5~5.9 min 20%A,5.9~6.0 min 20~98%A,6.0~14.0 min 98%A;柱温:35 ℃;进样量:5 μL。采用多反应监测扫描模式;电喷雾离子源;负离子扫描;喷雾电压-4.2 kV,雾化气压力50 psi,辅助气流速55 L/min,气帘气压力20 psi,离子源温度600 ℃,碰撞室压力7 psi。监测离子对为238.0→65.9,238.0→142.9,其中238.0→65.9 以其较高的灵敏性被选作定量离子对。
1.5 数据处理 血浆和组织样品中脱二氧喹赛多的浓度经液质联用仪的Analyst 1.5 软件处理得到。所有的药物浓度-时间数据经WinNonlin 6.1(美国Pharsight 公司)软件的非房室模型拟合,计算脱二氧喹赛多在血浆及各组织中的药动学参数,同时以药物浓度平均值对时间作药-时曲线图。
2 结果
2.1 色谱分析 通过测定不同浓度脱二氧喹赛多的信噪比(S/N),确定该代谢物的检测限(S/N=3)为1 μg/L,定量限(S/N=10)为2 μg/L。在5~500 ng/mL 的范围内,脱二氧喹赛多的线性关系良好,相关系数大于0.999。血浆和各组织的脱二氧喹赛多的回收率为86.40%-99.20%,批内变异系数为2.80%-13.80%,批间变异系数为3.51%-9.60%。
2.2 药物代谢动力学特征 大鼠口服200 mg/kg体重的喹赛多后,不同时间点的血浆及组织药时曲线如图1。采用非房室模型法计算血浆及组织中的药物代谢动力学参数,结果如表1。
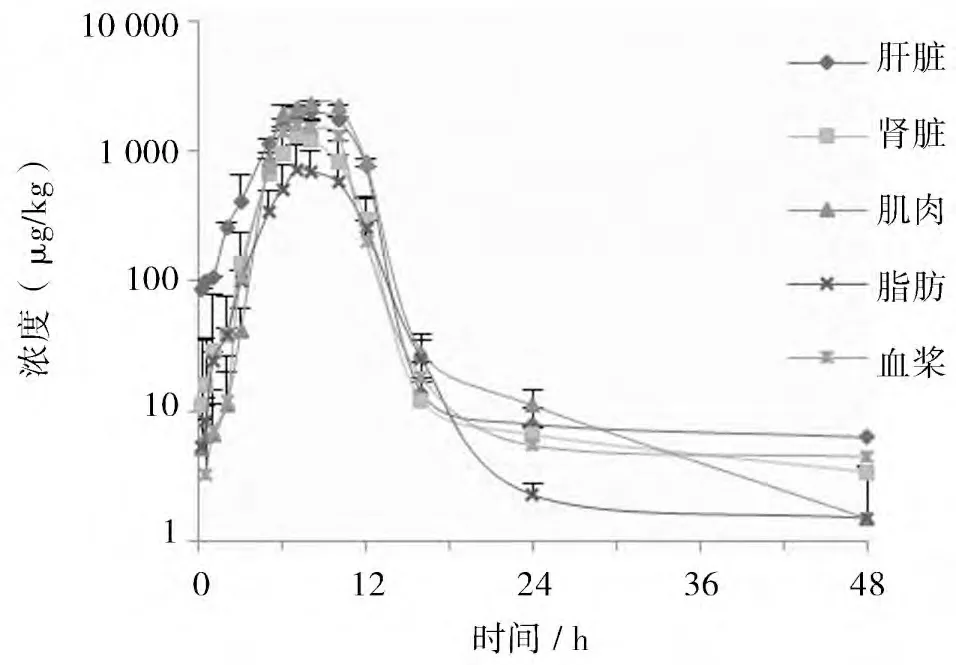
图1 大鼠口服喹赛多(200mg/kg体重)后血浆及各组织的药物浓度-时间对数曲线

表1 大鼠单剂量口服喹赛多(200mg/kg体重)脱二氧喹赛多在血浆及各组织中的药动学参数
3 结论与讨论
3.1 脱二氧喹赛多在血浆中的药动学特征 从药时曲线上可以看出,除了肝脏,其他组织均在2 h后检测出较高浓度的脱二氧喹赛多,这表明喹赛多在动物体内生成代谢产物的过程相对较慢。血浆药动学结果表明,脱二氧喹赛多在大鼠体内的血药浓度-时间数据适合用非房室模型拟合,其T1/2β为4.63 h,稍低于Zhao[12]报道的猪(40 mg/kg体重)的T1/2β(5.77 h),而稍高于郭军朋[11]报道的猪(40 mg/kg 体重)的T1/2β(3.85 h),说明脱二氧喹赛多在大鼠体内的消除速率在种属间的差异较小。本研究中脱二氧喹赛多在血浆中的Tmax 为7.00 h,略大于邱银生[10]报道的猪(40 mg/kg 体重)的Tmax(6.30 h),而与Zhao[12]报 道的猪的Tmax(7.25 h)相近,说明脱二氧喹赛多的达峰时间在种属间差异较小。本研究中脱二氧喹赛多的AUC0→∞为9937.08 h*μg/L,高于Zhao[12]报道的猪的AUC0→∞(1380.00 h*μg/L)、殷居易[9]报道的鲤(40 mg/kg 体重)的AUC0→∞(1890.00 h*μg/L),这说明AUC0→∞在种属间有一定的差异。大鼠口服喹赛多后脱二氧喹赛多的血浆清除率Cl/F 为20.13 L/h·kg,表观分布容积V/F 为134.35 L/kg,说明脱二氧喹赛多在大鼠体内分布广泛,清除缓慢。
3.2 脱二氧喹赛多在各组织中的药动学特征本研究中脱二氧喹赛多在各组织内T1/2β的顺序为:肝脏>肾脏>肌肉>脂肪。T1/2β的数值表明化合物在各组织中的消除速率较慢,其中肾脏T1/2β高于颜丹丹[14]报道的鸡(50 mg/kg 体重连续多剂量灌服给药7 d)肾脏T1/2β(3.71 h),与Li[13]报道的猪(20 mg/kg 体重连续多剂量灌服5 d)的各组织T1/2β(肝脏、肾脏、肌肉和脂肪分别为29.84、26.55、20.00 h 和19.52 h)有一定的差异,这可能和动物的种属差异和不同的给药方式有关。本研究中脱二氧喹赛多在各组织内的AUC0→∞顺序为肌肉>肝脏>肾脏>脂肪,说明脱二氧喹赛多在大鼠肌肉中的残留水平较高,在脂肪中较低,该结果和Li[13]报道的肾脏>肝脏>脂肪>肌肉有一定的差别。本研究中脱二氧喹赛多在各组织内的平均MRT 大小顺序为肝脏>肌肉>肾脏>脂肪,其中肾脏MRT稍高于颜丹丹[14]报道的鸡的肾脏MRT(6.48 h),该结果可以为临床上喹赛多休药期的制定提供参考。
3.3 总结 本文研究了大鼠单剂量口服喹赛多后,其代谢产物脱二氧喹赛多在血浆及组织中的药动学,通过与其他种属药动学特征的比较,可以看出,喹赛多代谢为脱二氧喹赛多的过程比较缓慢、消除速率低、达峰浓度高、在大鼠体内分布广泛。本文填补了喹赛多单剂量给药下各组织药物浓度变化的研究空白,为今后关于喹赛多及其代谢物的药动学研究提供参考,也可作为建立生理模型并外推至其他动物的前期工作。目前关于喹赛多在动物体内的残留标志物和残留靶组织仍没有确切的规定,本研究的结果可以为其他动物的残留消除研究提供借鉴,为休药期的制定提供参考,从而在生产中更合理的使用该药物。
[1]Wang X,He Q H,Wang Y L,et al.Achronic toxicity study of cyadox in Wistar rats [J].Regul Toxicol Pharm,2011,59(2):324-333.
[2]姚观崇,林彬全,郭俊杰,等.喹赛多对肉兔的促生长作用研究[J].仲恺农业技术学院学报,2008,21(1):6-9.
[3]Wu H X,Li L X,Shen JZ,et al.In vitro metabolism of cyadox in rat,chicken and swine using ultra-performance liquid chromatography quadrupole time-of-flight mass spectrometry [J].JPharmaceut Biomed,2012,67-68:175-185.
[4]Xu N,Huang L L,Liu Z L,et al.Metabolism of cyadox by the intestinal mucosa microsomes and gut flora of swine,and identification of metabolites by high-performance liquid chromatography combined with ion trap/time-of-flight mass spectrometry[J].Rapid Commun Mass Sp,2011,25(16):2333-2344.
[5]Liu Z Y,Huang L L,Dai MH,et al.Metabolism of cyadox in rat,chicken and pig liver microsomes and identification of metabolites by accurate mass measurements using electrospray ionization hybrid ion trap/time-of-flight mass spectrometry[J].Rapid Commun Mass Sp,2009,23(13):2026-2034.
[6]胥宁.喹赛多在猪、鸡、鱼和大鼠体内代谢及分布研究[D].武汉:华中农业大学,2012.
[7]Yan DD,He L M,Zhang G J,et al.Simultaneous determination of cyadox and its metabolites in chicken tissues by LC-MS/MS[J].Food Anal Method,2012,5(6):1497-1505.
[8]He L M,Liu K Y,Su Y J,et al.Simultaneous determination of cyadox and its metabolites in plasma by high-performance liquid chromatography tandem mass spectrometry[J].JSep Sci,2011,34(15):1755-1762.
[9]殷居易.喹赛多在鲤体内的药物动力学及残留的研究[D].武汉:华中农业大学,2003.
[10]邱银生.喹赛多在猪体内的药动学和残留研究[D].武汉:华中农业大学,2003.
[11]郭军朋,张展,远立国,等.喹赛多及其主要代谢物在猪体内的药代动力学研究[J].中国畜牧兽医,2011,38(9):228-231.
[12]Zhao N,Wang L,Lu X X,et al.Pharmacokinetics of cyadox and its major metabolites in swine after intravenous and oral administration [J].JIntegr Agr,2013,12(3):495-501.
[13]Li Y F,Zhao N,Zeng Z L,et al.Tissue deposition and residue depletion of cyadox and its three major metabolites in pigs after oral administration [J].JAgr Food Chem,2013,61:9510-9515.
[14]颜丹丹.喹赛多及其主要代谢物在鸡组织中的残留检测方法及消除规律研究[D].广州:华南农业大学,2012.
