金黄色葡萄球菌诱导大鼠乳腺炎模型的建立
2015-03-18余光涛顾铭杰王培莉李建基
王 亨 ,余光涛,顾铭杰,于 惠,张 军,王 艳,王培莉,林 宇,孟 霞,李建基
(1.扬州大学兽医学院,江苏 扬州225009 ;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
奶牛乳房炎是影响奶牛生产性能的重要疾病,可导致产奶量急剧下降,严重者可引起败血症,甚至死亡,造成巨大的经济损失。金黄色葡萄球菌、大肠杆菌和链球菌是导致乳腺炎的最常见的3 种细菌[1]。其中,金黄色葡萄球菌虽然不是典型的胞内寄生菌,但是该病原可以通过内在化进入宿主细胞,形成生物膜,在上皮细胞、巨噬细胞中生存,躲避抗生素的治疗,难以控制和清除,形成亚临床或慢性感染[2]。建立金黄色葡萄球菌感染大鼠乳腺的动物模型,对于研究感染和逃避机制,机体抵抗感染的先天性免疫机制,以及为治疗药物的开发都具有重要意义。鉴于此,该试验进行了金黄色葡萄球菌感染大鼠乳腺模型的研究。
1 材料
1.1 主要试剂与仪器 营养肉汤培养基和琼脂培养基,购自中国医药集团化学试剂有限公司;戊巴比妥钠,购自Sigma 公司;高速冷冻离心机(Eppendorf 公司,德国);动物血球分析仪(深圳迈瑞生物医疗电子股份有限公司);光学显微镜(Nikon,日本);隔水式电热恒温培养箱和培养摇床(上海新苗医疗器械制造有限公司);自制大鼠通乳针。
1.2 试验动物及分组 体重为275±25 g 同龄妊娠Wistar 大鼠84 只(由扬州大学比较医学中心提供),随机分为试验组和对照组(n=42)。
1.3 菌种 金黄色葡萄球菌,分离自临床乳房炎病例,由扬州大学兽医外科教研室保存。
2 方法
2.1 金黄色葡萄球菌的培养与计数 将保存的细菌接种营养琼脂固体培养基,37 ℃培养18 h,挑取单菌落接种营养肉汤,37 ℃,160 r/min,培养24 h。离心菌液,并用无菌生理盐水洗涤2 次后,制成细菌悬液,采用平板计数法计数,菌液放置于4 ℃冰箱备用。使用时,调整菌液浓度为2×107CFU/mL。
2.2 接种方法 于产后4 d 接种细菌。试验组用通乳针经乳头管将浓度为2×107CFU/mL 菌液接种第4 对乳腺(双侧),每侧0.1 mL。灌注后轻柔按摩。对照组注射等量的无菌生理盐水,其他操作同试验组。
2.3 样品采集及处理 分别在0 h(灌注前)和灌注后6、12、24、48、72 h 和96 h,取试验组和对照组大鼠各6 只,观察临床症状,感触乳房温度。麻醉后分离鼠膝部第四对乳腺,观察乳腺组织的形态,无菌取乳腺组织用于乳腺中的细菌计数;另取一份置于中性福尔马林中固定,做组织学检查。采集抗凝血用于血常规检测。称量脾和胸腺的重量,检测脏器指数。
2.4 乳腺组织中金黄色葡萄球菌的计数 将乳腺组织放入无菌的匀浆器中,加入生理盐水(1 mL:100 mg),研磨后转移至15 mL 离心管中,10 000 r/min(4 ℃)离心5 min,弃上清,加入等体积的生理盐水重悬,重复以上操作,然后采用平板计数法计数。
2.5 数据处理 应用SPSS19.0 软件对数据进行显著性分析,统计结果以平均值±标准误表示。以“*”表示差异显著,P<0.05,以“**”表示差异极显著,P<0.01。
3 结果
3.1 临床症状及组织学检查结果 试验组大鼠注菌后精神沉郁,饮食欲较注菌前减退,乳房局部增温。注菌12 h 后,剖检眼观即可见乳腺肿胀、充血(见中插彩版图1,A)。组织学变化:注菌前乳腺腺泡结构完整,小叶间结缔组织排列整齐(见中插彩版图1,B);注菌后6 h,腺泡内粒细胞增多,基质中炎性细胞浸润(见中插彩版图1,C);注菌后12 h,腺泡内大量粒细胞浸润,并伴有浆液性渗出,腺泡内现脱落坏死的上皮细胞。毛细血管扩张,基质内粒细胞浸润(见中插彩版图1,D);注菌后24 h,炎性细胞继续增多,广泛分布于腺泡和小叶间结缔组织,腺泡上皮细胞脱落、坏死(见中插彩版图1,E);注菌后48 h,腺泡结构进一步受到破坏,结构不清(见中插彩版图1,F);注菌后72 h,乳腺腺泡受到严重破坏,填充大量坏死组织(见中插彩版图1,G);注菌后96 h,乳腺腺泡萎缩,炎性细胞减少,结缔组织增生(见中插彩版图1,H)。对照组乳腺剖检和组织学无明显变化。
3.2 乳腺组织中感染细菌量的检查结果 大鼠乳腺注菌6 h,乳腺组织内金黄色葡萄球菌显著升高,后开始下降,12、24、48、72 h 和96 h 时间点较注菌6h 细菌数目均极显著减少(P<0.01)(见表1)。对照组注射生理盐水前后,乳腺组织内均未分离到细菌。
3.3 胸腺和脾脏脏器指数检查结果 试验组,胸腺指数在注菌后6、12、24、72 h 和96 h 较0 h 极显著升高(P<0.01),48h 较0 h 显著升高(P<0.05);脾脏指数在6、24 h 和72 h 较0 h 极显著升高(P<0.01),在12 h 和96 h 脾脏指数 较0 h 显著升 高(P<0.05)。对照组,胸腺和脾脏指数均未见显著变化(P>0.05)(见图2,3,4)。

表1 试验组乳腺组织中金黄色葡萄球菌数目的变化
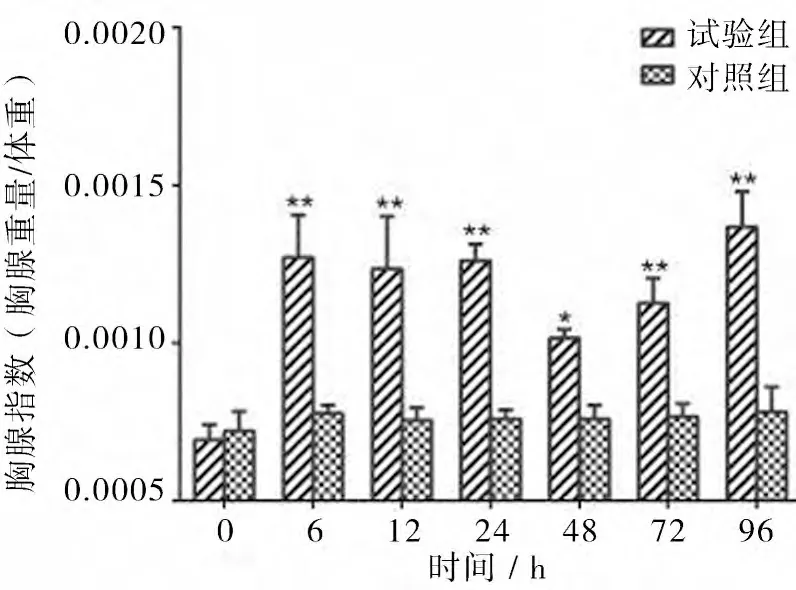
图2 胸腺指数的变化
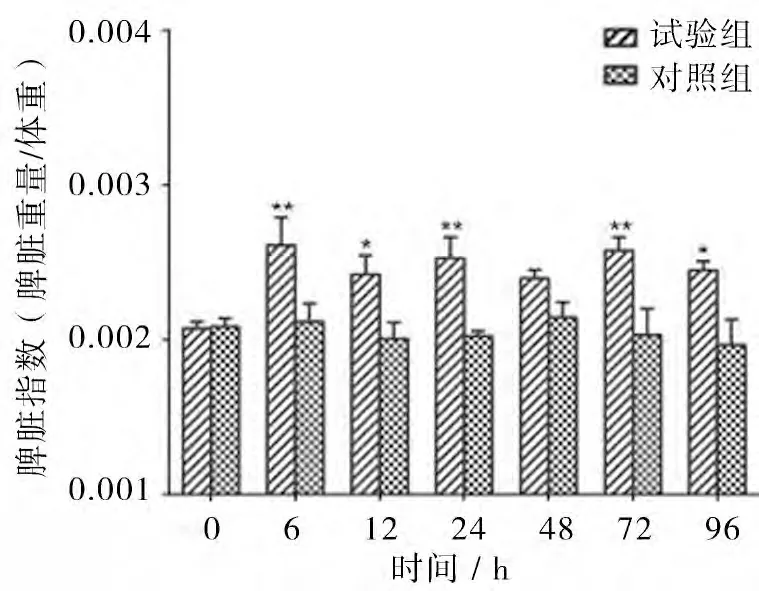
图3 脾脏指数的变化
3.4 外周血嗜中性粒细胞数的检测结果 与0 h相比较,注菌后6 h,嗜中性粒细胞数迅速升高,在6 h 和12 h 较0 h 极显著升高(P<0.01);对照组注射生理盐水后各时间点,嗜中性粒细胞数均无显著变化(P>0.05)(见图4)。
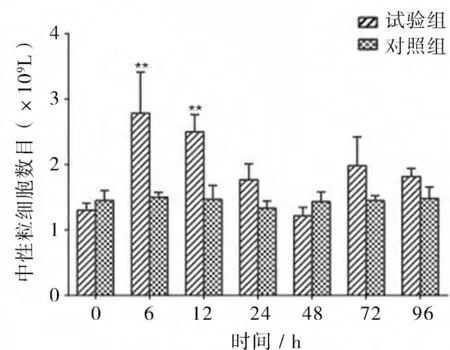
图4 外周血嗜中性粒细胞总数的变化
4 讨论
乳房炎的动物模型,最早是在1970 年由Chandler[3]建立的小鼠细菌性乳房炎模型。之后众多学者采用该动物模型进行细菌性乳房炎、疫苗开发及药物治疗研究[4-6]。小鼠乳腺动物模型虽然成功复制了奶牛乳腺炎,但细菌接种需要借助放大镜,且需切除部分乳头,存在感染风险[3]。钟凯等[7]在小鼠乳房炎模型的基础上,通过乳头管灌注内毒素诱发大鼠的乳腺炎。张书起等[8]通过大肠杆菌接种大鼠乳腺,成功诱导了大肠杆菌性乳腺炎。
由于大鼠的体型较小鼠大,乳导管明显,采用自制通乳针在眼睛直视的情况下就可以将针头置入乳腺管,注入菌液。该方法操作简便,不需要切除部分乳头,可操作性强。试验发现,外周血中的嗜中性粒细胞在注菌后6 h 和12 h 升高,与注菌0 h 差异极显著,之后差异不显著。说明注菌后,可快速激发机体免疫防御体系,参与乳腺局部的免疫反应。同时在组织学的动态观察中也发现,在6 h、12 h 和24 h,乳腺腺泡内PMNs 逐渐增多,之后出现腺泡损伤,结构不清,萎缩等组织学变化。钟凯等采用内毒素诱发大鼠乳腺炎试验中,发现不同剂量的内毒素均可引起嗜中性粒细胞在乳腺中的浸润和游出,并随剂量的升高,腺泡的破坏程度加重[7]。杨明峰等[9]在用金黄色葡萄球菌诱导小鼠乳腺炎中,发现乳腺上皮肿胀、脱落,大量淋巴细胞浸润。而本研究中采用大鼠作为动物模型,观察到接种后,随着时间的推移,乳腺腺泡和基质中有大量的PMNs浸润,即嗜中性粒细胞浸润为主,这与临床奶牛乳腺炎的发病相似。
在对乳腺组织细菌载量的检测中发现,注菌后6 h,组织中细菌含量急剧升高,之后开始下降,但在96 h 时依然可以分离到金黄色葡萄球菌,高于300 CFU/mg 乳腺组织。说明注菌后,虽然外周血的炎症反应在12 h 后恢复正常,组织学中炎性细胞减少,但金黄色葡萄球菌依然存在,而且细菌的含量高于有关学者在小鼠乳腺中检测到细菌量100 CFU/mg 乳腺组织[5],说明在大鼠乳腺接种金黄色葡萄球菌后,乳腺中细菌载量虽然减少,但可持续性存在,引发该疾病的传播,与临床金黄色葡萄球菌感染进程相似。
胸腺是中枢免疫系统,脾脏是淋巴细胞居留和增殖以及产生特异性免疫的器官。脾脏肿大是感染后T 淋巴细胞和B淋巴细胞增殖的表现,因此胸腺脾脏指数间接反映了机体对各种刺激的免疫反应[10]。试验中发现,胸腺指数和脾脏指数在接种后,直至96 h,均出现显著或极显著升高。说明接种后,胸腺和脾脏均发生了不同程度的增殖,增加了淋巴细胞的活化,但也可能与其提高机体抗氧化活性,减轻自由基损伤有关[7、11]。
综上所述,该研究建立了金黄色葡萄球菌感染大鼠乳腺的动物模型,动态观察了不同时间点乳腺病理组织学和细菌载量的变化,证实该模型可建立与奶牛金黄色葡萄球菌乳腺感染类似的病理过程。因此,可利用该模型研究细菌与乳腺相互作用,药物和疫苗研制等,具有很好的应用价值。
[1]Pu W,Su Y,Li J,et al.High incidence of oxacillin-susceptible mecA-positive Staphylococcus aureus(OS-MRSA)associated with bovine mastitis in China[J].PLoSOne,2014,9(2):e88134.
[2]Bardiau M,Detilleux J,Farnir F,et al.Associations between properties linked with persistence in a collection of Staphylococcus aureus isolates from bovine mastitis[J].Vet Microbiol,2014,169(1-2):74-79.
[3]Chandler R L.Experimental bacterial mastitis in the mouse[J].JMed Microbiol,1970,3(2):273-282.
[4]Reid I M,Harrison R D,Anderson JC.Experimental staphylococcal mastitis in the mouse.Amorphometric study of early changes in mammary gland structure[J].JComp Pathol,1976,86(2):329-336.
[5]Brouillette E,Malouin F.The pathogenesis and control of Staphylococcus aureus-induced mastitis:study models in the mouse[J].Microbes Infect,2005,7(3):560-568.
[6]孙勇,李德鹏,张雯,等.栀子苷对LPS诱导的小鼠乳腺炎的抑制效果[J].中国兽医科学,2013,43(8):876-880.
[7]钟凯,王艳玲,邹思湘,等.乳头管灌注内毒素诱发大鼠实验性乳腺炎模型的建立[J].农业生物技术学报,2005,13(5):109-113.
[8]张书起,于洪川.大鼠试验性乳房炎病理模型[J].农业科学研究,2006,27(4):27-31.
[9]杨明锋,陈创夫,王正荣,等.金黄色葡萄球菌感染小鼠乳房炎模型的建立[J].中国兽医学报,2011,31(1):107-109+114.
[10]Sanchez-Valdez F J,Perez BC,Ramirez G,et al.Amonoallelic deletion of the TcCRT gene increases the attenuation of a cultured Trypanosoma cruzi strain,protecting against an in vivo virulent challenge[J].PLoSNegl Trop Dis,2014,8(2):e2696.
[12]Wei Y Y,Hu T J,Su Z J,et al.Immunomodulatory and antioxidant effects of carboxymethylpachymaran on the mice infected with PCV2[J].Int JBiol Macromol,2012,50(3):713-719.
