牛源麦氏弧菌的分离鉴定及进化分析
2015-03-18方志超罗梓桐刀丽梅单文杰范财良程方俊
方志超 ,罗梓桐,黄 攀,刀丽梅,单文杰,林 雅,范财良,程方俊
(1.西南大学荣昌校区动物医学系,重庆 荣昌402460 ;2.重庆市荣昌县畜牧局,重庆荣昌 402460)
麦氏弧菌(Vibrio metschnikovii)又称梅氏弧菌,是广泛存在自然界的致病性弧菌,也是国内外公认的致病性弧菌。主要存在于海水,河水,水产品和食品中。近年来,已从水源,牛粪便、鸡肝、苍蝇中分离出该菌[1-2]。V.metschnikovii可引起人类伤口感染、食物中毒、腹泻和败血症,是公共卫生学上重要的病原微生物。姜淑红等[3-5]人都曾报道过麦氏弧菌引起人腹泻,沈强[6]报道,从食物中检测出麦氏弧菌,并引起人的食物中毒。Hansen[7]等人报道麦氏弧菌导致败血症,呼吸道感染,伤口感染。在动物方面,朴范泽[8]报道雏鸡感染V.metschnikovii后出现突然发病、腹泻以及严重肠炎,死亡率高。杨瑛等[9]发现,V.metschnikovii与猪链球菌2 型具有较强的协同致病作用,可引起猪的死亡。
16SrRNA基因普遍存在于原核生物中,不同细菌具有非常相似的保守区又具有其特异性可变区。16SrRNA长约1 500 bp,便于测序和序列分析,因而它非常适合对细菌进行鉴定和系统进化关系研究,已经被越来越多的学者接受[10]。本试验通过传统细菌学鉴定和16SrRNA序列分析方法鉴定从牛上呼吸道分离出的3 株细菌,同时进行系统进化分析,了解其进化关系。动物致病性试验、药物敏感性筛选为今后进一步研究该菌致病情况、耐药性以及指导临床用药提供理论依据。
1 材料与方法
1.1 样品来源 用无菌棉签采集重庆、四川某牛场肉牛的鼻腔黏液,放入已灭菌的LB营养肉汤中,4 ℃保存,备用。
1.2 试验动物 健康家兔,20 日龄健康小鼠。
1.3 主要试剂和材料 实验室常规用品由西南大学荣昌校区预防兽医教研室提供;微量生化管,购自杭州天和微生物试剂有限公司;细菌基因组提取试剂盒、PCR 产物凝胶回收试剂盒,均购自广州飞扬生物技术公司;Mix DL-2 000 Marker、6×Loading Buffer、PCR 试剂盒Premix ExTaq、无菌双蒸水,均购自宝生物工程(大连)有限公司;药敏纸片,购自杭州天和微生物试剂有限公司。
1.4 引物 参考细菌16SrRNA通用引物(正向:5′-AGAGTTTGATCCTGGCTCAG-3′;反向:5′-GGT TACCTTGTTACGACTT-3′),由上海百力格有限公司合成。
1.5 病原分离 将样品接种到鲜血琼脂培养基,置于37 ℃恒温箱培养24 h,取单个菌落进一步纯化,经纯化的单个菌落保存于鲜血琼脂斜面,4 ℃保存备用。
1.6 培养特性及形态学观察 将分离菌株接种于TCBS培养基,置于37 ℃恒温箱培养24 h,观察细菌的生长情况及菌落特征。挑取培养基上单个菌落涂片,进行革兰染色,然后镜检。
1.7 生化试验 将分离菌株分别进行糖发酵试验(葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖)、吲哚试验、V-P 试验、M.R.试验、硫化氢试验、枸橼酸盐利用试验、氧化酶试验、硝酸盐试验,置于37 ℃恒温箱培养24 h~48 h,观察并记录结果。
1.8 16SrRNA基因的扩增及测序 反应条件:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min 经30 个循环;最后72 ℃延伸10 min。
PCR 产物在1%琼脂糖凝胶电泳,结果照相保存。PCR 产物按照PCR 产物凝胶回收试剂盒说明书进行胶回收,回收产物由上海生工生物工程技术服务有限公司进行测序。
1.9 同源性分析和系统进化分析 将分离菌株的16SrRNA基因序列通过NCBI 的Blast 检索系统进行同源性分析,并使用DNAStar 软件与从Gen-Bank 数据库中获得的16SrRNA基因序列构建系统进化树。
1.10 药敏试验 药敏试验按照CLSI(Clinical and Laboratory Standards Institute)推荐的K-B法进行,判定标准参照美国实验标准委员会(NCCLS)药敏纸片扩散法规标准。
1.11 致病性试验 将该分离菌株DF309-1 于马丁肉汤中静置培养18 h,0.2 mL(8.7×108CFU/mL)剂量小鼠腹腔注射。并设立对照组,观察并记录小鼠的生理状况。
2 结果
2.1 培养特性及形态学观察 分离出3 株细菌分别命名为FD39-1、ZC3、ZC4。分离菌株在鲜血培养基中呈圆形、光滑、凸起的中等菌落,具有β-溶血现象。在TCBS培养基中呈黄色菌落,经革兰染色为革兰阴性弯曲杆菌。3 株分离菌株的生化特征见表1。

表1 分离菌株生化特征
2.2 16SrRNA基因的扩增 经16SrRNA基因扩增,扩得的凝胶电泳片段与目的片段大小一致(如图1)。
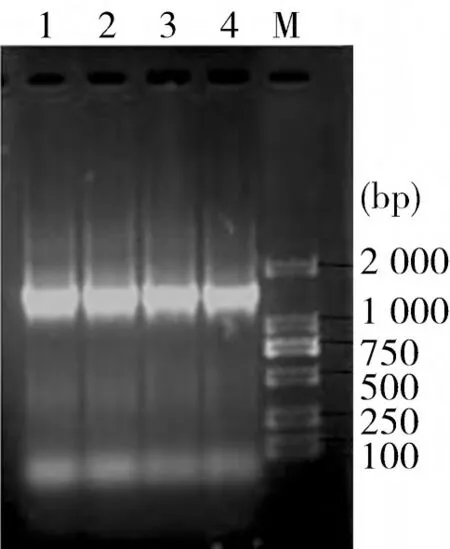
图1 分离菌株的扩增结果
2.3 同源性分析与进化树构建 将3 株分离菌的16SrRNA序列分别通过Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)在线比较,菌株FD39-1 与9株V.metschnikovii的相似性最高,为99%;菌株ZC3、ZC4 与18 株V.metschnikovii的相似性最高,为95%~96%。
选取GenBank 上登录的V.metschnikovii 的16SrRNA序列,利用DNAStar 软件分析,与3 株分离菌株进行系统进化树构建(如图2);ZC3 与ZC4 位于同一分支,与印度分离株HQ658055.1、山东青岛分离株JX409930.1 进化关系较近,但与FD39-1 进化关系较远,虽然都属于V.metschnikovii,但不是同一个进化分支。菌株FD39-1 与韩国分离株KC634073.1(Vibrio sp.M12-1144)进化关系较近。
2.4 药敏试验结果 见表2。
2.5 致病性试验结果 接种FD39-1 菌株的小鼠主要表现为精神委顿,竖毛,活动减少,食欲下降,腹泻,24 h 全部死亡,剖检小鼠可见肠绒毛脱落,肠壁化脓性炎症。取肠内容物均分离出该菌。对照组精神状况良好,饲养1 周无死亡。
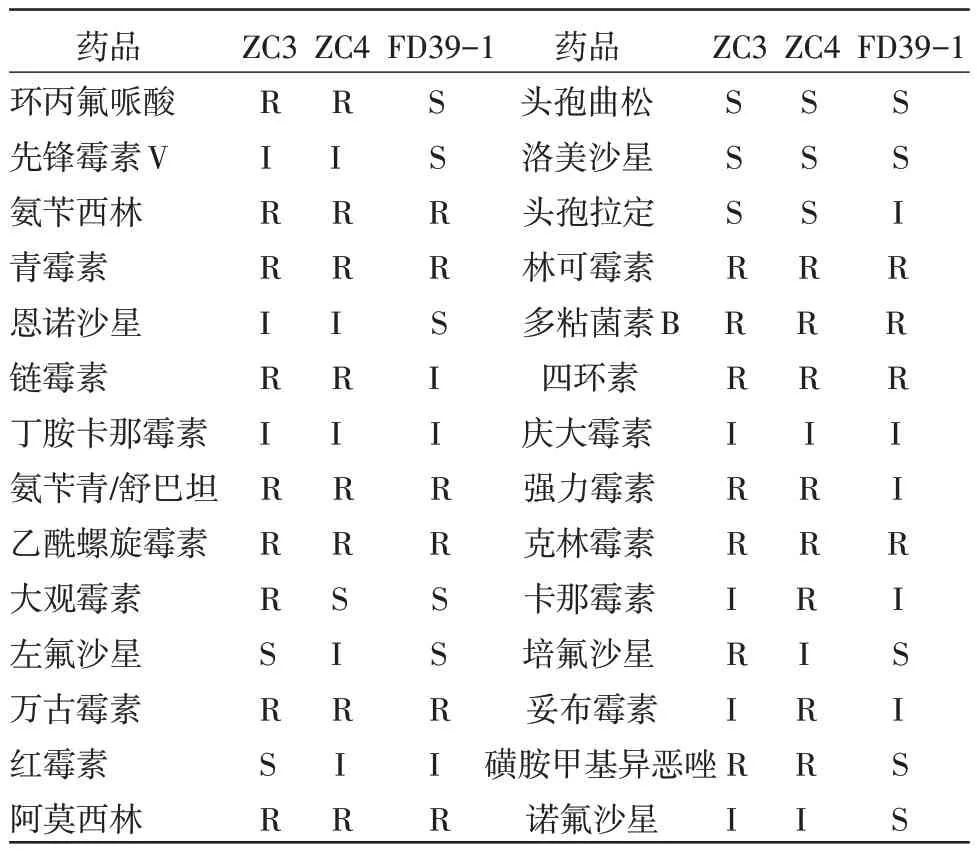
表2 药敏试验结果
3 讨论
本试验从肉牛上呼吸道分离到的3 株细菌在鲜血平板具有β-溶血现象,在TCBS培养基长出黄色菌落,各项生化结果均与已报道的V.metschnikovii生化特性一致[1,11];分子鉴定采用16SrRNA基因鉴定方法,结果显示,3 株分离菌株FD39-1、ZC3、ZC4 的16SrRNA序列与V.metschnikovii的16SrRNA序列同源性分别为99.6%、95.9%、96.4%。结合培养形态特征和生化特征,可鉴定3株分离菌株为V.metschnikovii。利用DANStar 构建进化树,显示ZC3与ZC4进化关系很近,与FD39-1 的进化关系较远,不在同一个进化分支,这是由于ZC3、ZC4 菌株来源于四川某牛场,而FD39-1 菌株来源于重庆某肉牛场,不同地区V.metschnikovii的进化有所差异。ZC3 与ZC4 同印度分离株HQ658055.1、山东青岛分离株JX409930.1 进化关系较近,属于同一族。菌株FD39-1与韩国分离株KC634073.1 进化关系较近,位于第二族。
刘利芝[11]等人对V.metschnikovii耐药状况研究发现,对丁胺卡那霉素、羟氨苄青霉素和克拉维酸、氨苄西林和舒巴坦、先锋V、头孢替坦、庆大霉素、四环素敏感;对氨苄青霉素、先锋必、头孢噻肟、复达欣、环丙沙星、妥布霉素耐药;对哌拉西林中度敏感。李正义等[12]研究发现,V.metschnikovii对青霉素有耐药性,对氨舒钠和头孢唑啉中度敏感,对头孢替坦、头孢他定、头孢曲松、阿米卡星、妥布霉素、环丙沙星、左氧氟沙星和磺胺甲恶唑/甲氧苄啶敏感。本试验药敏试验结果显示,菌株ZC3、ZC4 仅对头孢曲松、洛美沙星、头孢拉定敏感,环丙氟哌酸、青霉素等大多数药物耐药,耐药性较为严重;菌株FD39-1 对先锋霉素V、头孢曲松、洛美沙星、红霉素敏感,对青霉素、林克霉素耐药,这与李正义、王钦升报道一致。分析认为菌株ZC3、ZC4 来源于四川散养户,可能由于抗生素滥用导致细菌耐药性较为严重,FD39-1 来源于重庆某集约化牛场,管理规范,用药合理,因此没有严重的耐药性。
本试验中,采用小鼠进行致病性试验,孙延釜[2]、张晓玫[4]、刘利芝[11]等人在研究V.metschnikovii毒力试验中均采用小鼠作为试验动物,致病性试验中,接种FD39-1 菌株的小鼠先后发病,主要表现为精神委顿,竖毛,活动减少,饮食下降,腹泻,24 h 全部死亡,这与孙延釜[3]、刘利芝[11]等人的致病性试验结果一致,说明菌株FD39-1 有很强的致病力。
麦氏弧菌(V.metschnikovii)主要存在于水产品以及食物中,是一种致病性弧菌,易引起食物中毒。本试验采用传统细菌学鉴定方法和16SrRNA序列分析方法首次从肉牛上呼吸道分离并鉴定出3 株V.metschnikovii,证实V.metschnikovii存在于肉牛上呼吸道,可能肉牛上呼吸道潜在性病原,并可能成为食源性病原菌来源之一。因此对于V.metschnikovii的研究,不仅进一步研究V.metschnikovii成为肉牛上呼吸道感染潜在性病原奠定基础,在食品安全,公共卫生方面也有重要意义。
[1]王钦升,马红英,沈瑛.13 株麦氏弧菌的生物学特性和鉴定[J].上海医学检验杂志,1997,12(3):141-142.
[2]孙延釜,汪昌平,孙天梅.32 株麦氏弧菌生物学特性及毒素原性的检测[J].中国卫生检验杂志,2003,13(3):338.
[3]姜淑红,周振相,王志娜.一株由梅氏弧菌引起食物中毒的报告[J].现代预防医学,2001,28(2):168.
[4]张晓玫,王忠.腹泻患者呕吐物中麦氏弧菌的分离及其生物学性状观察[J].蚌埠医学院学报,2012,37(12):1530-1532.
[5]沈艳云,李建国,王栋,等.麦氏弧菌引起食物中毒的病原学分析[J].江苏预防医学,1999,10(4):42-43.
[6]沈强,任德生,瞿明芳,等.食物中毒样品中检出麦氏弧菌[J].江苏预防兽医,2000,4(10):5.
[7]Hansen W,Freney J,et al.Severe Human Infections Caused by Vibrio metschnikovii[J].JClin Microbiol,1993 Sep;31(9):2529-30.
[8]朴范泽,崔玉东,李英莹,等.鸡梅氏弧菌的鉴定[J].中国畜禽传染病学,1992,5:19-20.
[9]杨瑛,张宗军,孙伟,等.猪链球菌2 型与麦氏弧菌的分离鉴定及动物致病性试验[J].畜牧与兽医,2001,6(33):5-7.
[10]William G W,Susan MB,Dale A,et al.16SRibosomal DNAamplification for phylogeneticstudy[J].JBacteriol,1991,173(2):697-703.
[11]刘利芝,王芳.麦氏弧菌的鉴定及毒力和耐药状况研究[J].实用预防医学,2000,7(3):234-235.
[12]李正义,贾俊涛,曹际娟.一株分离自美国的麦氏弧菌的鉴定及其低温状态下细胞脂肪酸的变化[J].微生物学报,2013,53(6):628-634.
