犬瘟热病毒疫苗株与野毒株H 蛋白球状头部域的免疫原性比较研究
2015-03-18秦晓冰王怡男张传美张洪亮胡琳琳
秦晓冰 ,王怡男,张传美,黄 娟,张洪亮,王 聪,胡琳琳,单 虎
(1.青岛农业大学动物科技学院 山东省预防兽医学重点实验室,山东 青岛 266109;2.山东省安丘市畜牧局,山东 安丘 262100)
犬瘟热(Canine Distemper,CD)是由犬瘟热病毒(Canine Distemper Virus,CDV)感染引起的犬科、鼬科和其他食肉目动物的急性或亚急性、高度接触致死性传染病,对当前养犬业、特种经济动物养殖业和野生动物保护业危害巨大。血凝素(H)蛋白是CDV囊膜表面糖蛋白纤突,与病毒吸附、融合并侵入宿主细胞直接相关[1]。H 蛋白是CDV诱导机体产生中和抗体的主要抗原。H 蛋白的中和抗原表位编码的多肽可刺激机体产生中和抗体,中和CDV的传染性。但在犬瘟热病毒感染宿主过程中,不同毒株H 蛋白主要抗原表位区球状头部域(Head Domain)的中和抗原表位变化是否会对毒株间抗原演变或体液免疫机制产生影响尚不清楚。为此,本研究构建了疫苗株和野毒株Head Domain 基因的原核表达载体,并在表达宿主菌中成功表达,为进一步研究H 蛋白中和抗原表位及其体液免疫机制提供依据。
1 材料与方法
1.1 主要材料 疫苗株CDV3、Asia-Ⅰ型野毒株组织毒LYM、Vero 细胞和pET-30a 质粒均由本实验室保存;E.coliDH5a、BL21(DE3),均购自宝生物工程(大连)有限公司;6 周龄昆明系小鼠,购自青岛派特福德小鼠养殖专业合作社。
1.2 主要试剂 TRIZol LS®Reagent RNA提取试剂盒,购自Invitrogen 公司;ExTaq/PrimeSTAR HSDNA聚合酶、限制性内切酶,均购自宝生物工程(大连)有限公司;兔抗His 标签单克隆抗体,购自北京普利来基因技术有限公司。
1.3 引物设计与合成 根据CDV-H基因扩增方法,合成1 对引物(F1、R1),并设计2 对原核表达引物(CDV3-F2、R2/LYM-F3、R3),5′端引入酶切位点和保护性碱基,预期片段大小分别为1 921 bp 和1 143 bp(见表1)。
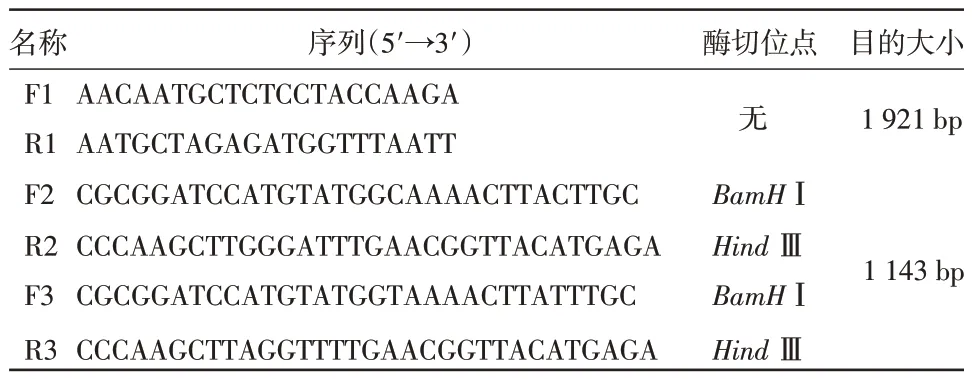
表1 引物序列
1.5 H 基因RT-PCR-RFLP 分析 分别以CDV3和LYMRNA为模板,RT-PCR 扩增得到H 全 基因,经回收纯化,由本实验室建立NdeⅠ-RFLP 方法进行鉴定。
1.6 H基因克隆和鉴定 将PCR纯化产物与pMD18-T 连接转化至E.coliDH5a。提质粒,经PCR 和BamHⅠ/HindⅢ酶切鉴定,阳性质粒分别命名为pMD18-T-H1 和pMD18-T-H2,送公司测序。
1.7 Head Domain 基因扩增及原核表达质粒构建以pMD18-T-H1 和pMD18-T-H2 为模板,PCR得到Head Domain 基因。目的片段和pET-30a 质粒均BamHⅠ/HindⅢ酶切后,连接转化至E.coliDH5a。摇菌提重组表达质粒鉴定正确后,命名为pET-30a-VCHD和pET-30a-LYHD,送公司测序。
1.8 诱导表达及其条件优化 将pET-30a-VCHD、pET-30a-LYHD和pET-30a,按常规方法转化至BL21(DE3)诱导表达,并对表达条件优化做SDS-PAGE。
1.9 表达产物Western blot 分析 SDS-PAGE 后转印到PVDF 膜,以兔抗His 标签单克隆抗体(1∶1 000)为一抗,以羊抗兔IgG-HRP(1∶2 000)为二抗,进行Western blot。
1.10 表达产物纯化 重组菌诱导表达后,经His.tag 蛋白纯化试剂盒纯化,做SDS-PAGE 分析。
1.11 间接ELISA分析 CDV3/LYM试验组和生理盐水对照组分别取12 只6 周龄昆明系小鼠,皮下注射纯化蛋白(50 μg/只),加强免疫两次,每次间隔2 周,自初免后每周对小鼠眼眶采血。将纯化蛋白(5 μg/mL)包被,待检血清1∶80 稀释,测量OD值。
1.12 细胞中和试验 采集血清灭活后,倍比稀释至1∶256,分别与100 TCID50的CDV3 细胞毒混合,于37 ℃孵育1 h 后加入Vero 细胞,逐日观察结果。
我校近几年分层走班教学活动搞得如火如荼。在这个过程中,我们特别重视以小组为主体,对学生进行人格培养,营造“创新教学”课堂教学形式,营造高效课堂。具体步骤是:以小组合作学习为平台,教师和学生,学生和学生可以相互提问,相互补充,相互激励,相互评价,达到培养思维品质,培养学生个性的目的。那么,作为语文教师,如何借助Blackboard平台,通过小组合作学习,打造这种高效课堂呢?经过一年多的实践,初显成效,具体做法如下:
2 结果
2.1 H 基因扩增及RFLP RT-PCR 产物电泳可见1 921 bp 左右特异性条带。RFLP 发现,LYM电泳可见约1 282 bp、345 bp 和294 bp 3 条特异性条带,而CDV3 只有1 条特异性条带(图1)。
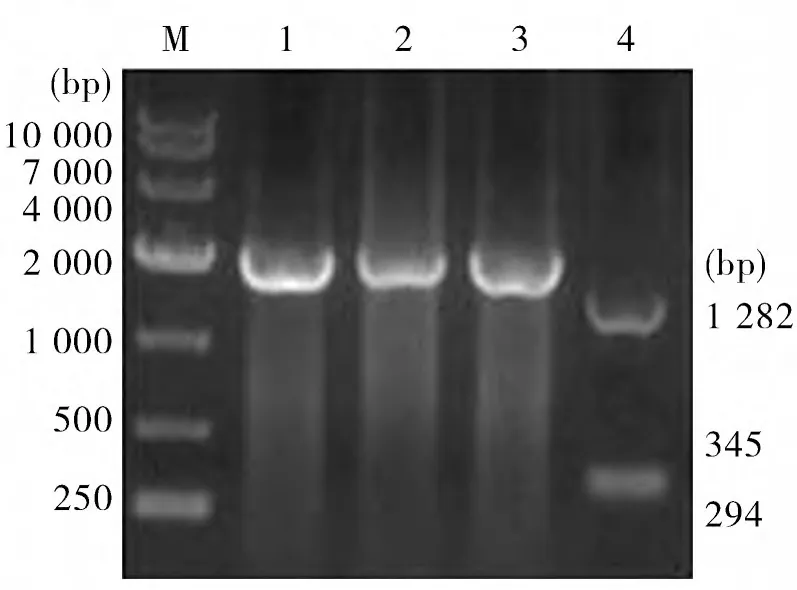
图1 H 基因扩增及R FLP
2.2 克隆质粒鉴定 重组克隆质粒pMD18-TH1、pMD18-T-H2 经BamHⅠ/HindⅢ酶切,得到片段大小分别为2 690 bp 和1 921 bp,与预期大小相同(图2)。测序结果表明,H 基因序列正确。
2.3 Head Domain 基因扩增 以pMD18-T-H1、pMD18-T-H2 为模板,PCR 扩增Head Domain 基因,电泳可见1 143 bp 特异性条带(图3)。
2.4 原核表达载体构建与鉴定 质粒pET-30a-VCHD、pET-30a-LYHD经BamHⅠ/HindⅢ酶切,得到片段分别为5 422 bp 和1 143 bp,与预期大小相符(图4)。表明目的基因均已插入相应克隆位点;测序结果表明,插入片段具有正确阅读框。
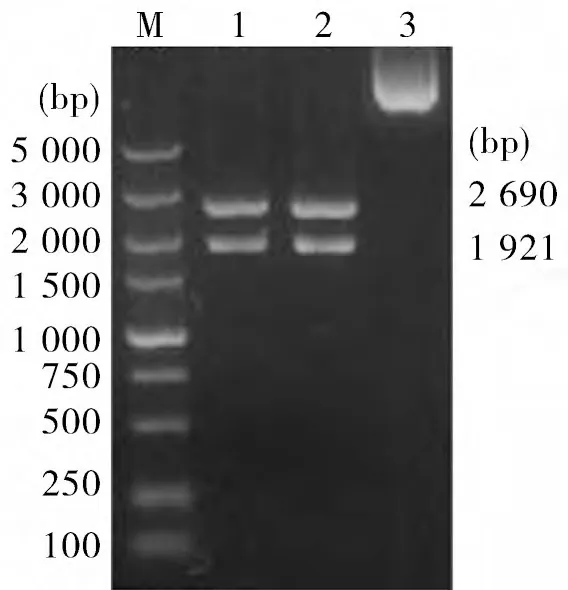
图2 pMD18-T-H 双酶切
图3 H ead Domain基因PCR
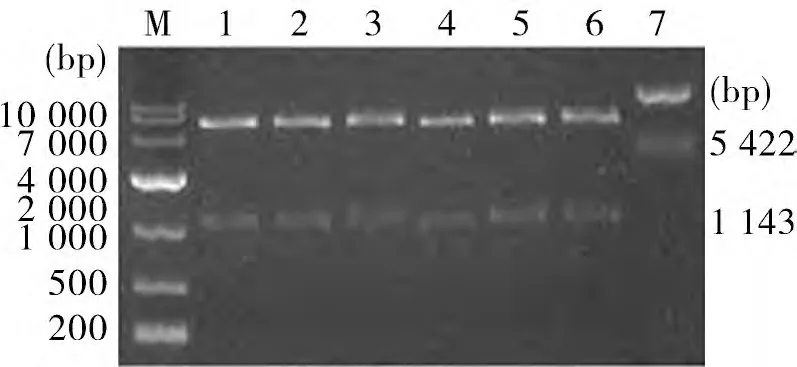
图4 pET-30a-VCH D、pET-30a-LY H D酶切鉴定
2.5 Head Domain-His 诱导表达 结果显示,重组菌在28 ℃、IPTG 为0.8 mmol/L、诱导6 h 时表达目的蛋白量最大。细菌裂解后在50.8 ku 处出现目的蛋白条带,而未诱导重组菌和诱导空载体无此条带(图5)。
2.6 Western Blot 分析 结果显示,CDV3-Head Domain 和LYM-Head Domain 重组蛋白相对分子质量约50.8 ku,与预期大小相符(图6)。表明两个蛋白均与兔抗His 标签单克隆抗体结合良好。
2.7 蛋白纯化蛋 白纯化后获得较纯的重组蛋白(图7)。
2.8 间接ELISA结果 结果显示,免疫次数越多,重组蛋白刺激小鼠产生抗体效价越高,且试验组差异不显著(P>0.05);而对照组抗体效价很低,试验组与对照组差异极显著(P<0.01)(图8)。说明重组蛋白均能激发机体产生特异性抗体,具有一定免疫原性。

图5 大肠埃希菌中诱导表达目的蛋白

图6 H ead Domain Western blot分析

图7 重组蛋白纯化
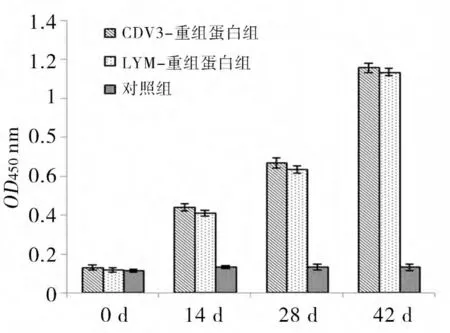
图8 间接ELISA结果(OD450值)
2.9 中和试验结果 结果显示,对照组免疫后小鼠体内均未检测到CDV中和抗体。而试验组在初免后中和抗体效价最高仅达到1∶4(图9 未显示),但二免后,两者抗体滴度均显著升高,在第21 天达到1∶16;随后三免,抗体滴度均再次升高,在第35 天达到1∶32,且试验组差异不显著(P>0.05)(图9)。表明两种重组蛋白都有抗病毒活性,且两者中和效价没有明显差异。
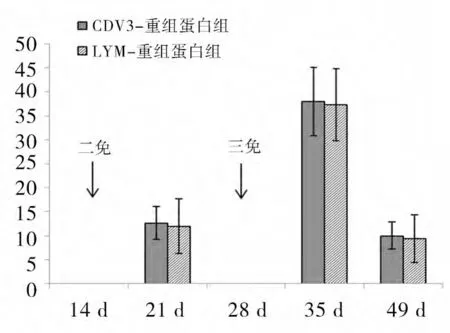
图9 中和试验结果
3 讨论
犬瘟热病毒H蛋白是Ⅱ型糖蛋白,包括N-末端胞质尾区、跨膜区和C-末端胞外结构域[2]。胞外结构域由α螺旋形成的茎部及其支持的受体结合位点、蛋白抗原区域的球状头部组成[3]。Onderstepoort 株球状头部域氨基酸序列为228~604 aa[4]。
H 蛋白是犬瘟热病毒最易变异的蛋白,常用来评估CDV毒株间遗传演变。CDV野毒株H 基因有一个或两个NdeⅠ酶切位点,而疫苗株H 基因中没有,可用来区分疫苗株和野毒株。有研究表明,CDV疫苗株与野毒株的部分氨基酸序列存在较低同源性(89.7%~91.8%),推测CD的免疫失败可能与两者遗传关系较远有关[5]。但也有研究表明,犬瘟热野毒株和疫苗株H、N 基因DNA疫苗对受到野毒株攻击水貂可产生相同保护力,推测两者抗原差异不会引起免疫失败[6]。疫苗株和野毒株Head Domain 变化是否对毒株间抗原演变或体液免疫产生影响尚不清楚。为此,本研究用原核表达系统,获得重组蛋白为Head Domain 研究提供基础。
本研究对重组蛋白免疫原性进行了鉴定。Western Blot 结果显示,Head Domain-His 蛋白与兔抗His 标签单抗特异性结合良好。ELISA结果显示,随着免疫次数增加,重组蛋白刺激小鼠产生抗体效价越高,表明重组蛋白具有一定免疫原性,且需多次免疫才能达到较高抗体水平。中和试验结果表明,CDV3 和LYM的重组蛋白中和抗体效价没有明显差异,提示野毒株与疫苗株Head Domain 蛋白抗原差异可能不会影响免疫原性改变,但这一推测仍需本体动物试验进行深入验证。
[1]Von Messling V,Zimmer G,Herrler G,et al.The hemagglutinin of canine distemper virus determines tropism and cytopathogenicity[J].JVirol,2001,75(14):6418-6427.
[2]李天松.不同宿主来源犬瘟热病毒遗传分析与生物学特性研究[D].吉林:吉林农业大学,2012.
[3]Katharine N,Bossart,Christopher C,Broder.Paramyxovirus Entry[J].Adv Exp Med Biol,2013,790:95-127.
[4]K Singethan,E Topfstedt,SSchubert,et al.CD9-dependent regulation of Canine distemper virus-induced cell-cell fusion segregates with the extracellular domain of the haemagglutinin[J].Journal of General Virology,2006,87:1635-1642.
[5]王君玮,姜平,王志亮,等.貂、狐、貉源犬瘟热病毒分离株H和N 基因的遗传多样性分析[J].南京:南京农业大学学报,2007,04:108-113.
[6]Line Nielsen,Trine Hammer Jensen,Birte Kristensen,et al.DNAvaccines encoding proteins from wild-type and attenuated canine distemper virus protect equally well against wild-type virus challenge[J].Arch Virol,2012,157:1887-1896.
