白藜芦醇通过促进自噬减轻糖尿病大鼠心肌缺血再灌注损伤的实验研究
2015-03-12沈佳佳黄瑛祁炜罡谈晶花张代富
沈佳佳 黄瑛 祁炜罡 谈晶花 张代富
(上海市浦东新区人民医院心内科,上海 201200)
白藜芦醇通过促进自噬减轻糖尿病大鼠心肌缺血再灌注损伤的实验研究
沈佳佳△黄瑛△祁炜罡谈晶花张代富
(上海市浦东新区人民医院心内科,上海201200)
摘要目的:探讨白藜芦醇减轻糖尿病大鼠心肌缺血再灌注损伤的保护机制及其对心肌细胞自噬的影响。方法:用链脲佐菌素(Streptozotocin,STZ)诱导建立糖尿病大鼠模型,选取35只糖尿病造模成功大鼠,随机分为假手术组、白藜芦醇未手术组、缺血再灌注损伤模型组、白藜芦醇治疗组、白藜芦醇+胰岛素联合治疗组,每组各7只。通过结扎-放松左冠状动脉制备缺血再灌注损伤模型。通过亚甲蓝染色观察心肌梗死面积变化;在透射电镜下观察自噬泡;采用蛋白质印迹(Western blotting)法检测微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)Ⅰ和Ⅱ、自噬相关基因5(autophagy related gene 5,Atg5)、Beclin-1的表达水平及腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)和雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的表达及磷酸化水平。结果:白藜芦醇治疗组与白藜芦醇+胰岛素联合治疗组心肌梗死面积显著小于缺血再灌注损伤模型组(P<0.05)。电镜结果显示,白藜芦醇治疗与白藜芦醇+胰岛素联合治疗可促进糖尿病大鼠缺血再灌注损伤心肌细胞的自噬,改善心肌细胞结构。缺血再灌注损伤模型组大鼠心肌细胞中LC3-Ⅱ、Atg5、Beclin-1表达水平较假手术组显著降低(P<0.05),而LC3-Ⅰ表达水平差异无统计学意义(P>0.05);白藜芦醇治疗组及白藜芦醇+胰岛素联合治疗组Atg5、Beclin-1表达水平均显著高于缺血再灌注损伤模型组,且白藜芦醇+胰岛素联合治疗组Beclin-1表达水平高于白藜芦醇治疗组(P<0.05);各组之间mTOR、AMPK表达水平差异无统计学意义(P>0.05),但白藜芦醇治疗组及白藜芦醇+胰岛素联合治疗组AMPK磷酸化水平显著高于缺血再灌注损伤模型组,而mTOR磷酸化水平则显著低于缺血再灌注损伤模型组(P<0.05)。结论:白藜芦醇可能通过激活AMPK、抑制mTOR通路,上调LC3-Ⅱ、Atg5、Beclin-1的表达,促进自噬,抑制缺血再灌注损伤,减少心肌梗死面积,从而保护糖尿病大鼠心肌细胞。
关键词白藜芦醇;糖尿病模型;缺血再灌注损伤模型;自噬;大鼠
糖尿病是心血管疾病的独立危险因子,超过50%的糖尿病患者死于血管并发症[1]。目前,关于强化血糖控制对糖尿病大血管并发症的影响,各研究[2-4]结果不一,这是因为糖尿病合并血管病变极具复杂性,与高血糖、高血压、高血脂、血液高凝状态、炎性反应等多种因素均有关,所以单纯控制血糖并不能从根本上降低血管事件的发生率。
白藜芦醇是一种非黄酮类的酚类物质,天然的白藜芦醇在很多植物中存在,这是植物为了抵御病菌入侵而产生的一种抗毒素。流行病学研究[5]发现,法国人常食牛排、奶酪等高胆固醇食品,但是其心血管病发病率仅为美国人的1/3,这归因于美法两国饮食习惯不同,法国人葡萄酒摄入量高。葡萄酒中所含大量的白藜芦醇可能对心血管病具有保护作用。白藜芦醇有抗癌、抗心血管疾病、抗糖尿病等作用。最近研究[6-7]发现,小剂量白藜芦醇能调节自噬,增强细胞存活信号,帮助细胞在损伤中复原,从而保护心肌。本研究旨在明确白藜芦醇对糖尿病大鼠缺血再灌注损伤(ischemia-reperfusion injury,I/R)的保护机制及其对心肌细胞自噬的影响,并探讨其内在机制,以期为临床研究提供依据。
1资料与方法
1.1实验动物及糖尿病模型的制备选取6~8周龄、体质量160~200 g的雄性SD大鼠45只(购自上海斯莱克实验动物有限公司),饲养在(26±2)℃空调房内,湿度60%~80%,2~3 d换1次垫料,分笼饲养,给予符合上海市卫生标准的饮用水,适应性饲养1周。实验前1 d禁食、不禁水,禁食时间不少于14 h。实验当天,将链脲佐菌素(Streptozotocin,STZ;美国Sigma公司)用0.1 mol/L、pH 4.2 的柠檬酸钠缓冲液在冰浴中溶解,根据大鼠的体质量单次腹腔注射STZ溶液65 mg/kg。全部大鼠注射STZ溶液后,继续禁食1 h,然后喂饲料,保持饮水充足。给药后10 d内,动物逐渐消瘦,状态变差,精神萎靡,皮毛耸立,出现多饮、多食、多尿等1型糖尿病的表现,空腹血糖值>16.7 mmol/L。10 d后造模成功,造模成功率超过80%。
1.2实验动物分组及处理选取35只糖尿病造模成功大鼠,每日监测血糖。将这35只大鼠随机分为5组,每组7只,分别为假手术组(sham组,不给药,模拟手术状态,但不结扎冠状动脉)、白藜芦醇未手术组[Resveratrol组,白藜芦醇(购自上海恒远生物技术公司)2.5 mg/(kg·d),饲养10 d,模拟手术状态,但不结扎冠状动脉]、缺血再灌注损伤模型组(I/R组,不给药,手术结扎冠状动脉30 min,再灌注120 min)、白藜芦醇治疗组[I/R+Resveratrol组,白藜芦醇2.5 mg/(kg·d),饲养10 d,手术结扎冠状动脉]、白藜芦醇+胰岛素联合治疗组[I/RI+Resveratrol组,白藜芦醇2.5 mg/(kg·d),饲养10 d,皮下注射胰岛素4 U/d,手术结扎冠状动脉30 min,再灌注120 min]。白藜芦醇的给药方法为:溶于0.9%氯化钠液后灌胃。手术结扎冠状动脉30 min后,取心肌组织、切片,用0.9%氯化钠液冲洗干净后在0.3%亚甲蓝染液中浸泡20 min,再用0.9%氯化钠液冲洗。染色后正常组织呈蓝色,梗死部位呈白色。用图形分析软件计算梗死面积。应用透射电镜观察各组梗死区、非梗死区、梗死边缘区的自噬泡。具体参考文献[8]。
1.3蛋白质印迹(Western blotting)法检测自噬相关蛋白的表达与腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的表达及其磷酸化水平各组取等量总蛋白行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,湿转(电流400 mA,2 h)至聚偏氟乙烯膜,将膜浸入封闭液[在Tris-盐酸缓冲液(TBST)中加入脱脂奶粉,至最终的质量体积浓度为5%],室温下振荡1 h。加入稀释好的一抗抗体[微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3, LC3)-Ⅰ与LC3-Ⅱ抗体,均为1∶1000,购自德国Merck Millipore公司;自噬相关基因5(autophagy related gene 5, Atg5)抗体,1∶1000,购自英国Abcam公司;Beclin抗体,1∶1000,购自英国Abcam公司;AMPK、mTOR及其磷酸化抗体稀释度均为1∶1000,购自美国Santa Cruz公司], 4 ℃过夜。TBST洗膜3次(每次5 min)。加入稀释好的二抗抗体(1∶5000),室温1 h振荡孵育。在电化学发光分析仪上进行电化学发光,于暗室压X光底片曝光,显影、定影,水洗胶片并晾干后保存。
1.4统计学处理采用SPSS 19.0软件进行统计学分析,组间比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
2结果
2.1白藜芦醇对糖尿病大鼠心肌梗死面积的影响相对于I/R组,I/R+Resveratrol组与I/RI+Resveratrol组大鼠的心肌梗死面积均缩小(P<0.05),见图1。
2.2白藜芦醇对糖尿病大鼠I/R中自噬泡的影响透射电镜下观察发现,sham组与Resveratrol组心肌细胞核膜完整,核质分布均匀,染色较淡,呈细粒分散状,胞浆内线粒体和内质网等细胞器结构完整,线粒体嵴清楚,存在少量自噬泡。而I/R组心肌细胞收缩,染色质缩合成块状,有的线粒体轻度肿胀、部分空泡化,无自噬泡存在;I/R+Resveratrol组心肌细胞结构较I/R组得到改善,核质内部分细胞器结构少量修复,可见少量自噬泡存在;I/RI+Resveratrol组心肌细胞结构较I/R组改善明显,线粒体等细胞器膜结构清晰,亦可见少量自噬泡存在。见图2。
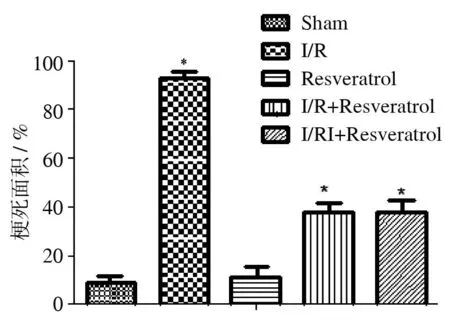
与I/R组比较,*P<0.05
图1各组大鼠心肌梗死面积的比较
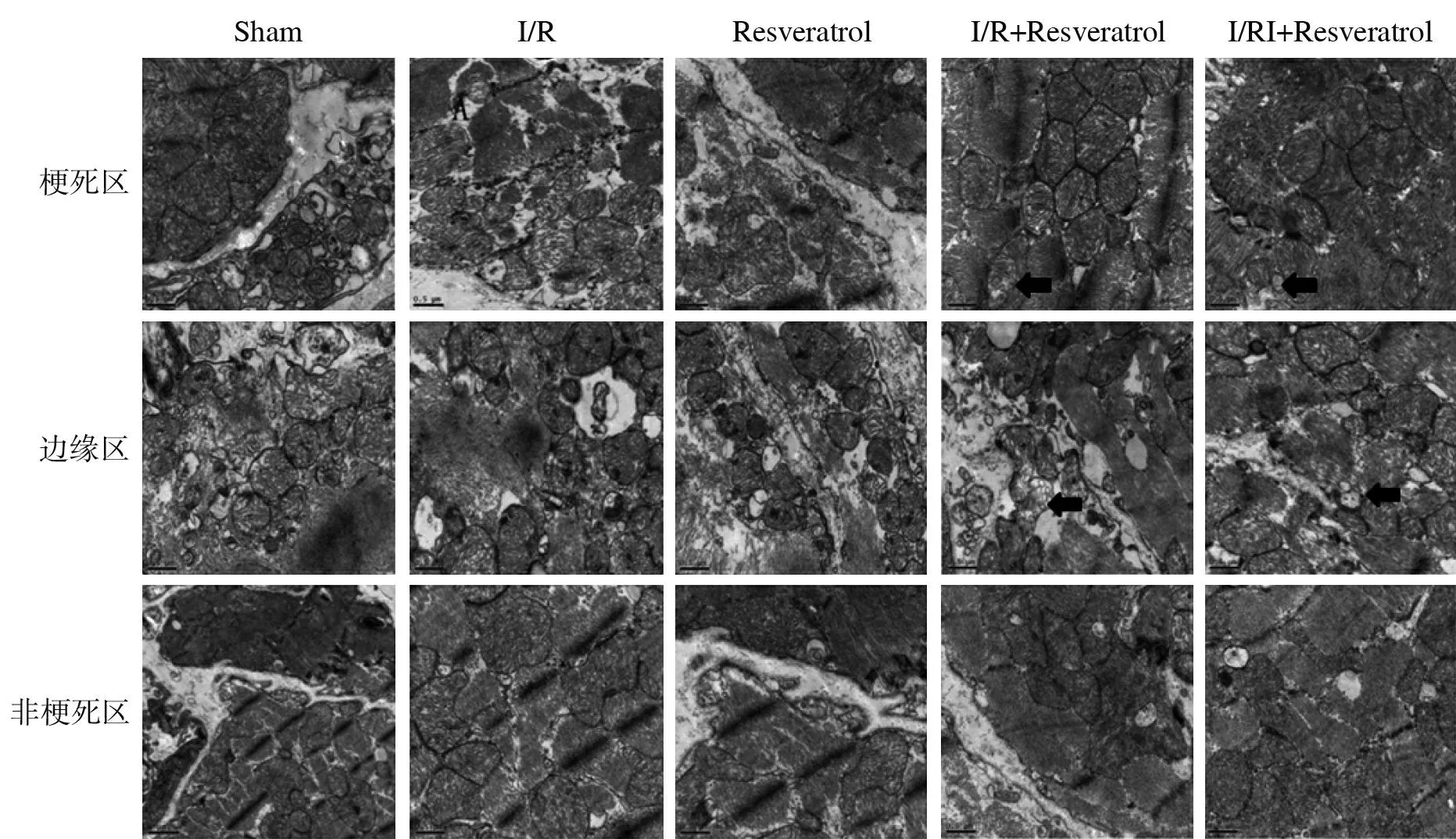
图2 透射电镜下观察心肌细胞的自噬泡 (标尺=0.5 μm;箭头指示为自噬泡)
2.3白藜芦醇对糖尿病大鼠I/R中自噬相关蛋白的表达以及mTOR、AMPK的表达和磷酸化的影响与Sham组比较,I/R组大鼠心肌细胞中LC3-Ⅱ、Atg5、Beclin-1表达水平明显降低(P<0.05),LC3-Ⅰ的表达水平差异无统计学意义(P>0.05);I/R+Resveratrol组及I/RI+Resveratrol组Atg5、Beclin-1表达水平显著高于I/R组,且I/RI+Resveratrol组Beclin-1表达水平高于I/R+Resveratrol组。此外,各组间mTOR、AMPK表达水平差异无统计学意义(P>0.05),I/R+Resveratrol组及I/RI+Resveratrol组p-AMPK表达水平显著高于I/R组,而p-mTOR表达水平则显著低于I/R组。见图3。
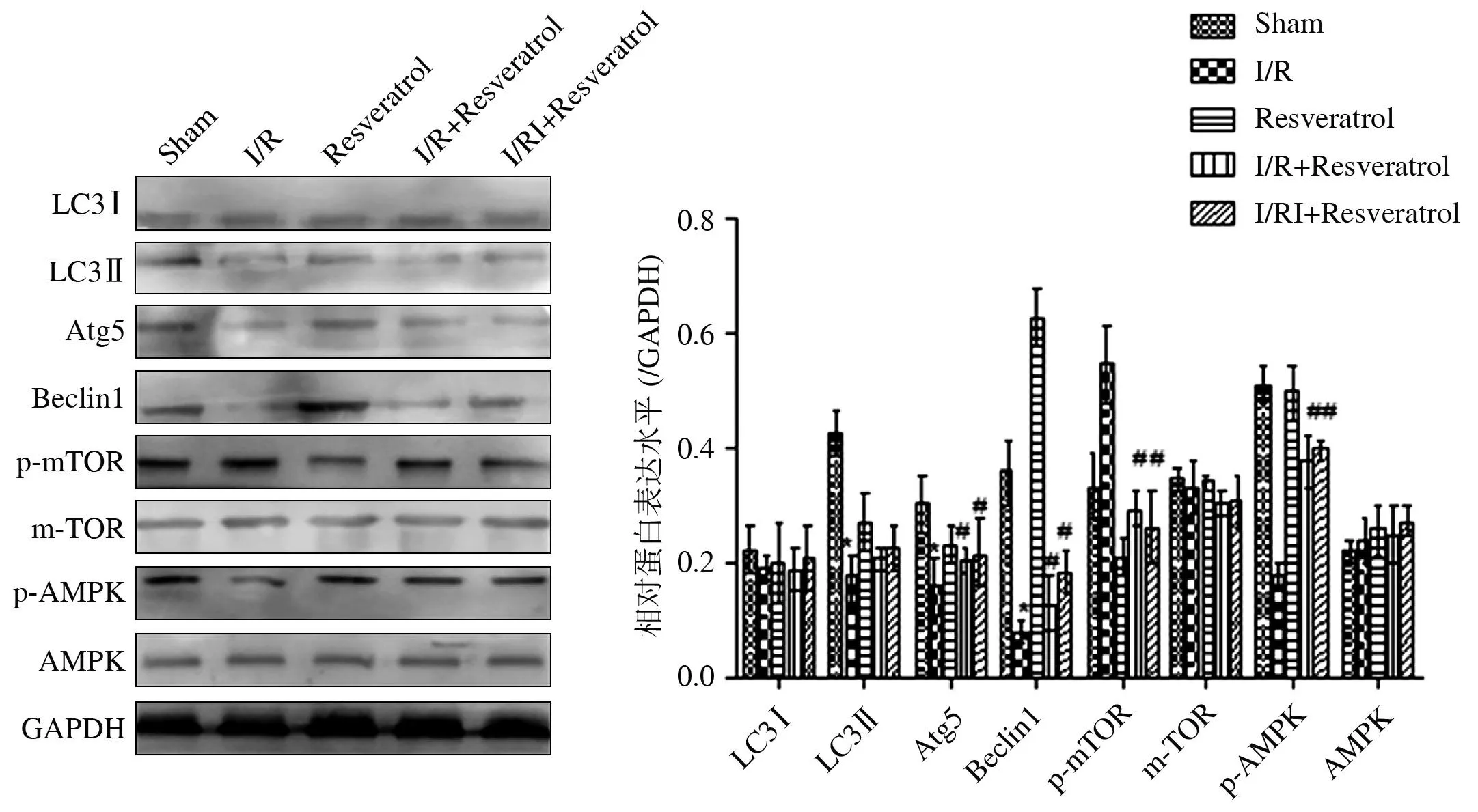
与Sham组比较,*P<0.05;与I/R组比较,#P<0.05
图3各组大鼠心肌组织中自噬相关蛋白的表达及AMPK、mTOR的表达及其磷酸化水平的检测
[内参照为甘油醛-3-磷酸脱氢酶(GAPDH)]
3讨论
自噬是指细胞通过单层或双层膜包裹细胞质中的大分子物质(比如蛋白质、RNA、糖原等)和一些细胞的内源性底物(包括由于生理或病理原因引起的衰老、破损的细胞器)而形成自噬体,再转运到溶酶体形成自噬溶酶体进而被降解利用的过程。在应激、营养缺乏、低氧状态下,自噬降解的分子和细胞器可为细胞内提供能量和合成蛋白质的氨基酸,是营养缺乏状态下的一种保护机制。近期研究[6-7]发现,白藜芦醇能调节自噬,增强细胞存活信号,帮助细胞在损伤中复原,从而保护心肌。本研究结果显示,I/R+Resveratrol组及I/RI+Resveratrol组心肌梗死面积都较I/R组显著减小。电镜结果也显示,I/R+Resveratrol组及I/RI+Resveratrol组心肌细胞结构较I/R组改善,核质内部分细胞器结构得到修复,2组心肌细胞内均可见少量自噬泡。这表明,白藜芦醇能上调自噬,减轻糖尿病大鼠I/R,减少心肌梗死面积,保护心肌。
自噬的启动依赖于一系列自噬相关基因(Atg)的参与,目前发现的Atg有30余种[9]。自噬诱发后,Atg5可促使自噬体膜的形成和延长,形成自噬体结构[10]。在自噬的整个过程中,自噬体的形成是关键。Beclin 1是一个关键的自噬调控分子,能与VPS34形成复合物,引发自噬相关蛋白在两大泛素系统中的募集并结合于前自噬结构(pre-autophagosomal structure,PAS)膜上,促使PAS膜呈“C”型延伸,包裹待降解的细胞质或细胞器等,形成自噬体结构[11]。另外,LC3能与Atg一起,促进自噬体成熟。本研究发现,I/R+Resveratrol组及I/RI+Resveratrol组的Atg5、Beclin-1含量均显著高于I/R组;白藜芦醇治疗能增加糖尿病大鼠IR时的Atg5、Beclin-1含量,促进自噬体形成、上调自噬。此外,白藜芦醇和胰岛素联合治疗较单用白藜芦醇能进一步上调Beclin-1的表达。
AMPK是一种Ser/Thr蛋白激酶,为异源三聚体蛋白,由1个催化亚基α和2个调节亚基β、γ组成,是能量代谢和自噬、凋亡调控中的重要分子[12]。当细胞内ATP水平较低时,AMP和ADP直接结合γ亚基,构象改变,使AMPK磷酸化[13-14]。本研究发现,I/R+Resveratrol组及I/RI+Resveratrol组p-AMPK表达水平显著高于I/R组,而p-mTOR表达水平则显著降低;这表明,在I/R时,白藜芦醇可活化糖尿病大鼠的AMPK通路、抑制mTOR通路。这与国外其他研究[15-17]结果一致。
综上所述,白藜芦醇可能通过激活AMPK通路和抑制mTOR通路,上调LC3-Ⅱ、Atg5、Beclin-1的表达,促进自噬,从而减轻糖尿病大鼠I/R。然而,其内在调控机制仍有待进一步探究。
参考文献
[1]Bowden DW,Cox AJ,Freedman BI,et al.Review of the Diabetes Heart Study(DHS) family of studies:a comprehensively examined sample for genetic and epidemiological studies of type 2 diabetes and its complications[J].Rev Diabet Stud,2010,7(3):188-201.
[2]Stratton IM,Cull CA,Adler AI,et al.Additive effects of glycaemia and blood pressure exposure on risk of complications in type 2 diabetes:a prospective observational study(UKPDS 75)[J].Diabetologia,2006,49(8):1761-1769.
[3]Nathan DM,Cleary PA,Backlund JY,et al.Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes[J].N Engl J Med,2005,353(25):2643-2653.
[4]ADVANCE Collaborative Group,Patel A,MacMahon S,et al.Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes[J].N Engl J Med,2008,358(24):2560-2572.
[5]Renaud S,Lorgeril M.Wine,alcohol,platelets and the French paradox for coronary heart disease[J].Lancet,1992,339(8808):1523-1526.
[6]Gurusamy N,Ray D,Lekli I,et al.Red wine antioxidant resveratrol-modified cardiac stem cells regenerate infarcted myocardium[J].J Cell Molr Med,2010,14(9):2235-2239.
[7]Lekli I, Ray D, Mukherjee S, et al. Co-ordinated autophagy with resveratrol and γ-tocotrienol confers synergetic cardioprotection[J].J Cell Mol Med,2010,14(10):2506-2518.
[8]Suzuki C,Isaka Y,Takabatake Y,et al.Participation of autophagy in renal ischemia/reperfusion injury[J].Biochem Biophys Res Commun,2008,368(1):100-106.
[9]Mizushima N.The role of the Atg1/ULK1 complex in autophagy regulation[J].Curr Opin Cell Biol,2010,22(2):132-139.
[10]Reggiori F,Klionsky DJ.Autophagy in the eukaryotic cell[J].Eukaryot Cell,2002, 1(1):11-21.
[11]Funderburk SF,Wang QJ,Yue Z.The Beclin 1-VPS34 complex—at the crossroads of autophagy and beyond[J].Trends Cell Bid,2010,20(6):355-362.
[12]Hardie DG,Ross FA,Hawley SA.AMPK:a nutrient and energy sensor that maintains energy homeostasis[J].Nat Rev MoI Cell Bio,2012,13(4):251-262.
[13]Xiao B,Sanders MJ,Underwood E,et al.Structure of mammalian AMPK and its regulation by ADP[J].Nature,2011,472(7342):230-233.
[14]Mihaylova MM,Shaw RJ.The AMPK signaling pathway coordinates cell growth,autophagy and metabolism[J].Nat Cell Biol,2011,13(9):1016-1023.
[15]Gwinn DM,Shackelford DB,Egan DF,et al.AMPK phosphorylation of raptor mediates a metabolic checkpoint[J].Mol Cell,2008,30(2):214-226.
[16]Lee CW,Wong LL,Tse EY,et al.AMPK promotes p53 acetylation via phosphorylation and inactivation of SIRT1 in liver cancer cells[J].Cancer Res,2012,72(17):4394-4404.
[17]Mihaylova MM,Shaw RJ.The AMPK signalling pathway coordinates cell growth, autophagy and metabolism[J].Nat Cell Biol,2011,13(9):1016-1023.
Resveratrol Reduces Cardiac Ischemia-Reperfusion Injury of Diabetic Rats by Promoting Autophagy in Experimental Study
SHENJiajia△HUANGYing△QIWeigangTANJinghuaZHANGDaifu
DepartmentofCardiology,ShanghaiPudongNewAreaPeople’sHospital,Shanghai201200,China
AbstractObjective: To investigate the protective mechanism of resveratrol in reducing cardiac ischemia-reperfusion injury (I/R) of diabetic rats and its effect on autophagy of cardiomyocytes.Methods: Streptozotocin(STZ)-induced diabetic rat model was constructed and 35 diabetic model rats were randomly divided into five groups, the sham group, the resveratrol non-surgery group, the I/R group, the resveratrol treatment group, and the resveratrol+insulin group, with 7 rats in each. Then I/R model was built by ligating-relaxing the left coronary. The change of myocardial infarction size was observed by methylene blue staining. Autophagic vacuoles were observed with transmission electron microscope(TEM). The expression of microtubule-associated protein 1 light chain 3(LC3)-Ⅰ and Ⅱ, autophagy related gene 5(Atg5), Beclin-1, as well as the expression and phosphorylation levels of AMP-activated protein kinase(AMPK) and mammalian target of rapamycin(mTOR), were detected by Western blotting.Results: The infarction size in resveratrol treatment group and resveratrol+insulin group was significantly smaller than that in I/R group(P<0.05).TEM showed that in resveratrol treatment group and resveratrol+insulin group, autophagy of cardiomyocytes could be promoted and the structure of cardiomyocytes could be improved, when I/R of occurred. The expression levels of LC3-Ⅱ,Atg5,Beclin-1 in I/R group were significantly lower than those in sham group(P<0.05),whereas the change of expression levels of LC3-Ⅰ had no significant difference(P>0.05). Meanwhile, the expression levels of Atg5 and Beclin-1 in resveratrol treatment group and resveratrol+insulin group were significantly higher than those in I/R group, and the expression level of Beclin-1 in resveratrol+insulin group was higher than that in resveratrol treatment group(P<0.05). There was no significant difference in the expression level of AMPK and mTOR among the 5 groups(P>0.05). However, the expression level of p-AMPK was significantly higher in resveratrol treatment group and resveratrol+insulin group than that in I/R group, and the expression level of p-mTOR was significantly lower in resveratrol treatment group and resveratrol+insulin group than that in I/R group (P<0.05).Conclusions: Resveratrol may protect cardiomyocytes of diabetic rats by activating AMPK pathway, inhibiting mTOR pathway, increasing the expression of LC3-Ⅱ,Atg5 and Beclin-1, promoting autophagy, suppressing I/R, and reducing infarction size.
Key WordsResveratrol;Diabetic model;Ischemia-reperfusion injury model;Autophagy;Rats
中图分类号R587.1
文献标识码A
通讯作者张代富,E-mail:zdf@medmail.com.cn
基本项目:上海市卫生局青年科研项目(编号:20124Y200)
△沈佳佳和黄瑛对本文有同等贡献,为共同第一作者
·论著·
