Notch1在胆管癌细胞光动力疗法中的作用研究
2015-03-08邓小峰苗雄鹰
苏 进,邓小峰,熊 力,文 宇,苗雄鹰
(中南大学湘雅二医院, 肝胆外科, 湖南 长沙 410011)
Notch1在胆管癌细胞光动力疗法中的作用研究
苏进,邓小峰,熊力,文宇,苗雄鹰*
(中南大学湘雅二医院, 肝胆外科, 湖南 长沙 410011)
摘要:目的:1、研究Photosan介导光动力疗法(Photodynamic Therapy,PDT)对胆管癌细胞的杀伤作用。2、探讨Notch1在胆管癌发生中的表达情况以及Notch1在PDT治疗胆管癌细胞中的作用。方法:1、体外培养人胆管癌QBC939细胞株,在细胞对数生长期用不同浓度Photosan处理,并用半导体激光治疗仪不同强度光照后,采用MTT法检测PDT对QBC939细胞的杀伤作用。观察不同的光敏剂孵育时间、光敏剂浓度及光照剂量对PDT效果的影响。2、采用免疫细胞化学方法和蛋白印迹法检测胆管癌细胞Notch1表达,经Photosan介导光动力作用胆管癌细胞后,检测胆管癌细胞内Notch1表达变化。结果:1、MTT结果显示Photosan介导的PDT对胆管癌细胞有杀伤作用(P<0.05),而且这种杀伤作用在一定范围内随着光敏剂浓度增加、光敏剂孵育时间、光照剂量呈正相关。2、免疫细胞学检查发现Notch1在胆管癌细胞中高表达,其表达主要位于细胞膜及胞浆,并且经PDT处理后Notch1表达量较前减少(P<0.05)。结论: Notch1与胆管癌细胞生长、增殖密切相关,且Notch1在PDT对胆管癌细胞产生的抑制、促凋亡和杀伤作用中有重要作用。
关键词:光动力疗法;胆管癌;Notch1信号
流行病学调查发现,在世界范围内胆管癌的发病率及死亡率均有上升趋势,中国是胆管癌的发病大国, 约占全球胆管癌的55%[1, 2]。胆管癌的治疗手段很多,手术切除仍为首选治疗,但早期胆管癌缺乏明显临床症状,在诊断后使得超过50%患者失去手术切除机会,非切除胆管癌患者的生存期一般<1年[3]。光动力疗法(photodynamic therapy, PDT)目前被认为是肿瘤姑息性治疗手段之一,PDT具有高选择性、操作简单、可重复性、副作用少、治疗效果佳等优点,不仅能够提高不可切除胆管癌患者生存期,同时能改善患者的生活质量。PDT主要通过产生活性氧来诱导肿瘤凋亡,体外试验及裸鼠胆管癌模型上均得到了证实,但具体的分子机制仍有待更深一步研究[4, 5]。最近越来越多的研究发现Notch信号通路在决定胆管癌生物学特性上有着重要意义,Notch信号过表达能促进胆管癌细胞增殖、迁移、上皮细胞间质化(EMT)、肿瘤血管形成及抗肿瘤药免疫等,并与胆管癌的分化程度相关[6]。本研究旨在探讨Notch信号在光动力治疗胆管癌中的作用及 PDT的可能分子机制,为基于Notch信号通路的光动力治疗提供依据。
1材料和方法
1.1材料
QBC939购自中南大学湘雅医学院细胞中心,光敏剂Photosan购自德国(Seehof Labiratorium F&E GmbH Wesselburenerkoog), MTT(Sigma-Aldrich公司,美国),Hochest 33258(谷歌公司,武汉),兔抗鼠Notch1多克隆抗体(Abcam公司,美国),半导体激光光动力仪(深圳雷迈公司),光纤(深圳雷迈公司),超净台(苏州净化设备有限公司),恒温CO2细胞培养箱(Thermo公司,美国),酶联免疫检测仪(Thermo公司,美国),倒置显微镜(奥林巴斯,日本),激光扫描共聚焦显微镜Leica TCS SP5(Leica/徕卡,德国),荧光显微镜(奥林巴斯公司,日本)。
1.2方法
1.2.1细胞培养及MTT试验
胆管癌细胞株QBC939贴壁生长于DMEM完全培养液(含10%胎牛血清,青霉素100 U/mL,链霉素100 mg/L),于37 ℃、5%CO2饱和湿度恒温箱中培养,约48 h传代一次,取对数生长期细胞,胰酶消化后离心制悬,计数板计数,浓度约为4×104/mL,接种于96孔板中,每组设4个平行孔,置于温箱中孵育24 h后弃培养液,分别加入浓度为0 mg/L、1 mg/L、2 mg/L、4 mg/L、8 mg/L、16 mg/L的Photosan,孵育时间分别设为0 h、1 h、2 h、4 h、8 h,光照前弃上清液,PBS清洗3次后加入含10%胎牛血清的完全培养液,调整半导体激光仪光照剂量分别为 0 J/cm2、5 J/cm2、10 J/cm2、15 J/cm2进行照射,波长为630 nm,温箱中孵育24 h后进行MTT试验,酶联免疫检测仪检测吸光度(波长为570 nm),测定各孔OD值,空白对照组进行调零,观察PDT对QBC939的杀伤、抑制作用,并计算各组的细胞存活率=(实验组OD值/对照组OD值)×100%。以上试验重复3次,全程在避光下进行。
1.2.2细胞免疫荧光测定Notch1在QBC939中的表达
取对数生长期的QBC939细胞种植于置有盖玻片的6孔板中,温箱中培养24 h后制成细胞爬片,4%多聚甲醛固定并用破膜工作液处理,依次加入兔抗鼠Notch1多克隆抗体(稀释比1∶100)、山羊抗兔Hochest二抗,DAPI染核,抗荧光淬灭封片剂封片,荧光显微镜拍照分析,激光共聚焦显微镜对Notch1表达分布进行亚定位,PBS代替一抗作为阴性对照。爬片成功后经PDT处理,同法进行细胞免疫荧光标记。结果判定标准:以细胞中出现红色为阳性,其中细胞核染色且符合评分标准的定性为细胞核阳性。通过观察各视野中细胞染色强度,以文献中报道的阳性病例作为阳性对照。其中,根据荧光强弱分为:强阳性(+++),阳性(++),弱阳性(+),表达阴性为(-)。
1.2.3Western-Blot测定PDT处理后QBC939中Notch1蛋白表达
于PDT处理后提取QBC939细胞中Notch1总蛋白,将其加入SDS聚丙烯凝胶电泳进行分离,然后转入PVDF膜,用封闭液按1∶200的比例稀释兔抗鼠Notch1多克隆抗体或抗β-actin抗体,膜与一抗孵育4 ℃过夜,封闭液按1∶500比例稀释二抗,室温摇床2 h,然后放入NBT/ BCIP中显色,扫描,阳性条带用Quantity One 4.4.1软件分析。
1.3统计学分析
2结果
2.1PDT对QBC939细胞存活率的影响
PDT处理后通过光学显微镜观察细胞形态学改变,QBC939细胞生长抑制明显,细胞形态发生明显皱缩,细胞核固缩,折光性下降,部分出现包膜皱缩、胞质浓缩、核固缩、染色质边集、核裂解和凋亡小体形成,表现为坏死、凋亡改变。不同Photosan浓度、光敏剂孵育时间及光照剂量对QBC939存活率的影响见图1-图3,随机选定其中两个参数,得出另外一个参数的最佳值,最终当光照剂量为10 J/cm2、光敏剂浓度为8 mg/L、光敏剂孵育时间为4 h时,PDT对细胞的杀伤效果最佳(P<0.05),抑制率达到72.72%,继续增加光敏剂浓度、光照剂量及光敏剂孵育时间PDT所致细胞存活率的下降不明显,差异无统计学意义。并且实验过程中未见明显光毒性及光敏剂毒性(P>0.05)。因此,Photosan介导PDT治疗QBC939安全有效,且当Photosan浓度8 mg/L、光敏剂孵育时间4 h及光照剂量10 J/cm2时治疗效果最佳。
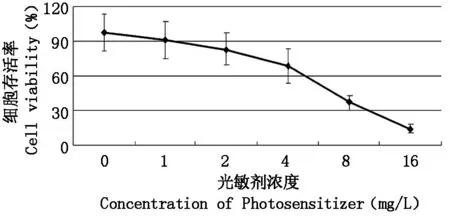
图1 选定光敏剂孵育时间为4 h、光照剂量为10 J/cm2时,不同光敏剂浓度对细胞存活率的影响Fig.1 The impacts of Photosan concentrations on cell viability of PDT, when light dose was 10 J/cm2 and incubate time was 4 h

图2 选定光敏剂浓度为8 mg/L、光敏剂孵育时间为4 h时,不同光照剂量对细胞存活率的影响Fig.2 The impacts of light dose on cell viability of PDT, when Photosan concentration was 8 mg/L and incubate time was 4 h
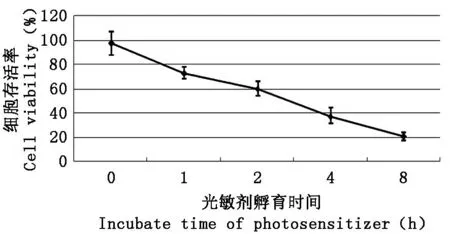
图3 选定光敏剂浓度为8 mg/L、光照剂量为10 J/cm2时,不同光敏剂孵育时间对细胞存活率的影响Fig.3 The impacts of incubation times on cell viability of PDT, when Photosan concentration was 8 mg/L and light dose was 10 J/cm2
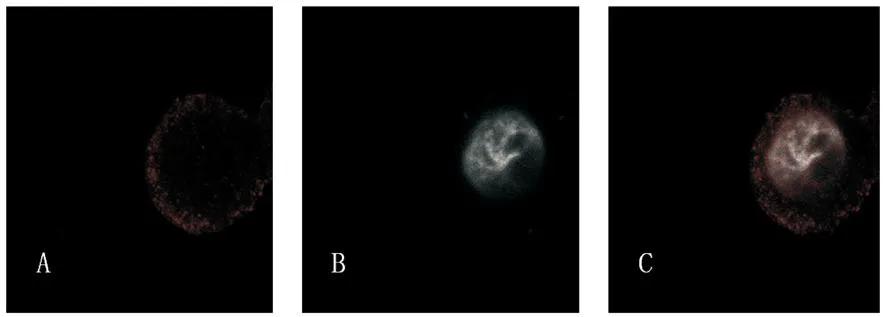
图4 激光共聚焦显微镜检测Notch1的表达(×400)A:Notch1,主要表达于细胞膜和细胞质中;B:DAPI染核;C:A和B合并Fig.4 The expression of Notch1, detected by laser scanning confocal microscope(×400)A: Notch1, mainly expressed in cytomembrane and cytoplasm; B: Nucleus; C: A and B Merged
2.2免疫荧光检测PDT对QBC939 Notch1表达的影响
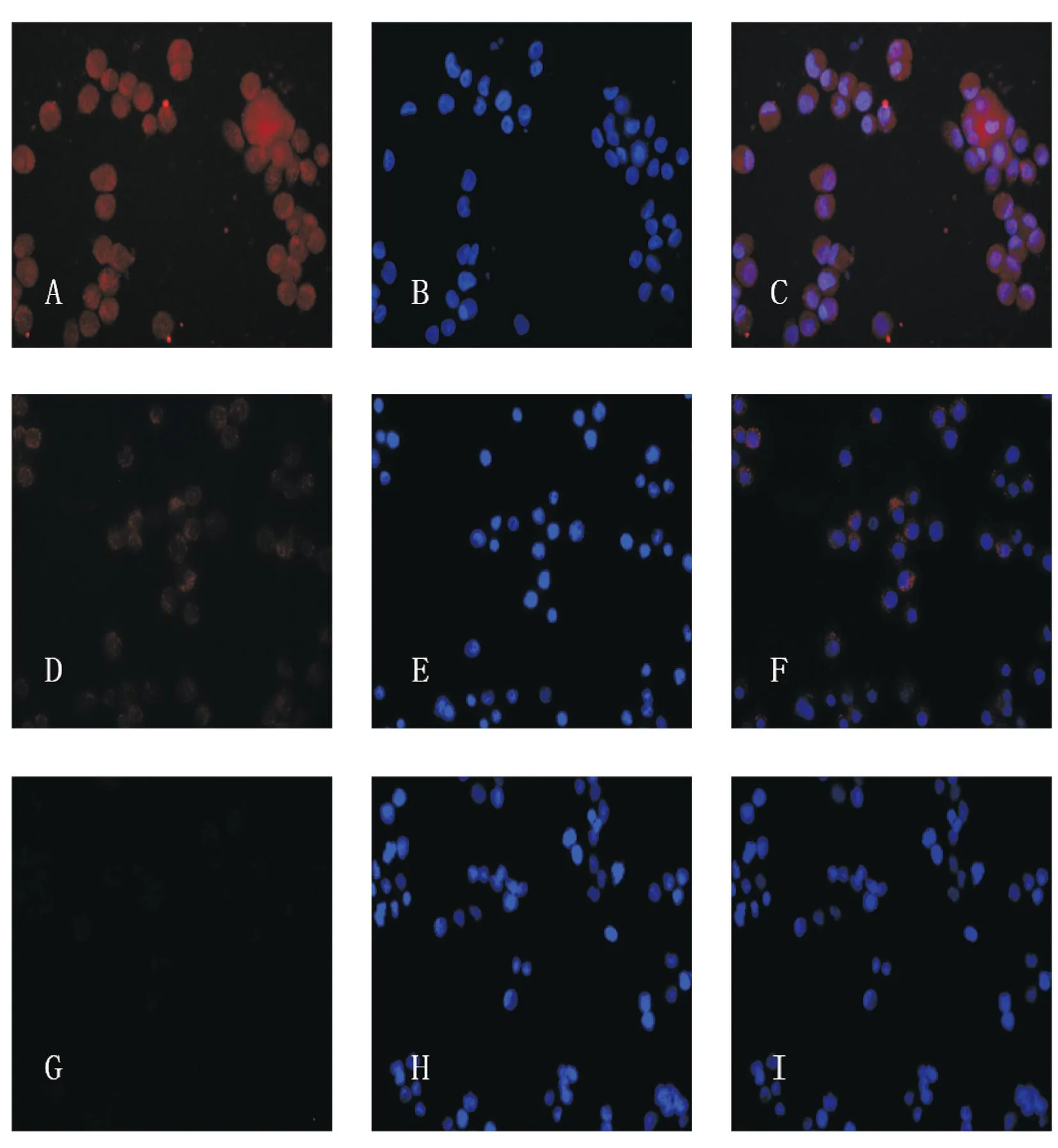
图5 Notch1在QBC939中呈强阳性表达(×200)A:Notch1蛋白;B:DAPI染核;C:A和B合并;D:PDT处理后Notch1蛋白表达,E:DAPI染核,F:D和E合并;G、H、I为阴性对照Fig.5 Notch1 was overexpressed in QBC939, detected by fluorescence microscope (×200)A:Notch1; B:Nucleus; C:A and B merged; D:The expression of Notch1 after PDT; E:Nucleus; F:D and E merged; G, H and I was negative control
免疫荧光检测发现Notch1蛋白在 QBC939中强阳性表达(图5),在激光共聚焦显微镜下可以看出Notch1蛋白主要表达于细胞膜及细胞质中(图4)。设定参数为光敏剂浓度16 mg/L、光照剂量为10 J/cm2时,经PDT处理后48 h行免疫荧光发现Notch1的荧光强度表达明显降低,呈弱阳性(图5)。
2.3Western Blot检测PDT处理后Notch1蛋白的表达
Western blot检测发现Notch1在QBC939细胞中均呈过表达状态,设定参数为光敏剂浓度1 mg/L、光照剂量5 J/cm2、光敏剂孵育时间4 h,PDT处理后孵育48 h后行凝胶电泳,测量Notch1蛋白灰度值为19.51± 2.25,与对照组比较表现出下降(P<0.05);当参数设定光敏剂浓度16 mg/L、光照剂量10 J/cm2、光敏剂孵育时间4 h时,PDT处理后,Notch1蛋白灰度值为14.55±2.01,与对照组比较有明显差异(P<0.05),A、B两组之间差异也有统计学意义(P<0.05)(图6)。
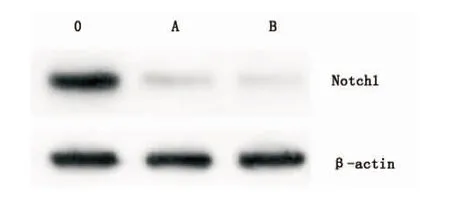
图6 PDT处理后Notch1的表达变化.0组为对照组(未经PDT处理)A、B组经PDT处理(A组为低剂量光照、低浓度光敏剂组;B组为高剂量光照、高浓度光敏剂组)Fig.5 The expression of Notch1 after PDT, detected by Western-Blot. Group O was blank control. Group A and B deal with PDT(group A treated with 1 mg/L Photosan at light dose 5 J/cm2,while B treated with 16 mg/L Photosan at light dose 10 J/cm2)
3讨论
光动力疗法(PDT)应用于胆管癌的治疗已有数十年,先后经历了体外细胞实验、动物模型实验及临床实验三个阶段,目前临床上主要用于不可切除胆管癌的姑息性治疗和术前新辅助治疗[7-8],也有个别报道称应用胆道良性肿瘤和癌前病变的治疗,如胆管乳头状瘤和重度非典型增生[9-10]。光动力疗法在胆管癌细胞中的杀伤作用得到了国内外学者的证实,姜海涛[11]等使用血卟啉衍生物(HPD)介导光动力疗法作用于胆管癌细胞,证实PDT在细胞实验中有显著的杀伤抑制作用,其抑制程度达到了80%。韩国学者Kim[12]等采用LED光源、光敏剂5-ALA对胆管癌细胞株HuCC-T1的杀伤作用研究,在无明显光敏剂毒性的范围内随着光敏剂孵育时间延长,PDT效应越好。Wagner[13]等研究发现不同胆管癌细胞株对PDT的敏感性变化较大,并认为造成这种结果的原因在于miRs的作用。深入研究PDT在肿瘤作用的机制及相关影响因素将对提高肿瘤治疗疗效提供指导。
PDT所致的肿瘤细胞凋亡主要通过诱导细胞内外凋亡通路实现。大量体内外实验证明[14-16]PDT通过上调caspase-3、caspase-7、caspase-9和caspase-12等凋亡蛋白的表达激活内外源性凋亡通路,最终诱导肿瘤细胞凋亡,其中以内源性占主导作用。最近有研究发现[6]Notch信号与胆管癌发生、发展、迁移和浸润等特征有密切关系,一定程度上决定了肿瘤干细胞的状态,在肿瘤的形成过程中发挥着原癌基因的特性。Zender等[17]发现Notch1信号胞内域(NICD)高表达诱导肝内胆管癌的形成,其下游靶基因HES-1在胆管癌多种细胞系中的高表达也得到证实。Notch1/2/3/4在肝外胆管癌中表达均有上调,其中Notch1的异常表达与肝外胆管癌的TNM分期相关,与肿瘤进展存在一定关系[18]。但也有学者发现[19-20]Notch1在肿瘤细胞中高表达伴随着P53基因的异常表达,认为Notch1的过表达和 P53的失活在促进肿瘤发生发展有协同作用。由此可见,Notch信号在胆管癌的发生中有重要作用,并有可能协同多种因素促进肿瘤发生发展。
本次实验中,我们首先通过MTT实验来验证PDT对胆管癌细胞的杀伤抑制作用。结果发现光动力疗法对QBC939细胞抑制作用明显(如图1-3),其抑制程度达72.72%,与完全空白对照组相比有明显差异(P<0.05),在一定范围内,这种作用随着PDT上述的三个参数强度的增加而增强,由此可以看出这三个参数在一定程度上能决定PDT的疗效,为光动力的后续研究发展提供了基础实践依据。然而在实验中我们发现,PDT并不能完全杀死胆管癌细胞,处理一段时间后QBC939得到重新生长,这也是PDT治疗后肿瘤复发的原因,在动物模型及人体临床应用中,肿瘤微环境变化更加微妙,而且受到光照渗透能力的限制,甚至光源导入途径的困难处境,因此,除了本实验中涉及的三个光动力参数以外,我们同时应当将目光定位于其他直接限制临床应用及影响临床疗效的因素上,如光敏剂的改进、光源的革新,以及多种治疗手段的联合应用等。
然后验证Notch1信号与PDT所致细胞凋亡的关系。通过免疫荧光我们发现Notch1蛋白在QBC939中明显高表达,说明了Notch1可能与肿瘤的发生、发展存在一定关系。通过共聚焦显微镜对Notch1表达进行亚定位发现其主要表达位于细胞膜及细胞质中,这充分符合Notch受体胞内合成、胞膜上组装并发挥生物学特征的特点。经过PDT处理后,Notch1的荧光强度较对照组明显下调,呈弱阳性状态,Western-blot检测Notch1蛋白表达明显降低(P<0.05),QBC939增殖明显受到抑制,并出现凋亡,说明了Notch1在胆管癌细胞中起促进增殖和抑制凋亡的作用。且PDT高参数组(B组)较低参数组(A组)相比,Notch1蛋白表达下降更加明显(P<0.05),说明了在一定范围内PDT的疗效与Notch1表达量负相关。由此可见,PDT可能通过引起QBC939细胞Notch1蛋白表达的减少来抑制细胞生长、诱导细胞凋亡甚至坏死,可能成为继激活经典凋亡通路后光动力诱发细胞凋亡的新的机制。然而,Notch信号通路的其他成员在PDT治疗中的作用如何仍需要更深入研究,光动力治疗过程中Notch信号通路与凋亡通路之间的关系如何仍然有待探讨和挖掘。因此,深入探索Notch信号通路与PDT的关系,在此基础上全面开展基于Notch信号的光动力治疗,可能成为肿瘤光动力治疗的新方向。
4结论
综上分析,体外实验中PDT对胆管癌细胞有明显的抑制和促凋亡作用,而这种作用可能和Notch信号通路表达异常有着密切关系。和细胞凋亡的两大经典途径不同的是,Notch通路较为简单,而且可以通过和VEGF信号相互影响和调节肿瘤血管形成[21],甚至是偶联多种信号通路影响肿瘤的生物学特性,目前已经有部分靶向Notch信号通路的要药物应用临床研究中,证实了其临床应用的实用性。因此,靶向Notch信号的光动力治疗、PDT与靶向Notch信号的联合治疗或者指导肿瘤干细胞的治疗等值得我们更进一步的研究和探索,为将来肿瘤的治疗提供一种新的思路和方法。
参考文献
[1]GATTO M, ALVARO D. New insights on cholangiocarcinoma [J]. World J Gastrointest Oncol, 2010, 2(3):136-145.
[2]黄志强. 肝胆管外科的发展方向 [J]. 外科理论与实践, 2011, 16(4):329-331.
HUANG Zhiqiang. Developing direction of hepatobiliary surgery [J]. Journal of Surgery Concepts & Practice, 2011, 16(4):329-331.
[3]HEZEL A F, ZHU A X. Systemic therapy for biliary tract cancers [J]. Oncologist, 2008, 13(4):415-423.
[4]MFOUO-TYNGA I, ABRAHAMSE H. Cell death pathways and phthalocyanine as an efficient agent for photodynamic cancer therapy [J]. Int J Mol Sci, 2015, 16(5):10228-10241.
[5]WANG X, HU J, WANG P,etal. Analysis of theinvivoandinvitroeffects of photodynamic therapy on breast cancer by using a sensitizer, sinoporphyrin sodium [J]. Theranostics, 2015. 5(7):772-786.
[6]WU W R, ZHANG R, SHI X D,etal. Notch1 is overexpressed in human intrahepatic cholangiocarcinoma and is associated with its proliferation, invasiveness and sensitivity to 5-fluorouracilinvitro[J]. Oncol Rep, 2014, 31(6):2515-2524.
[7]GRENDAR J, GRENDAROVA P, SINHA R,etal. Neoadjuvant therapy for downstaging of locally advanced hilar cholangiocarcinoma:a systematic review [J]. HPB (Oxford), 2014, 16(4):297-303.
[8]RICHTER J A, KAHALEH M. Photodynamic therapy:Palliation and endoscopic technique in cholangiocarcinoma [J]. World J Gastrointest Endosc, 2010, 2(11):357-361.
[9]BECHMANN L P, PHILIP HILGARD, ANDREA FRILLING,etal. Successful photodynamic therapy for biliary papillomatosis:a case report [J]. World J Gastroenterol, 2008, 14(26):4234-4237.
[10]ZHOU J J, XIONG L, LI Q L,etal. Photodynamic therapy for high-grade dysplasia of bile duct via a choledochoscope [J]. World J Gastroenterol, 2013, 19(33):5590-5592.
[11]姜海涛, 曹景玉, 韩瑞, 等. 光动力疗法促进胆管癌细胞QBC939的凋亡 [J]. 世界华人消化杂志, 2013, 21(39):1853-1858.
JIANG Haitao, CAO Jingyu, HAN Rui,etal. Photodynamic therapy promotes apoptosis of cholangiocarcinoma QBC939 cells [J]. World Chinese Journal of Digestology, 2013, 21(39):1853-1858.
[12]KIM C H, CHUNG C W,CHOI K H,etal. Effect of 5-aminolevulinic acid-based photodynamic therapy via reactive oxygen species in human cholangiocarcinoma cells [J]. Int J Nanomedicine, 2011, 6:1357-1363.
[13]WAGNER A, MAYR C. MicroRNAs associated with the efficacy of photodynamic therapy in biliary tract cancer cell lines [J]. Int J Mol Sci, 2014, 15(11):20134-20157.
[14]刘园园,王逸飞,张春敏,等. ALA-PDT对皮肤鳞状细胞癌A431细胞Caspase- 3及Caspase- 7表达的影响 [J]. 山东大学学报(医学版), 2014, 52(12):50-53, 59.
LIU Yuanyuan, WANG Yifei, ZHANG Chunmin,etal. Effects of ALA-PDT on Caspase- 3 and Caspase- 7 expressions incutaneous squamous cell carcinoma A431 cells [J]. Journal of Shandong University (Health Sciences), 2014, 52(12):50-53, 59.
[15]刘忠涛,刘志鹏,熊力,等. 纳米氧化硅空心球负载光敏剂对肝癌体内外的杀伤作用研究 [J]. 激光生物学报, 2014, 23(1):17-23.
LIU Zhongtao, LIU Zhipeng, XIONG Li,etal. The killing effects of photosensitizer- loaded hollow silica nanoparticles on hepatoma cellinvitroandinvivo[J]. Acta Laser Biology Sinica, 2014, 23(1):17-23.
[16]LI D, LI L, LI P,etal. Apoptosis of HeLa cells induced by a new targeting photosensitizer-based PDT via a mitochondrial pathway and ER stress [J]. Onco Targets Ther, 2015, 8:703-711.
[17]FAN B, MALATO Y, CALVISI D F,etal. Cholangiocarcinomas can originate from hepatocytes in mice [J]. J Clin Invest, 2012, 122(8):2911-2915.
[18]YOON H A, NOH M H, KIM B G,etal. Clinicopathological significance of altered Notch signaling in extrahepatic cholangiocarcinoma and gallbladder carcinoma [J]. World J Gastroenterol, 2011, 17(35):4023-4030.
[19]LICCIULLI S, AVILA J L, HANLON L,etal. Notch1 is required for Kras-induced lung adenocarcinoma and controls tumor cell survival via p53 [J]. Cancer Res, 2013, 73(19):5974-5984.
[20]EL KHATIB M, BOZKO P, PALAGANI V,etal. Activation of Notch signaling is required for cholangiocarcinoma progression and is enhanced by inactivation of p53invivo[J]. PLoS One, 2013, 8(10):e77433.
[21]KOFLER N M, SHAWBER C J, KANGSAMAKSIN T,etal. Notch signaling in developmental and tumor angiogenesis [J]. Genes Cancer, 2011, 2(12):1106-1116.
The Research of Notch1 in Photodynamic Therapy of Cholangiocarcinoma Cells
SUJin,DENGXiaofeng,XIONGLi,WENYu,MIAOXiongying*
(Department of Hepatobiliary Surgery, The 2nd Xiangya Hospital of Central South University, Changsha 410011, Hunan, China)
Abstract:Objective:1.Research the killing effect of Photosan mediated photodynamic therapy(PDT) for cholangiocarcinoma cells. 2.Investigate the expression of Notch1 protein in cholangiocarcinoma cells and the function of Notch1 when deal with PDT. Methods:1.Cholangiocarcinoma cells line QBC939 was cultured in vitro, and incubated with different concentration of Photosan when QBC939 growth is in the logarithmic phase, then irradiated with semi-conducted laser device with different light doses. Detect the killing effects of PDT for cholangiocarcinoma with MTT assay when applying with different incubation time and changable concentrations of photosensitizer and variable doses of light. 2.Detect the expression of Notch1 protein in cholangiocarcinoma cells by using immunofluoresence method and Western-blot method, and detect the variation of Notch1 after PDT. Result:1.MTT assay show that Photosan mediated PDT have killing effect to cholangiocarcinoma cells(P<0.05). Under certain circumstance, this result positively correlate to the longer incubation time, higher photosensitizer concentration and larger dose of light. 2.Notch1 was highly expressed in membrane and cytoplasm in cholangiocarcinoma which was detected by immunochemistry assay. The rate of Notch1 was decreassed when deal using different parameters for PDT. Conclusions:Notch1 protein was highly related to the development and proliferation of cholangiocarcinoma cells and plays important role in killing and hampering the growth of cholangiocarcinoma cells while treating with PDT.
Key words:photodynamic therapy; cholangiocarcinoma; Notch1 signal
文章编号:1007-7146(2015)06-0513-05
文献标志码:A
中图分类号:R735.8
*通讯作者:苗雄鹰,中南大学湘雅二医院普外科教授,博士生导师。(电子邮箱)4896142@qq.com
作者简介:苏进,中南大学湘雅二医院硕士研究生,研究方向为肝胆肿瘤。(手机)15874182107;(电子邮箱)915769309@qq.com
基金项目:国家自然科学基金项目(81372628;81402536);长沙市科技局科技计划(K1205018-31);湖南省自然科学基金(12JJ5048);湖南省科技计划(2012FJ3129;2013WK3029);湖南省科技厅项目(2014WK2016);美捷登青年科学研究基金(MJR20140011)
收稿日期:2015-09-10;修回日期:2015-10-10
doi:10.3969/j.issn.1007-7146.2015.06.004
