一株海洋真菌BY1产伸筋草醇发酵条件的优化
2015-03-08纪仁飞李爱贞
王 凯,纪仁飞,李爱贞
(集美大学食品与生物工程学院, 福建 厦门 361021)
一株海洋真菌BY1产伸筋草醇发酵条件的优化
王凯,纪仁飞,李爱贞*
(集美大学食品与生物工程学院, 福建 厦门 361021)
摘要:伸筋草醇(Clavatol)是具有多种生物活性的聚酮类三萜醇化合物。本文采用HPLC法分析海洋真菌BY1发酵产物中伸筋草醇的产量,研究不同培养基、海水浓度、培养天数、装液量对BY1菌株产伸筋草醇的影响。结果表明,海洋真菌BY1产伸筋草醇的发酵条件为:接种量1.0 mL种子发酵液,250 mL三角瓶装海水浓度为20% (v/v)的70 mL麦芽汁培养基(MA培养基),28 ℃,180 r/min,振荡培养9 d。
关键词:海洋真菌;伸筋草醇;发酵条件
海洋真菌分为专性海洋真菌和兼性海洋真菌两大类。其中专性海洋真菌是指只能够在大洋和河口地区生长和形成孢子的真菌,而兼性海洋真菌是指那些虽然来自淡水和陆地环境,但是能在海洋环境中生长和形成孢子的真菌[1]。海洋真菌为了适应海洋独特的生存环境,可代谢产生许多结构新颖,具有抗菌、抗肿瘤、抗氧化、抗病毒、抑制细胞周期、及拮抗血小板活化因子等不同生物活性的化合物[2-7]。
伸筋草醇(Clavatol)是首先发现于传统中药伸筋草中的一种聚酮类三萜醇化合物(图1)[8],具有抗炎、抗氧化、镇痛、调节免疫、治疗类风湿性关节炎、预防性治疗实验性矽肺、影响中枢神经系统药物作用及抑制乙酰胆碱酯酶等活性[9,10]。本实验室从福建省厦门市集美区红树植物海马齿(Sesuviumportulacastrum)中分离到一株海洋真菌BY1,并从其发酵产物中分离得到化合物伸筋草醇,本文采用HPLC分析菌株BY1发酵产物中伸筋草醇的产量,研究菌株BY1产伸筋草醇的发酵条件,为提高菌株BY1发酵产物中伸筋草醇的产量提供理论依据和技术支持。

图1 伸筋草醇的化学结构Fig.1 Chemical structure of Clavatol
1材料与方法
1.1材料
1.1.1菌种来源
菌株BY1分离自福建省厦门市集美区红树植物海马齿(Sesuvium portulacastrum)中。
1.1.2主要试剂
伸筋草醇标准品 (95%);高效液相色谱用甲醇为色谱纯,购于美国天地公司;蛋白胨、酵母粉、牛肉膏、玉米浆为生化试剂,购于上海华美生物公司;甲醇、三氯甲烷、乙酸乙酯、石油醚、NaNO3、K2S2O8、KH2PO4、MgSO4·7H2O、KCl、FeSO4·7H2O、(NH4)2SO4、蔗糖、葡萄糖等均为分析纯,购于国药集团化学试剂北京有限公司。
1.1.3发酵培养基
1)麦芽汁液体培养基(MA):500 mL麦芽汁,500 mL蒸馏水。121℃灭菌20 min后备用。
2)马铃薯葡萄糖培养基(PDB):马铃薯200.0 g,葡萄糖20.0 g,蒸馏水1000 mL。121℃灭菌20 min后备用。
3)察氏培养基(CZA):硝酸钠3.0 g,磷酸二氢钾1.0 g,氯化钾0.5 g,葡萄糖30.0 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,蒸馏水1 000 mL。121 ℃灭菌20 min后备用。
4)酵母蔗糖培养基(YES):酵母膏20.0 g,蔗糖150.0 g, MgSO4·7H2O 0.5 g,蒸馏水1 000 mL。121 ℃灭菌20 min后备用。
5)淀粉培养基(SYE):可溶性淀粉15.0 g,酵母膏4.0 g,蒸馏水1 000 mL。121 ℃灭菌20 min后备用。
6)高氏Ⅰ号培养基(NA):可溶性淀粉20.0 g,KNO31.0 g,氯化钠0.5 g,磷酸氢二钾0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,蒸馏水1 000 mL,pH 7.2-7.4,121℃、灭菌20 min后备用。
1.1.4主要仪器设备
ZWY-200D型恒温培养振荡器(上海智诚分析仪器制造有限公司);薄层硅胶 GF254 (青岛谱科分离材料有限公司);Agilent 1260系列高效液相色谱仪。
1.2方法
1.2.1种子发酵液制备
制备麦芽汁固体培养基平板,将菌株BY1以划线法接种到平板中,28 ℃培养3 d,从平板上切取生长一致的1 cm2的菌丝块(3块)接种到麦芽糖液体培养基中(100 mL/250 mL三角瓶),28 ℃,180 r/min培养2 d,制成种子发酵液[11]。
1.2.2发酵产物的制备
吸取1.0 mL种子发酵液至装有发酵培养基的250 mL三角瓶中,28 ℃,180 r/min,振荡培养。将摇瓶发酵液经过减压抽滤,收集菌体和发酵液上清。将发酵液上清用等体积乙酸乙酯萃取,萃取3次,合并发酵液上清乙酸乙酯相,减压浓缩后称重,甲醇溶解备用。
1.2.3生物量的测定
取干燥的培养皿准确称重(G1),将抽滤所得菌体置于培养皿内,将菌体连同培养皿置于烘箱中,100 ℃干燥至恒重,在干燥器中冷却至室温,准确称重 (G2),根据G1与G2算出菌体干重W(g/ L)[12],即得生物量。
1.2.4ABTS法测定抗氧化活性
测定方法参考Re等[13]的报道略做改变:称取一定质量的2,2-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)加蒸馏水配制成7 mmol/L 的ABTS水溶液,称取一定质量的K2S2O8用蒸馏水配制成45 mmol/L 的K2S2O8水溶液,将配制好的两种溶液按1∶1 的比例混合均匀,常温避光下放置12-16 h,即得到ABTS+溶液。测定时用先用甲醇将ABTS+溶液稀释至波长为734 nm 时吸光度为0.700±0.02的浓度,反应时发酵产物试液与ABTS+稀释溶液以1∶20的比例混合,30 ℃恒温水浴下反应6 min,在734 nm 下测定其吸光度Ax;空白以同体积的甲醇代替代谢产物试液,同样波长下测定吸光度A0。每个浓度3 个平行,清除率以下式计算:
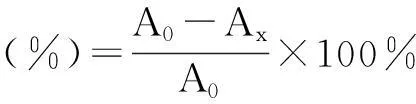
1.2.5标准曲线的绘制
用甲醇作溶剂,分别配置浓度为10、15、20、25、30、40、50 μg/mL的伸筋草醇标准品,在1.2.5的高效液相色谱条件下,测定各浓度在280 nm下的吸收峰面积。以质量浓度(μg/mL)为横坐标,以峰面积为纵坐标绘制标准曲线。
1.2.6HPLC分析伸筋草醇的产量
利用外标法分析伸筋草醇的产量。色谱条件为 C18(Waters ODS,4 μm,4.6×25 cm)色谱柱;紫外检测波长:280 nm;流动相:甲醇-超纯水(95∶5);流速:0.5 mL/min,进样量15 μL,进样间隔时间15 min,通过标准曲线计算伸筋草醇产量。
2结果与分析
2.1伸筋草醇(Clavatol)标准曲线

图2 伸筋草醇的HPLC色谱图Fig.2 The HPLC chromatograms of clavatol
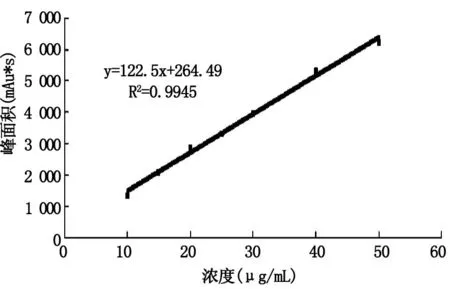
图3 伸筋草醇含量-峰面积标准曲线Fig.3 Thes standard curve of the content-peak area of clavatol
在1.2.5的色谱条件下,HPLC分析法测定的伸筋草醇保留时间为6.68 min,峰面积达到100%(图2)。将不同浓度的伸筋草醇标准溶液,在上述色谱条件下进行分析,制得标准曲线为y=122.5x+264.49,标准曲线的线性相关系数为0.9945(图3),结果表明峰面积与质量浓度之间有良好的线性关系。
2.2不同培养基的选择
选取不同培养基(YES、MA、CZA、SYE、NA和PDB各100 mL)发酵菌株BY1,28 ℃,180 r/min,振荡培养9 d,以抗氧化活性、生物量和伸筋草醇的产量为指标,对菌株BY1的发酵培养基进行选择。
菌株BY1不同培养基的抗氧化活性测定结果如表1所示。结果表明,菌株BY1不同培养基发酵产物在浓度为1 mg/mL时,抗氧化活性差别较大。MA培养基发酵产物的抗氧化活性最强,对ABTS+自由基清除率为100%;SYE培养基发酵产物的抗氧化活性次之,对ABTS+自由基清除率为71.63%;YES培养基发酵产物的抗氧化活性最低,对ABTS+自由基清除率仅为17.66%。
表1菌株BY1不同培养基发酵发酵产物抗氧化活性分析(ABTS法)
Tab.1The antioxidant activity of extract from different fermentation media of strain BY1 (the method of ABTS)

培养基清除率(%)10mg/mL1mg/mLYES97.1217.66MA100100CZA10030.00SYE10071.63NA10064.89PDB10053.37

图4 不同培养基培养9 d后的生物量和伸筋草醇的产量Fig.4 The yield of biomass and clavatol under in different medium after 9 days
菌株BY1不同培养基的生物量和伸筋草醇产量测定结果如图4所示。结果表明,菌株BY1不同培养基的生物量和伸筋草醇产量差别较大。MA培养基菌体的生物量最大,为10.47 g/L;CZA培养基菌体的生物量次之,为7.49 g/L;PDB培养基菌体的生物量最小,为0.65 g/L。NA培养基伸筋草醇的产量最高,为2040.22 mg/L;MA培养基伸筋草醇的产量次之,为720.51 mg/L;CZA培养基伸筋草醇的产量最低,为40.43 mg/L。
综上,NA培养基伸筋草醇的产量虽然最高,但其菌体生物量较少,仅为0.78 g/L,因此伸筋草醇总产量较低;而MA培养基伸筋草醇的产量仅次于NA培养基,菌体生物量最大,因此伸筋草醇总产量最高。再结合MA培养基抗氧化活性最强的实验结果,选择MA培养基为基础培养基进行进一步的单因素优化实验。
2.3不同海水浓度对伸筋草醇(Clavatol)产量的影响

图5 不同海水浓度下伸筋草醇的产量Fig.5 Production of clavatol in different concentration of seawater
选取不同海水浓度(0%、10%、20%、30%和40%)的MA培养基发酵菌株BY1,28 ℃,180 r/min,振荡培养9 d,研究不同海水浓度对伸筋草醇产量的影响,结果如图5所示。从图中可以看出,海水浓度从0%增加到40%的过程中,伸筋草醇的产量为先增加后减少的趋势,海水浓度为0%~20%时,随着海水浓度的增加,伸筋草醇的产量增大,海水浓度为20%时,伸筋草醇的产量达到最大值,为565.7 mg/L;海水浓度为30%~40%时,随着海水浓度的增加,伸筋草醇的产量减少,海水浓度为40%时,伸筋草醇的产量下降到381.3 mg/L。因此选择海水浓度20%(v/v)为最佳浓度。
2.4不同培养天数对伸筋草醇(Clavatol)产量的影响

图6 不同培养天数下伸筋草醇的产量Fig.6 Production of clavatol in the different number of days
应用100 mL MA培养基/250 mL三角瓶发酵菌株BY1,28 ℃,180 r/min,振荡培养5 d~14 d,研究不同培养天数对伸筋草醇产量的影响,结果如图6所示。从图中可以看出,培养天数为5 d~9 d时,随着培养天数的增加,伸筋草醇的产量增大,培养天数为9 d时,伸筋草醇的产量达到最大值,为598.4 mg/L;培养9 d后,伸筋草醇的产量下降,当培养天数为14 d时,伸筋草醇的产量最低,为158.6 mg/L。因此选择培养天数9 d为最佳天数。
2.5不同装液量对伸筋草醇(Clavatol)产量的影响
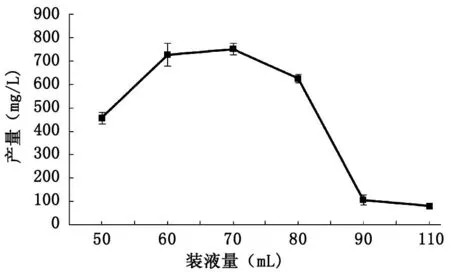
图7 不同装液量下伸筋草醇的产量Fig.7 Production of Clavatol in the different loaded liquid
选取不同装液量(50 mL MA培养基/250 mL三角瓶~ 110 mL MA培养基/250 mL三角瓶)发酵菌株BY1,28 ℃,180 r/min,振荡培养9 d,研究不同装液量对伸筋草醇产量的影响,结果如图7所示。从图中可以看出,装液量为50 mL MA培养基/250 mL三角瓶~70 mL MA培养基/250 mL三角瓶时,随着装液量的增加,伸筋草醇的产量增大,装液量为70 mL MA培养基/250 mL三角瓶时,伸筋草醇的产量达到最大值,为753.0 mg/L,装液量为80 mL MA培养基/250 mL三角瓶~ 110 mL MA培养基/250 mL三角瓶时,随着装液量的增加,伸筋草醇的产量减少,装液量为110 mL MA培养基/250 mL三角瓶时,伸筋草醇的产量最低,为80.5 mg/L。因此选择装液量70 mL MA培养基/250 mL三角瓶为最佳装液量。
3结论
对海洋真菌BY1产伸筋草醇的发酵条件进行单因素优化,确定发酵条件为:接种量1.0 mL种子发酵液, 250 mL三角瓶装海水浓度为20%(v/v)的70 mL麦芽汁培养基(MA培养基),28 ℃,180 r/min,振荡培养9 d。
参考文献
[1]朱伟明, 王俊锋. 海洋真菌生物活性物质研究之管见[J]. 菌物学报, 2011, 30(2):218-228.
ZHU Weiming, WANG Junfeng. A review on studies of secondary metabolites from marine fungi[J]. Institute of Microbiology, 2011, 30(2):218-228.
[2]REN H, LIU R, CHEN L,etal. Two new hetero-spirocyclic gamma- lactam derivatives from marine sediment-derived fungusAspergillussydowiD2-6[J]. Archives of Pharmacal Research, 2010, 33(4):499-502.
[3]QX W, MS C, M D,etal. Azonazine, a novel dipeptide from a Hawaiian marine sediment-derived fungus,Aspergillusinsulicola[J]. Organic Letters, 2010, 12(6):4458-4461.
[4]CAI S, SUN S, ZHOU H,etal. Prenylated Polyhydroxy-p-terphenyls fromAspergillustaichungensisZHN-7-07[J]. Journal of Natural Products, 2011, 74(5):1106-1110.
[5]JULIANTI E, OH H, JANG K H,etal. Acremostrictin, a highly oxygenated metabolite from the marine fungusAcremoniumstrictum[J]. Journal of Natural Products, 2011, 74(12):2592-2594.
[6]焦炳华. 海洋生命活性物质和海洋药物的研究与开发[J]. 第二军医大学学报, 2006, 27(1):5-7.
JIAO Binghua. Research and development of marine bio-active substances and drugs[J]. Academic Journal of Second Military Medical University, 2006, 27(1):5-7.
[7]刘楠, 李英新, 李志勇, 等. 珊瑚来源真菌天然产物及其活性的研究进展[J]. 中国海洋药物, 2014, 33(4):73-74.
LIU Nan, LI Yingxin, LI Zhiyong,etal. Advances in the natural products from coral-associated fungi and their activities[J]. Chinese Journal of Marine Drugs, 2014, 33(4):73-74.
[8]叶盛英, 杨本明, 杜欣, 等. 中药伸筋草研究概况[J]. 药学实践杂志, 2009, 27(1):18-21.
YE Shengying, YANG Benming, DU Xin,etal. The research summary of traditional Chinese medicine common clubmoss herb [J]. Joumal of Pharmaceutical Practice, 2009, 27(1):18-21.
[9]黄珊珊. 海洋真菌BYY-1代谢产物Clavatol的发酵条件及生物活性研究[D]. 厦门大学, 2007.
HUANG Shanshan. Study on the culture conditions and bioactivities of clavatol from marine-derived fungi BYY-1[D]. Xia Men University, 2007.
[10]ZHANG C L, ZHENG B Q, LAO J P,etal. Clavatol and patulin formation as the antagonistic principle ofAspergillusclavatonanicus, an endophytic fungus of Taxus mairei[J]. Applied Microbiology and Biotechnology, 2008, 78(5):833-840.
[11]王军, 林永成, 吴雄宇, 等. 从南海红树林内生真菌No.2533分离出新的异香豆素[J]. 中山大学学报, 2001, 40(1):127-128.
WANG Jun, LING Yongcheng,WU Xiongyu,etal. Avicennin A, a new isocomnarine from mangrove entophytic fungus No.2533 from the South China Sea[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2001, 40(1):127-128.
[12]陈劲平, 黄耀坚, 沈月毛, 等. 海洋真菌Phomopsis sp.产抗肿瘤药物南强菌素发酵培养基的优化[C]. 生物炼制技术交流和产业化研讨大会暨全国化工应用技术开发热点研讨会, 2008.
CHEN Jinping, HUANG Yaojian, SHEN Yuemao,etal. Optimization of medium components for production of antitumor agent Deacety Mycoepoxydiene by marine endophytic fungi Phomopsis sp [C]. Modern Chemical Industry, 2008, 28(2):275-277.
[13]RE R, PELLEGRINI N, PROTEGGENTE A,etal. Antioxidant activity applying an improved ABTS radical cation Octolorization assay[J]. Free Radical Biology & Medicine, 1999, 26(9-10):1231-1237.
Optimization of Fermentation Condition of Clavatol Produced by a Marine Fungus BY1
WANGKai,JIRenfei,LIAizhen*
(College of Food and Bioengineering, Jimei University, Xiamen 361021, Fujian, China)
Abstract:Clavatol is a polyketide and triterpene alcohol compound that has a variety of biological activities. This article used HPLC to analyse the Clavatol production in fermentation products of marine fungus BY1 strain, and research the influences on the yield of Clavatol in different media, concentration of seawater, culture days, and different loaded liquid. The optimal medium was Maltose medium (MA) with seawater concentration 20% (v/v) and the optimal culture condition was 70 mL medium in 250 mL triangular flask, inoculum 1.0 mL seed fermented liquid, temperature 28 ℃ and incubation time 9 days under the condition of oscillation at 180 r/min.
Key words:marine fungus; clavatol; fermentation condition
文章编号:1007-7146(2015)06-0551-05
文献标志码:A
中图分类号:Q932
*通讯作者:李爱贞(1964-),女,湖南涟源人,集美大学副教授,博士,微生物学方向。(手机)13779921643;(电子邮箱)azli@ jmu.edu.cn
作者简介:王凯 (1989-),男,河南安阳人,硕士研究生,主要从事天然化合物分离纯化及生物活性研究。(手机)15659836808;(电子邮箱)yuetadakai@163.com
基金项目:福建省教育厅项目(JB12140)
收稿日期:2015-04-10;修回日期:2015-05-10
doi:10.3969/j.issn.1007-7146.2015.06.011
