基于TiO2和CdTe荧光共振能量转移的PDT体外灭活HL60细胞实验研究
2015-03-08罗有焕艾保全熊建文
罗有焕,张 卿,陈 丽,艾保全,熊建文*
(1.广东省高等学校量子信息技术重点实验室, 华南师范大学物理与电信工程学院, 广东 广州510006;
2.广东工业大学物理与光电工程学院, 广东 广州 510006)
基于TiO2和CdTe荧光共振能量转移的PDT体外灭活HL60细胞实验研究
罗有焕1,张卿1,陈丽2,艾保全1,熊建文1*
(1.广东省高等学校量子信息技术重点实验室, 华南师范大学物理与电信工程学院, 广东 广州510006;
2.广东工业大学物理与光电工程学院, 广东 广州 510006)
摘要:为研究TiO2和CdTe量子点间荧光共振能量转移效率对PDT体外灭活HL60细胞的影响,本文以发射波长为407.8 nm的TiO2为供体,CdTe为受体,通过TiO2与CdTe超声混合构建荧光共振能量转移体系,研究了TiO2和CdTe量子点间荧光共振能量转移;其中体系中TiO2浓度为200 μg/mL时,通过逐渐增加体系中CdTe浓度来观察供体TiO2荧光强度变化,根据Forster能量共振转移理论计算体系能量转移效率。之后将体系用于PDT体外灭活HL60细胞的实验研究,采用CCK- 8 法,结合酶联免疫检测仪进行细胞活性检测,得出不同浓度下体系的PDT灭活效率。发现当TiO2-CdTe体系荧光共振能量转移效率20.21%时,PDT灭活效率为53.75%,而当体系能量转移效率为6.77%时,灭活效率达到了71.54%,实验表明在一定浓度范围内,TiO2-CdTe混合体系荧光共振能量转移效率低时,PDT灭活效率更高。这可能是由于TiO2-CdTe之间能量共振转移低时,容易致使TiO2表面光生电子和空穴复合率降低,提高了二氧化钛的光催化活性,导致灭活效率增高。
关键词:TiO2-CdTe;共振能量转移;光动力疗法(PDT);白血病HL60细胞
0引言
光动力疗法(photo dynamic therapy,PDT)是借助光敏剂进入患者体内后,动态浓集于生长异常的组织(如肿瘤、鲜红斑痣及黄斑病变),后者在一定波长光辐照下,因其所摄入光敏剂发生光动力敏化反应而产生活性氧物质,导致生物大分子光氧化失活,并由此造成细胞器损伤而破坏目标组织以达到治疗目的方法[1,2]。在光动力疗法中,由于肿瘤等在人体中的深浅不一,使得传统光敏剂的应用受到限制,而量子点由于其尺寸效应,使其吸收光谱能够被调节去匹配深浅不同的肿瘤的需要[3,4]。量子点直接作为光敏剂或用于能量转移提高传统光敏剂的光动力疗效已初见成效[5-6]。
荧光成像技术在现代生命科学中是一种非常重要的实验研究手段。近年来生命科学领域出现了一种崭新的技术:荧光共振能量转移(fluorescence resonance energy transfer, FRET),是一种通过荧光物质间发生荧光能量转移进行分析的一种实验方法。FRET是指在两个不同的荧光基团中,若一个荧光基团(供体Donor)发射光谱与另一个基团(受体acceptor)的吸收光谱有一定的重叠,两个荧光基团间的距离合适时(一般小于10 nm),即可观察到荧光能量由供体向受体转移的现象。研究表明,量子点不仅可以作为FRET供体也可以作为受体[7-9],利用这种技术能够定时定量、定位、无损伤检测细胞内的分子相互作用[10-12]。
传统PDT通过灭活实验方法研究得出该光敏剂的最佳作用时间、光照强度、药物浓度、药物配比等,进而得出最佳PTD效率,但实验操作周期长、繁琐,不经济。本文将研究CdTe-TiO2混合体系的荧光共振能量转移现象及将其应用于PDT体外灭活HL60细胞实验研究;通过体系的荧光光谱图研究其荧光能量转移规律,计算体系荧光共振能量转移的效率,并将不同浓度比例的TiO2-CdTe体系用于PDT体外灭活HL60细胞,通过检测细胞活性得出在不同浓度下体系的PDT灭活效率,探讨CdTe-TiO2混合体系能量转移效率与PDT灭活效率的关系,试图从能量共振转移的角度出发去寻求最佳作用药物浓度配比,达到最佳PDT灭活效果。
1实验部分
1.1仪器与试剂
UV-1700紫外-可见光谱仪(日本 Shimadzu),JEM-2100HR透射电子显微镜(日本 JEOL),X射线粉末衍射仪(德国 Bruker),WFY-28型荧光分光光度计(天津 拓普),DF-101S集热式恒温加热磁力搅拌器(河南矛华仪器有限公司),SK2510LHC超声仪(上海科导),TiO2(P25,德国DEGUSSA),碲粉,NaBH4 , 巯基丙酸,CdCl2,NaOH, 血清含量为 10%的完全RPMI-1640 培养基 (美国 GIBCO),CCK-8 试剂 (日本同仁化学研究所),5%台盼蓝细胞染色液(美国 Invitrogen),无水乙醇,去离子水, CountessTM型自动细胞计数仪(美国 Invitrogen),PDT 反应室(自行设计),Bio-Rad 美国伯乐 imark 酶标仪,SW-CJ型洁净工作台(苏州安泰空气技术),HH.CP-TW80 升二氧化碳培养箱(上海一恒科技), MDF-192(N)型医用低温冰箱(日本三洋),HC-2518高速离心机(科大创新股份有限公司),微量移液枪(芬兰),96 孔培养板,细胞计数板等其他常规器皿。
1.2实验方法
1.2.1量子点的合成
参照Zhang H等[13]的方法并作适当调整,将碲粉和NaBH4分别倒入反应瓶中,注入适量水,磁力搅拌下进行反应半小时,反应过程中反应体系由氮气脱氧保护,得NaHTe溶液。在氮气饱和的CdCl2水溶液中加入巯基丙酸,用NaOH调溶液的PH在9.5左右,用强磁力搅拌半小时后加入NaHTe溶液,于95摄氏度下磁力搅拌回流2小时,整个实验过程通氮气保护,获得CdTe水溶性量子点,之后再离心、干燥、研磨得到CdTe粉末。
1.2.2量子点表征
测量量子点CdTe 的吸收光谱;荧光发射光谱;X射线衍射图;透射电镜图。
1.2.3混合体系CdTe-TiO2荧光共振能量转移体系的构建
配比一定浓度的TiO2溶液,与不同浓度的CdTe混合,超声混合半小时使其充分混合均匀,然后测定TiO2的荧光光谱。考虑到体系之后用于PDT体外灭活HL60细胞,根据实验室以往的最佳数据研究,混合体系中TiO2的浓度设定为200 μg/mL,CdTe浓度分别为0 μg/mL 、0.25 μg/mL、0.5 μg/mL、0.75 μg/mL、1 μg/mL、25 μg/mL、50 μg/mL、75 μg/mL、100 μg/mL。同样地固定CdTe浓度为25 μg/mL,与浓度为0.5 μg/mL、1 μg/mL、1.5 μg/mL、2 μg/mL的TiO2混合,超声混合半小时后测量CdTe的荧光光谱变化。根据供体荧光强度变化来计算不同浓度混合体系下的荧光共振能量转移效率。
1.2.4细胞培养
白血病 HL60 细胞采用胎牛血清含量为10 %的RPMI- 1640 培养基培养传代,置于培养箱内培养。培养箱的相关参数设置如下:箱内温度为 37 ℃,箱内空气湿度为95%,CO2体积分数为5 %。当细胞进入对数生长期时,取一定量的细胞液,通过倍比稀释法确定细胞浓度。
1.2.5细胞活性检测
本文采用与传统方法相比具有操作简单、灵敏度高、可重复性好的 CCK- 8(cell counting Kit- 8)法[14, 15],结合DG5031型酶联免疫检测仪进行细胞活性检测。为尽可能降低误差,我们采用双波长法进行检测:以450 nm作为测量波长,630 nm作为参比波长检测细胞活性的一般步骤为: (1)制备细胞悬液,(2)将细胞悬液加入96 孔培养板,置于37 ℃培养箱中培养一段时间,(3)加入适量的CCK-8试剂,置于37 ℃培养箱中遮光培养4小时,(4)测定吸光度(OD值)。
1.2.6混合体系CdTe-TiO2用于PDT体外灭活HL60的实验设计
根据实验内容在96孔培养板进行规划实验,实验分为光照板和遮光板,每个板分别设置调零组和实验组。为尽减小实验误差,同一条件设置三个重复孔。取对数生长期的HL60细胞以细胞浓度为2×105个/mL接种在96孔板设定好的实验组中,实验组中的每孔接种体积为100 μL细胞,而在调零组中,只加入200 μL的血清含量为10%的完全RPMI-1640培养液,接着在实验组中加入100 μL的光敏剂溶液,并使HL60细胞液和光敏剂溶液的混合液中光敏剂最终浓度和体系在测试能量共振转移中的浓度一致,从而达到实验要求。随后,用振荡器将混合液混合均匀,再用无水乙醇擦拭96孔培养板,然后将96孔培养板放入37 ℃的二氧化碳培养箱中培养24小时,之后光照板在本实验室自主研发的光动力反应室进行光照1 h,遮光板避光处理,接着将96孔培养板继续放入二氧化碳培养箱中培养一段时间,之后每孔加入20 μL CCK-8试剂,混合均匀再放入二氧化碳培养箱避光培养2个小时,最后使用 Bio-Rad美国伯乐imark酶标仪,以450纳米为测量波长,630纳米为参比波长,对上述实验组和调零组进行活性检测。
2实验结果与讨论
2.1量子点CdTe的表征

图1 CdTe的吸收光谱Fig.1 Aborption spectra of CdTe

图2 CdTe量子点的XRD图Fig.2 XRD pattern of CdTe quantum dots

图3 CdTe量子点的透射电镜图Fig.3 TEM image of CdTe QDs
图1为CdTe的吸收光谱,可以看到量子点在478 nm处有吸收峰,且吸收范围较宽。图2为CdTe量子点的XRD图,具有二个衍射峰,其中峰形明显,并非尖锋,符合小尺寸量子点的特点,峰位对应的角度分别是:24.38、40.31和47.02,分别对应于CdTe立方晶系的(111)、(220)、(311) 3个晶面,显示了比较好的晶形结构,属于闪锌矿立方晶相。利用本实验的方法制得的CdTe在水溶液中具有良好的分散性与稳定性,如图3所示,所制备CdTe的TEM照片,CdTe近似球形,尺寸为3-5 nm之间,分散性较均匀,基本没有团聚现象。图4和图5中的曲线1分别为CdTe和TiO2在激发波长为345 nm下的荧光光谱图。
2.2CdTe-TiO2量子点间的荧光共振能量转移
从图4曲线1中可以看到TiO2的荧光发射峰位于407.8 nm和470 nm处,而从图1.CdTe量子点的吸收光谱中可以观察到CdTe在400-500 nm之间有很强的吸收,若将TiO2作为供体,CdTe作为受体,即可观察到供体的发射光谱和受体的吸收光谱有很好的光谱重叠,而供体的发射光谱(图5中曲线1)和受体的发射光谱几乎没有重叠部分,发射光谱不会产生相互干扰,说明用该波长的TiO2作为供体与CdTe可以构成荧光共振能量转移体系。
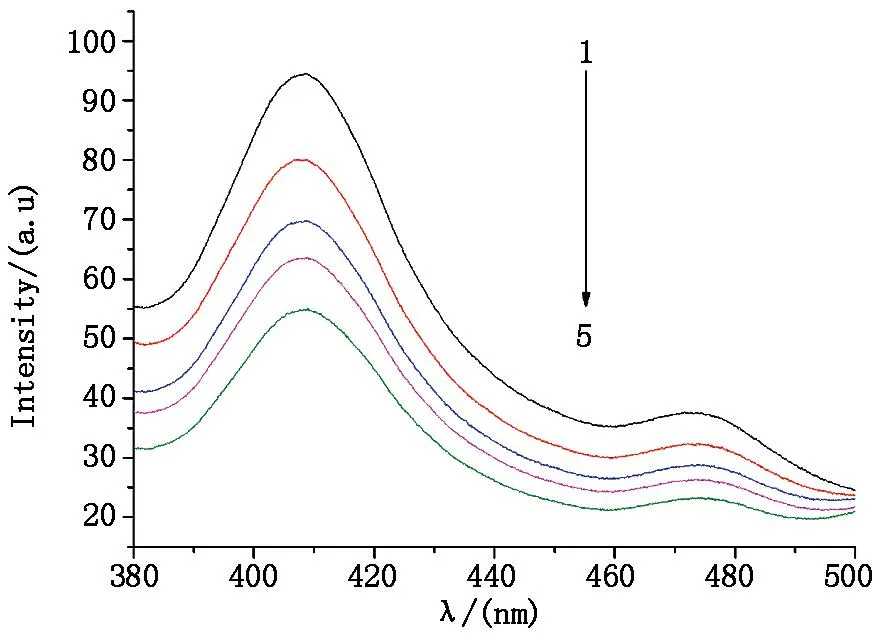
TiO2: 200 μg/mL ; CdTe(1-5): 0 μg/mL, 25 μg/mL, 50 μg/mL, 75 μg/mL, 100 μg/mL图4 CdTe浓度对TiO2-CdTe体系能量转移的影响Fig.4 Effect of CdTe concentration on energy transfer between TiO2 and CdTe

CdTe: 25 μg/mL ; TiO2 (1-5): 0 μg/mL, 0.5 μg/mL, 1 μg/mL, 1.5 μg/mL, 2 μg/mL图5 TiO2浓度对TiO2-CdTe体系能量转移的影响Fig.5 Effect of TiO2 concentration on energy transfer between TiO2 and CdTe
为了进一步研究TiO2-CdTe体系荧光共振能量转移,将固定TiO2的浓度不变,逐渐增加CdTe的浓度,得到体系中TiO2的荧光光谱如图4所示,随着CdTe浓度的增加,TiO2的主要荧光发射峰(407.8 nm)峰值强度逐渐减弱;固定CdTe的浓度不变,逐渐增加TiO2的浓度,得到体系中的CdTe的荧光光谱如图5所示,随着TiO2的浓度逐渐增大,CdTe荧光峰强度逐渐增大,说明了TiO2-CdTe之间发生了有效的能量转移。
2.3CdTe-TiO2体系PDT体外灭活HL60
2.3.1计算CdTe-TiO2荧光共振能量转移效率
考虑到CdTe中的镉离子对细胞具有毒性[16, 17],并结合本实验室以往的实验数据研究[18, 19],本次PDT体外灭活HL60细胞实验选用的浓度为:在CdTe-TiO2混合体系中,CdTe浓度的分别为0 μg/mL、 0.25 μg/mL、0.5 μg/mL、0.75 μg/mL、1 μg/mL,TiO2的浓度为200 μg/mL,测试体系中TiO2的荧光光谱图如图6所示。

TiO2: 200 μg/mL ; CdTe(1-5): 0 μg/mL, 0.25 μg/mL, 0.5 μg/mL, 0.75 μg/mL, 1 μg/mL图6 CdTe浓度对TiO2-CdTe体系能量转移的影响Fig.6 Effect of CdTe concentration on energy transfer between TiO2 and CdTe
根据Forster荧光能量共振转移理论(fluorescence resonance energy transfer,FRET),其能量转移效率E与给供-受体间的距离(r)以及临界能量转移距离(R0)有关,能量转移效率E表达式为:
(1)
式中Fda是有受体时供体的荧光强度,Fd为没有受体时供体的荧光强度,n为每个供体分子周围受体分子的数目,R0是能量转移效率达到50%的距离,它依赖于供受体双方的物理性质以及它们的取向,可用公式表达为:
(2)
式中k2为偶极空间取向因子,n为溶剂的折射率,Φd为无受体存在时供体的荧光量子产率,J(λ)为供体的荧光发射光谱与受体的吸收光谱之间的重叠积分,即:
(3)
式中F(λ)为荧光供体在波长λ处的荧光强度,ε(λ)为受体在波长λ处的摩尔吸收系数,能量转移效率可以式子(1)求出。根据式(1)可求出得到体系中CdTe浓度为0.25 μg/mL、0.5 μg/mL、0.75 μg/ml、1 μg/mL的能量转移效率分别为17.25%、20.21%、11.75%、6.77%。
2.3.2不同浓度的TiO2-CdTe体系PDT体外灭活HL60细胞实验研究
利用CCK-8法测量在光照板和遮光板中,添加了不同浓度TiO2-CdTe后培养的HL60细胞的OD 值,测的实验OD值如图7所示:

图7 混合体系TiO2-CdTe中不同CdTe浓度PDT对HL60细胞OD值的影响Fig.7 The influence of different CdTe concentration of TiO2-CdTe to OD values of HL60 cells base on PDT
光照后,各遮光组细胞的OD值均高于光照组细胞的OD值,灭活HL60 细胞的效率(PDT efficiency)用Pe表示:
(4)
其中,ODR表示光照后细胞的OD值,ODWR表示不光照时的细胞OD值。跟据式(4)可得到混合体系TiO2-CdTe中不同CdTe浓度的PDT灭活效率为59.70%;53.75%;59.02%;71.54%。
2.3.3量子点间能量转移效率与PDT灭活效率存在的对应关系
根据A、B、C、D四组得出的能量转移效率和PDT灭活效率参数,将其绘制成体系TiO2-CdTe共振能量转移效率和PDT体外灭活效率的关系图。如图8所示,从图中我们可以发现,在一定浓度范围内,随着体系能量共振转移效率的降低,灭活效率有所增高,当体系TiO2-CdTe荧光共振能量转移效率20.21%时,PDT灭活效率为53.75%,而当体系能量转移效率为6.77%时,灭活效率达到了71.54%。本次实验表明在一定浓度范围内,TiO2-CdTe混合体系荧光共振能量转移效率低时,PDT灭活效率更高。

图8 能量转移效率与PDT灭活效率Fig.8 Energy transfer efficiency and PDT inactivated efficiency
3结论
本文用合成的CdTe与TiO2超声混合,研究两者之间的能量共振转移,并将两者的混合体系用于体外PDT灭活HL60细胞。研究表明量子点能够使TiO2的吸收光谱拓宽,光能利用效率明显增大[20-22],光催化效率增高,我们此前实验结果表明,TiO2-CdTe混合体系要比单纯的TiO2灭活效率要高,这说明量子点CdTe加入有效的提高了TiO2的光催化活性。而本次实验结果表明,当TiO2-CdTe之间能量共振转移低时,PDT灭活效率增高。这可能是由于TiO2-CdTe之间能量共振转移低时,容易致使TiO2表面光生电子和空穴复合率降低,从而提高了二氧化钛的光催化活性,导致灭活效率增高。对于加入量子点后TiO2光催化活性的提高,PDT灭活效率提高的程度,我们可以从TiO2与CdTe能量共振转移的角度去分析。事实上TiO2-CdTe体系对细胞的灭活机理较为复杂,为更清楚地了解其作用机理,更多的相关实验研究是我们下一步的工作。总之,在寻求TiO2-CdTe体系PDT最佳作用浓度、配比的问题上,根据我们的实验分析可以从TiO2-CdTe荧光共振能量转移效率方面入手,去寻求合适的药物配比、浓度,以求达到最佳的灭活效果。
参考文献
[1]TYRRELL J, CAMPBELL S M, CURNOW A. Monitoring the accu-mulation and dissipation of the photosensitizer protoporphyrin IX during standard dermatological methyl-aminolevulinate photo-dynamic therapy utilizing noninvasive fluorescence imaging and quantification [J]. Photodiagnosis Photodyn Ther, 2011, 8(1):30-38.
[2]CHANG C P, NAGEL D J, ZAGHLOUL M E. Irradiance dependence of photobleaching of resorufin [J]. J Photochem & Photobiol A Chem, 2011, 217(2-3):430-432.
[3]BAKALOVA R, OHBA H, ZHELEV Z,etal. Quantum dot anti-CD conjugates:are they potential photosensitizers or potentiators of classical photosensitizing agents in photodynamic therapy of cancer? [J]. Nano Lett, 2004, 4(9):1567-1573.
[4]SAMIA A C, CHEN X, BURDA C. Semiconductor quantum dots for photodynamic therapy [J]. J Am Chem Soc, 2003, 125(51):15736-15737.
[5]GENERALOV R, KAVALIAUSKIENE S, WESTR∅M S,etal. Entrapment in phospholipid vesicles quenches photoactivity of quantum dots [J]. Int J Nanomedicine, 2011, 6:1875-1888.
[6]SINGH S P. Multifunctional magnetic quantum dots for cancer theranostics [J]. J Biomed Nanotechnol, 2011, 7(1):95-97.
[7]LUNZ M, BRADLEY A L, CHEN W Y,etal. Förster resonant energy transfer in quantum dot layers [J]. Superlattices & Microstructures, 2010, 47(1):98-102.
[8]LUNZ M, BRADLEY A L, GERARD V A,etal. Concentration dependence of forster resonant energy transfer between donor and acceptor nanocrystal quantum dot layers:effect of donor-donor interactions [J]. Physical Review B Condensed Matter, 2011, 83(11):52-57.
[9]KOMARALA V K, BRADLEY L, RAKOVICH Y,etal. Surface plasmon enhanced forster resonance energy transfer between the CdTe quantum dots [J]. Applied Physics Letters, 2008, 93(12):2666-2672.
[10]GAITS F, HAHN K. Shedding light on cell signaling:interpretation of FRET biosensors.[J]. Sci STKE, 2003, 165:PE3.
[11]TAKEMOTO K, NAGAI T, MIURA M M. Spatio-temporal activation of caspase revealed by indicator that is insensitive to environmental effects [J]. J Cell Biol, 2007, 160(2):235-243.
[12]WANG F, CHEN T S, XING D,etal. Measuring dynamics of caspase-3 activity in living cells using FRET technique during apoptosis induced by high fluence low-power laser irradiation [J]. Lasers Surg Med, 2005, 36(1):2-7.
[13]ZhANG H, WANG L, XIONG H,etal. Hydrothermal synthesis for high-quality CdTe nanocrystals [J]. Advanced Materials, 2003, 15(20):1712-1715.
[14]TOMINAGA H, ISHIYAMA M, OHSETO F,etal. A water-soluble tetrazolium salt useful for colorimetric cell viability assay [J]. Analytical Communications, 1999, 36(2):47-50.
[15]熊建文, 肖化, 张镇西. MTT法和CCK-8法检测细胞活性之测试条件比较 [J]. 激光生物学报, 2007, 16(5):559-562.
XIONG Jianwen,XIAO Hua,ZHANG Zhenxi. An experimental research on different detection conditons between MTT and CCK-8 [J]. Acta laser Biology Sinica, 2007, 16(5):559-562.
[16]YUANYUAN S, YAO H, HAOTING L,etal. The cytotoxicity of cadmium based, aqueous phase - Synthesized, quantum dots and its modulation by surface coating [J]. Biomaterials, 2009, 30(1):19-25.
[17]CHEN N, HE Y, SU Y,etal. The cytotoxicity of cadmium-based quantum dots [J]. Biomaterials, 2012, 33(5):1238-1244.
[18]贺宇路. 基于CdTe和CdSe量子点体外PDT灭活白血病 HL60细胞实验研究 [J]. 生物医学, 2012, 2:1-5.
HE Yulu. Experimental research on thevitroinactivation of HL60 cells based on CdTe and CdSe quantum dots [J]. Hans Journal of Biomedicine, 2012, 2:1-5.
[19]WANG J, CHEN L, JIANG F,etal. Experimental research of destruction of leukemia tumor cells HL60 by QDs-CdTe-based PDT combined with antibioticsinvitro[J]. Advanced Materials Research, 2012, 365:205-208.
[20]MAURYA A, CHAUHAN P. Structural and optical characterization of CdS/TiO2nanocomposite [J]. Materials Characterization, 2011, 62(4):382-390.
[21]HUI F, THANHTHUY T T, LAN C,etal. Visible light-induced efficiently oxidative decomposition of p-Nitrophenol by CdTe/TiO2nanotube arrays [J]. Chemical Engineering Journal, 2013, 215-216:591-599.
[22]LI D, WANG S, WANG J,etal. Synthesis of CdTe/TiO2nanoparticles and their photocatalytic activity [J]. Materials Research Bulletin, 2013, 48(10):4283-4286.
本刊加入CNKI中国期刊全文数据库的声明
本刊已许可中国学术期刊(光盘版)电子杂志社在中国知网及其系列数据库产品中以数字化复制、汇编、发行、信息网络传播本刊全文。该社著作权使用费与本刊稿酬一并支付。作者向本刊提交文章发表的行为即视为同意我社上述声明。
Experimental Research on the PDT Vitro Inactivation of HL60 Cells Based on Fluorescence Resonance Energy Transfer between
TiO2and CdTe Quantum DotsLUOYouhuan1,ZHANGQing1,CHENLi2,AIBaoquan1,XIONGJianwen1*
(1.Laboratory of Quantum Information, School of Physics and Telecommunication Engineering,South China Normal University, Guangzhou 510006, Guangdong, China; 2.School of Physics and Optoelectronic Engineering, Guangzhou 510006, Guangdong, China)
Abstract:A fluorescence resonance energy transfer system based on TiO2and CdTe ultrasonic mix was built to study how fluorescence resonance energy transfer between TiO2and CdTe quantum dots influence HL60 viability in PDT experiment. TiO2with 407.8 nm emission wavelength was used as donor, and CdTe as acceptor. The intensity change of donor TiO2was observed when the concentration of CdTe was increased in proportion, and the concentration of TiO2remained at 200 μg/mL. The system energy transfer efficiency was calculated according to the theory of Forster energy transfer. The system was then applied in in vitro PDT experiment based on HL60 cells. With CCK-8 method, the cell viability under different drug concentration was calculated. Our data showed that when the fluorescence resonance energy transfer efficiency of TiO2-CdTe hybrid system was 20.21%, the PDT inactivated efficiency was 53.75%; when the system energy transfer efficiency was 6.77%, the inactivated efficiency reached 71.54%. The results showed that low fluorescence resonance energy transfer efficiency promote higher PDT inactivation efficiency. This might be on account of the decrease of the recombination rate of electron-hole pair caused by the decline of fluorescence resonance energy transfer efficiency, which enhanced the photocatalytic activity of TiO2.
Key words:TiO2-CdTe; resonance energy transfer; photodynamic therapy(PDT); leukemic HL60 cell
文章编号:1007-7146(2015)06-0506-07
文献标志码:A
中图分类号:R318.51
*通讯作者:熊建文(1962-),男,广东人,华南师范大学教授,博士,博士生导师,主要研究方向为激光生物学与生物医学光子学。(电话)020- 85216860;(电子邮箱)jwxiong@scnu.edu.cn
作者简介:罗有焕(1989-),男,广西陆川人,硕士研究生,主要研究方向为光电技术及应用研究。(电子邮箱)youhuanluo@126.com
基金项目:国家自然科学基金(61072029);广州市科技计划资助项目(2014J4100049)
收稿日期:2015-09-16;修回日期:2015-10-13
doi:10.3969/j.issn.1007-7146.2015.06.003
