早期胃癌中淋巴结微转移及LMO4、DLEC1表达的临床意义
2014-09-13陈晓军刘胜春
陈晓军 刘胜春
随着医疗水平的提高,早期胃癌的诊断率日益增高,手术是其最有效的治疗手段,但术后仍有部分患者会复发,主要是由淋巴结微转移所致。LMO4、DLEC1已被认为在消化道恶性肿瘤的转移过程中起重要作用,但LMO4、DLEC1与早期胃癌淋巴结微转移之间关系的临床意义尚未清楚。本研究通过免疫组化方法前瞻性研究50例早期胃癌患者淋巴结微转移与原发灶LMO4、DLEC1的关系。
1 材料与方法
1.1 一般资料
本研究中50例早期胃癌组织标本取自我院普外科2007年6月-2010年2月手术标本,其中男性31例,女性19例;年龄37~71岁,平均55.6岁;按组织学分类:高分化20例,中分化13例,低分化14例,印戒细胞3例;按肿瘤部位分类:胃体8例,胃窦42例;按侵犯深度分类:黏膜层11例,黏膜肌层17例,黏膜下层22例;按淋巴结转移分类:有淋巴结转移3例,无淋巴结转移47例。纳入标准:本组资料全部组织标本获取前未经放疗和化疗,有详细的临床资料,所有患者均行标准的胃癌D2根治术。
1.2 主要试剂
LMO4和DLEC1兔抗人多克隆抗体购自北京中杉金桥生物技术有限公司,SP 免疫组化试剂盒、DAB 显色试剂盒及磷酸盐缓冲液(PBS)均购自武汉博士德生物工程有限公司。亚甲蓝购自美国Gibco公司,细胞角蛋白(cytokeratin,CK)单抗鼠抗CK-20蛋白购自美国Cell signaling公司。
1.3 免疫组织化学染色
1.3.1 淋巴结免疫染色 全组50例早期胃癌患者术后标本共采集到1 225枚淋巴结,平均每例24.5枚,分别进行常规HE染色和CK免疫组化染色,以标准SAB免疫组织化学染色法进行CK染色,肿瘤及淋巴结标本用10%甲醛固定和石蜡包埋,石蜡切片脱蜡、水化、3%过氧化氢、EDTA溶液修复抗原后、山羊血清封闭后,滴加CK抗体(1∶500工作浓度),冲洗并滴加辣根过氧化酶标记的二抗,并以DAB显色,以亚甲蓝进行背景染色,以PBS作为阴性对照。
1.3.2 LMO4和DLEC1免疫组化检测 采用免疫组化 SP 法,并用 DAB 显色。所有标本均采用高温高压修复抗原,并按照试剂说明书进行染色。用已知的阳性切片作为阳性对照,PBS 代替一抗作为阴性对照。
1.4 染色结果判定
所有结果由两位有经验的病理医师对染色切片进行诊断,CK染色表现为黄棕色颗粒,只在CK染色中发现,但HE染色未能诊断的淋巴结转移称为微转移。
LMO4蛋白阳性染色表现为细胞核呈棕黄色或者棕褐色。根据视野中染色的细胞所占百分比评估染色的强度,分为3个等级:55%以下表示轻度及以下染色,>55%~70%为中度染色,>70%为强度染色。定义染色等级<55%的是低表达,≥55%即认为是高表达。
DLEC1蛋白阳性染色表现为细胞质呈棕黄色或者棕褐色,根据视野中染色的细胞所占百分比评估染色的强度,分为4个等级:0~5%为-,≥6%~25%为+,≥26%~50%为++,>50%为+++。“-,+”为低表达,“++,+++”为高表达。
1.5 统计学分析
采用SPSS 13.0统计软件进行统计分析。采用χ2检验、确切概率法及Spearman等级相关分析法。用Kaplan-Meier法绘制5年生存曲线,P<0.05为有统计学意义。
2 结果
2.1 早期胃癌淋巴结转移情况
50例早期胃癌患者中,HE 染色发现的淋巴结转移2例,而 CK 免疫组化染色发现的淋巴结转移12例,两种方法淋巴结转移率差异比较有统计学意义(χ2=6.597,P<0.05);在全部1 225枚淋巴结中,淋巴结受累率HE染色发现的为7枚,而CK免疫组化染色发现的淋巴结受累率为25枚,两种方法淋巴结转移率差异比较有统计学意义(χ2=33.793,P<0.05)。
2.2 早期胃癌临床病理因素与淋巴结微转移的关系
在50例早期胃癌中黏膜内癌的淋巴结转移率为9.1%(1/11),黏膜肌层癌的淋巴结转移率为11.8%(2/17),黏膜下癌的淋巴结转移率为40.9%(9/22),淋巴结微转移与侵犯深度有显著相关性(P<0.05);高分化癌发现的淋巴结转移率为5.0%(1/20),中分化癌发现的淋巴结转移率为15.4 %(2/13),低分化癌发现的淋巴结转移率为57.1 %(8/14),印戒细胞癌发现的淋巴结转移率为33.3%(1/3),淋巴结微转移与侵犯程度有显著相关性(P<0.05),但与肿瘤直径、肿瘤部位无相关性。见表1。
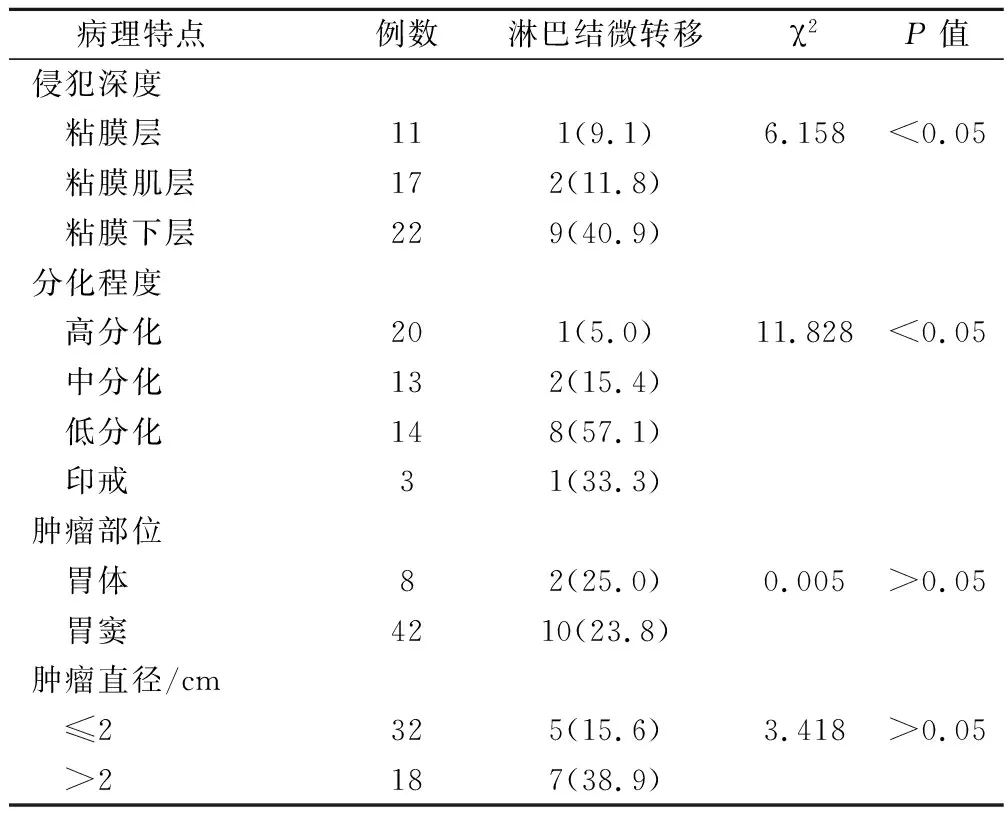
表1 早期胃癌临床病理资料及淋巴结微转移的关系(例,%)
2.3 LMO4、DLEC1在早期胃癌中的表达
早期胃癌组织中LMO4表达与浸润深度、淋巴结微转移、组织分化程度、肿瘤大小呈明显正相关(P<0.05),DLEC1表达与浸润深度、淋巴结微转移、组织分化程度、肿瘤大小呈明显负相关(P<0.05)。两者表达均与患者的年龄、性别无关(P>0.05)。见表2。
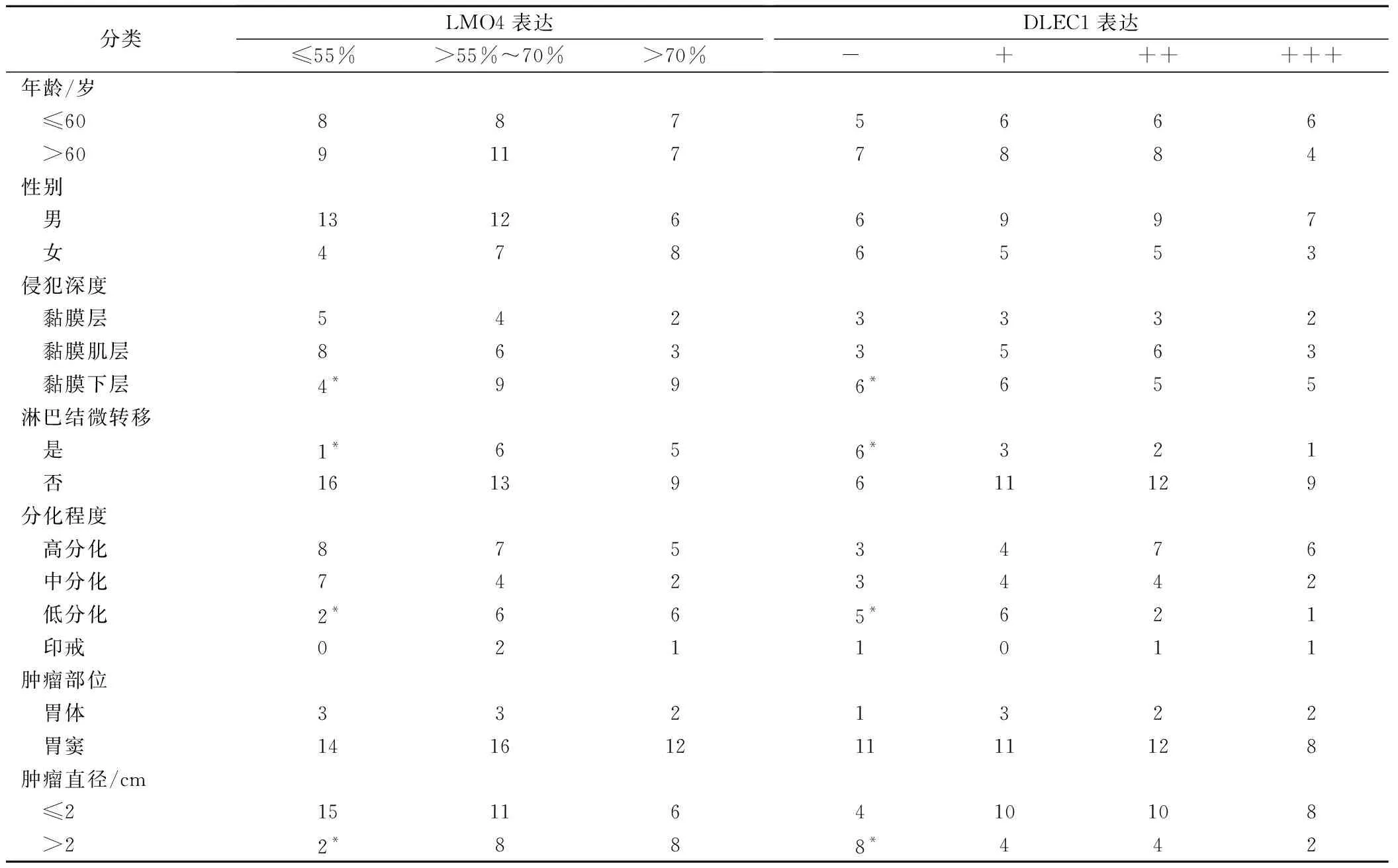
表2 早期胃癌组织中LMO4、DLEC1表达/例
注:*为与高表达组相比较,P<0.05。
2.4 LMO4、DLEC1在早期胃癌组织中表达的关系
在早期胃癌组织中LMO4与DLEC1蛋白表达经Spearman等级相关性分析,结果显示,LMO4与DLEC1蛋白存在负相关(γ=-0.788,P=0.001)。见表3。

表3 在早期胃癌组织中LMO4、DLEC1的关系/例
2.5 早期胃癌患者的预后
早期胃癌患者5 年生存率为96.0%,平均时间35.2个月(28~60个月)。按早期胃癌患者的淋巴结微转移分为微淋巴结转移组和无微淋巴结转移组。根据生存分析法分析微淋巴结转移的无瘤中位生存时间为32.5个月,无微淋巴结转移的无瘤中位生存时间为38.8个月,两者无瘤生存率的差异无统计学意义(P=0.068)。
3 讨论
每年全球新发胃癌100余万例,死亡约80万例,中国占35%,发病率和死亡率均是世界平均水平的两倍多。转录调节因子LMO4、DLEC1与胃癌的发生发展及患者的预后是否存在相关性,其病因、发病机制和浸润转移的信号传导机制等仍尚未明确。如何有效地阻止肿瘤的发生转移及改善患者预后生活质量已成为现今学者研究的方向。人类基因组编码4个 LMO (lim domain only)蛋白,分别是 LMO1-LMO4,LMO4 作为转录调节因子亚家族 LMO中的一员是最后被发现的,其在细胞分化决定、组织形成、器官发育中起到了重要作用[1-4]。EMT是胚胎发育过程中出现转分化的基础,同时也是肿瘤细胞演进与迁移的基础,而LMO4的表达也集中在EMT活跃的区域,其可能参与了EMT中信号通路的调节,在肿瘤发生过程中发挥重要作用[5-6]。已有不少研究[7-12]发现在人类多种肿瘤中DLEC1均有异常表达,且体外实验也显示其可以抑制细胞聚集和生长,诱导细胞周期阻滞,在细胞生长过程中发挥负性调节作用[13]。刘艳华等[8-9]实验结果显示,DLEC1在肺癌中表达下调,且其表达与组织学类型、淋巴结转移等相关,提示DLEC1基因的失活与NSCLC的发生发展可能具有相关性。叶晓兵等[10]用甲基化特异性聚合酶链反应(MSP) 检测DLEC1基因在结直肠癌患者组织和血清中的甲基化状态,发现在CRC 组织和血清DNA 中,DLEC1 基因启动子甲基化比例均高于对照组,且组织和血清DNA中具有良好的一致性。数据显示,在CRC 患者中DLEC1 基因有着较高的检出率。至今尚未有关于LMO4、DLEC1与早期胃癌淋巴结微转移方面的文献,因此本研究通过免疫组织化学检测LMO4、DLEC1在早期胃癌中的表达情况。
经免疫组化染色,LMO4 蛋白细胞核呈棕黄色或者棕褐色,DLEC1 蛋白的细胞浆呈棕黄色或者棕褐色。实验结果显示,在50例早期胃癌中黏膜内癌、黏膜肌层癌、黏膜下癌的淋巴结转移率分别为9.1%、11.8%、40.9%;且高分化癌、中分化癌、低分化癌、印戒细胞癌淋巴结转移率分别为5.0%、15.4%、57.1%、33.3%,证实了淋巴结微转移与侵犯深度,与组织学类型有显著相关性。肿瘤浸润深度越深,恶性程度越高,淋巴结内转移的癌细胞数量可能就越多,提示淋巴管受侵犯情况与淋巴结微转移具有相关性[14]。早期胃癌组织中LMO4、DLEC1的表达与患者的年龄、性别均无关。LMO4与临床病理因素如浸润深度、淋巴结微转移、组织分化程度、肿瘤大小呈明显正相关,证实在早期胃癌中LMO4在有淋巴结微转移的病例中高表达,即 LMO4在有淋巴结微转移组中高表达,提示可能其参与了胃癌的转移侵袭。而DLEC1与浸润深度、淋巴结微转移、组织分化程度、肿瘤大小有较强的负相关性(P<0.05),在淋巴结微转移组的表达明显低于无淋巴结微转移组,提示DLEC1对临床预后判断具有重要意义。经Spearman等级相关性分析,LMO4 和 DLEC1 两者之间存在相关关系,呈负性相关。通过生存分析发现,早期胃癌患者的5年生存率为96.0%。分析结果显示,无微淋巴结转移的无瘤中位生存时间为38.8个月,高于微淋巴结转移组。说明淋巴结微转移可能造成淋巴结内以聚集形式出现癌细胞转移,进而向更远的淋巴结转移,影响患者的生存率。
综上所述, LMO4 及 DLEC1 基因与胃癌的发病机制和浸润转移有一定的相关性。联合检测两基因可能对胃癌的早期诊断及预后监测具有重要意义。
[1] 刘艳华,熊小亮.DLEC1基因的研究现状与进展〔J〕.临床与实验病理学杂志,2010,26(5):606-608.
[2] Kwong RA,Scarlett CJ,Kalish LH, et al.LMO4 expression in squamous cell carcinoma of the anterior tongue〔J〕.Histopathology,2011,58(3):477-480.
[3] Monta ez-Wiscovich ME,Shelton MD,Seachrist DD,et al.Aberrant expression of LMO4 induces centrosome amplification and mitotic spindle abnormalities in breast cancer cells〔J〕.J Pathol,2010,222(3):271-281.
[4] Murphy NC,Scarlett CJ,Kench JG,et al.Expression ofLMO4 and outcome in pancreatic ductal adenocarcinoma〔J〕.Br J Cancer,2008,98(3):537-541.
[5] 李静怡,申秀锦,邓 红.LM04调节肿瘤发生过程中的上皮-间质转化〔J〕.浙江大学学报(医学版),2011,40(1):107-111.
[6] Lu Z,Lam KS,Wang N,et al.LM04 can interact with Smad proteins and modulate transforming growth factor-B signaling in epithelial cells〔J〕.Oncogene,2006,25(20):2920-2930.
[7] Seng TJ, Currey N, Cooper WA, et al. DLEC1 and MLH1 promoter methylation are associated with poor prognosis in non-small cell lung carcinoma〔J〕.Br J Cancer,2008,99(2):375-382.
[8] 刘艳华, 罗达亚, 艾有生,等.非小细胞肺癌中DLEC1与Ki-67的表达及意义〔J〕.广东医学,2010,31(12):1585-1587.
[9] 刘艳华, 罗达亚, 艾有生,等.非小细胞肺癌中DLEC1的表达缺失与临床病理因素的相关研究〔J〕.实用医学杂志,2010,26(16):2898-2901.
[10] 叶晓兵,张有为,陈龙邦.DLEC1 基因在结直肠癌中的甲基化水平及临床意义〔J〕.第二军医大学学报,2010,31(8):842-845.
[11] Fujimura T,Tsukada T,Kinoshita J,et al.Lymph node micrometastases in gastric cancer〔J〕.Nihon Geka Gakkai Zasshi,2013,114(1):13-16.
[12] Arigami T,Uenosono Y,Yanagita S,et al.Clinical significance of lymph node micrometastasis in gastric cancer〔J〕.Ann Surg Oncol,2013,20(2):515-521.
[13] Yano K,Nimura H,Mitsumori N,et al.The efficiency of micrometastasis by sentinel node navigation surgery using indocyanine green and infrared ray laparoscopy system for gastric cancer〔J〕.Gastric Cancer,2012,15(3):287-291.
[14] 陈焕年,王荣朝,王 勍.早期胃癌前哨淋巴结微转移临床分析〔J〕.江苏医药,2011,37(1):77-79.
