人端粒酶逆转录酶siRNA诱导宫颈鳞癌耐药细胞株SiHa/DDP凋亡的分子机制研究
2014-09-13陈金石李隆玉
王 艺 陈金石 李隆玉 李 凌
宫颈癌是常见的妇科恶性肿瘤,其中宫颈鳞癌约占80%~90%。虽然目前对于宫颈鳞癌的治疗效果取得了显著进步,但晚期及复发性宫颈鳞癌患者治疗效果及预后却不够理想。随着恶性肿瘤多学科综合治疗模式的转变,基因治疗倍受瞩目。因此,探索宫颈鳞癌基因治疗具有重大意义。本研究将hTERT SiRNA导入耐药宫颈鳞癌SiHa/DDP细胞株后,采用实时荧光定量PCR检测hTERT mRNA含量、流式细胞仪检测细胞凋亡、MTT法检测细胞凋亡变化,并将研究结果报告如下。
1 材料与方法
1.1 材料
宫颈鳞癌耐药细胞株SiHa/DDP:由四川大学华西第二医院西部妇幼医学研究院遗传实验室刘珊玲教授惠赠。hTERT SiRNA由Invitrogen公司构建。
1.2 方法
1.2.1 引物设计和合成 目的基因hTERT及内参照基因的PCR引物采用Primer5引物设计软件,并经GeneBank Blast进行同源性比较,确定其特异性,引物序列:hTERT上游引物,5’-GAGTCAACGGATTTGGTCGT-3’;下游引物,5’-CCTTGTCGCCTGAGGAGTAG-3’;GAPDH上游引物,5’-CGTGGTTTCTGTGTGGTGTC-3’;下游引物,5’-CCTTGTCGCCTGAGGAGTAG-3’。由上海英俊生物技术有限公司合成。
1.2.2 细胞实验分组 实验分为4组:空白对照组(A组),脂质体对照组(B组),Negative Control siRNA对照组(C组),转染组(D组)[hTERT SiRNA与脂质体混合液转染SiHa/DDP细胞组(荧光定量PCR检测各组细胞hTERT mRNA实验时,该组有SiRNA-1、SiRNA-2、SiRNA-3 3小组)]。不同时间点收集各组细胞进行相关检测,重复3次,每个指标检测设置3复孔。
1.2.3 SiHa/DDP细胞培养 培养瓶含有10%胎牛血清的DMEM培养液,每毫升加2微克顺铂的混合液,置37 ℃、5% CO2细胞培养箱中常规培养。
1.2.4 设计并化学合成hTERT siRNA 根据Genebank中的hTERT基因序列,遵守siRNA设计原则并参考相关文献,设计了三对长度均为21bp的siRNA链,并由美国Invitrogen公司上海分部协助合成,Negative Control siRNA正义链,5’-AUCUUGUAGAUGUUGGUGCTT-3’;反义链,5’-AUCUUGUAGAUGUUGGUGCTT-3’。SiRNA-1正义链,5’-GGAGCAAGUUGCAAAGCAUTT-3’;反义链,5’-AUGCUUUGCAACUUGCUCCTT-3’。SiRNA-2正义链,5’-GGAACACCAAGAAGUUCAUTT-3’;反义链,5’-AUGAACUUCUUGGUGUUCCTT-3’。SiRNA-3正义链,5’-GCACCAACAUCUACAAGAUTT-3’;反义链,5’-AUCUUGUAGAUGUUGGUGCTT-3’。序列经检索证实与其它基因无同源性,siRNA带有绿色荧光蛋白作标记。
1.2.5 hTERT SiRNA转染SiHa/DDP细胞 实验步骤如下:①种板:转染前一天,以(4~6)×105/孔的密度将细胞转种到6孔板中,加入1 ml无抗生素培养基,并保证转染时的细胞密度为70%~85%。② hTERT siRNA和脂质体的配置:依照转染试剂说明书,转染当天用EP管把干粉装10 OD siRNA离心→加300 μlDEPC水(获得10 μM浓度siRNA300 μl,此时10 μlsiRNA溶液含siRNA100 pmol)→加120 μl ployfectine转染试剂轻轻摇晃混匀,室温静置15 min。③孵育siRNA脂质体溶液同时用无血清培养基洗涤待转染的细胞3次,然后于每孔中加入1.0 ml无血清培养基培养。siRNA脂质体溶液孵育15 min后,转移至6孔板中,轻轻摇动,置培养箱孵育5 h后更换完全培养基。24 h后取出6孔板,在荧光显微镜下观察绿色荧光蛋白估计转染效率,选择荧光监测效果明显的处理孔完成后面实验。
1.3 hTERT mRNA含量检测
试剂盒购于美国Invitrogen公司,具体操作按试剂盒说明书进行,实验过程:总RNA的提取,然后去除基因组DNA,再行逆转录,然后采用Real-time PCR检测hTERT mRNA含量,本实验设计了三对长度均为21bp的siRNA链 转染细胞,并检测各转染组hTERT mRNA表达,然后选取对hTERT mRNA表达抑制效果最明显的siRNA链(siRNA-1)进行后续实验。
1.4 流式细胞术检测细胞凋亡
取转染后的细胞用不含EDTA的0.25%胰酶消化制备成单细胞悬液,将细胞分散于200 ml的PBS缓冲液中,用4 ℃预冷的PBS分别洗涤待检测细胞两次,用吸管吸尽PBS。加入2 ml预冷的70%乙醇,4 ℃固定细胞抗原;250 μL Binding Buffer重悬细胞,转移悬液至EP管,用100 μL Binding Buffer充分润洗六孔板残留细胞,转移至EP管,往EP管加入5 μL AnnexinV-FITC和10 μL 20 μg/mL的PI,混匀后避光,室温反应20 min,加PBS400 μL稀释细胞,调整细胞浓度为(5~6)×105/ml,应用流式细胞仪检测分析,通过软件分析细胞凋亡率。
1.5 MTT法检测hTERT SiRNA转染后SiHa/DDP细胞生长抑制变化
选取贴壁80%~90%的六孔板,消化。各处理组细胞悬液分别以100 μL接种于96孔平底细胞培养板,每个浓度设3个复孔;同时设调零孔和细胞对照孔。将96孔细胞培养板置于培养箱。于24 h、48 h、72 h 3个时间,于每孔加入5 mg/mL的MTT 20 μL,继续培养4 h后弃上清,于每孔中加入200 μL DMSO终止反应。室温下置于摇床振荡10 min,结晶物充分溶解后应用酶标仪检测OD值。应用作图软件OD值为纵坐标,以时间(h)为横坐标绘制生长抑制曲线,观测hTERT siRNA对宫颈癌耐药细胞株SiHa/DDP的生长抑制效果。
1.6 结果判定
转染24 h、48 h、72 h后提取各处理组细胞总RNA,进行逆转录,并通过实时荧光定量PCR进行定量分析,由系统自动记录荧光曲线并分析计算出Ct值。计算方式:△Ct=Ct(hTERT)-Ct(hGAPDH),△△Ct =(样品Ct值-内参照Ct值)-(对照组样品Ct值-对照组内参照Ct值),然后取2-△△Ct代表被检样品初始hTERT mRNA含量。MTT设置酶标仪490 nm波长处检测细胞OD值。
1.7 统计学分析
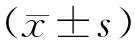
2 结果
2.1 观察荧光细胞
荧光显微镜下观察,未转染的细胞无荧光,而转染的SiHa/DDP细胞可见有绿色荧光。
2.2 转染后hTERT mRNA表达水平的检测
2.2.1 不同siRNA对SiHa/DDP细胞hTERT表达水平的抑制作用 hTERT siRNA转染SiHa/DDP细胞24 h后,实时荧光定量PCR检测各组细胞hTERT mRNA,结果siRNA-1、siRNA-2和SiRNA-3转染组细胞的hTERT mRNA表达量均显著下降:设定空白对照组为1,其各组细胞hTERT mRNA相对表达量(即拷贝数与内参基因拷贝数比值)均值分别为:SiRNA-1组(0.249±0.019)、SiRNA-2组(0.273±0.028)、SiRNA-3组(0.350±0.017)、Negative Control siRNA组(0.931±0.036)、脂质体对照组(0.956±0.052)(图1)。单因素方差分析结果显示:SiRNA-1组、SiRNA-2组、SiRNA-3组hTERT mRNA相对表达量分别与Negative Control siRNA组、脂质体组及空白对照组比较差异有统计学意义(P<0.05)。SiRNA-1组hTERT mRNA相对表达量与SiRNA-2组、SiRNA-3组相互比较差异无统计学意义(P>0.05);Negative Control siRNA组、脂质体对照组及空白对照组相互比较差异无统计学意义(P>0.05)。可见SiRNA-1组、SiRNA-2组、SiRNA-3组hTERT mRNA相对表达量较各未转染对照组均明显下降,说明3个构建的SiRNA片段均有良好抑制效果,三组片段间无明显差异,选取对hTERT mRNA表达抑制效果最强的siRNA-1进行后续实验。

图1 转染24 h后转染组及各对照组hTERT mRNA相对表达量
2.2.2 siRNA-1对SiHa/DDP细胞hTERT表达水平的抑制作用 转染48 h及72 h后继续检测siRNA-1转染组、Negative Control siRNA组、脂质体组及空白对照组hTERT mRNA含量。同理用2-△△Ct公式计算被检样品hTERT mRNA含量,其他各组细胞hTERT mRNA相对表达量均值与空白对照组比较,48 h分别为:siRNA-1组(0.138±0.009),Negative Control siRNA组(0.940±0.025),脂质体组(0.961±0.037),siRNA-1组hTERT mRNA相对表达量与各对照组比较差异有统计学意义(P<0.01)。72 h分别为:siRNA-1组(0.174±0.016),Negative Control siRNA组(0.901±0.042),脂质体组(0.943±0.28);siRNA-1组hTERT mRNA相对表达量与各对照组比较差异有统计学意义(P<0.01)。可见siRNA-1转染组细胞的hTERT mRNA表达量下降显著,见图2。
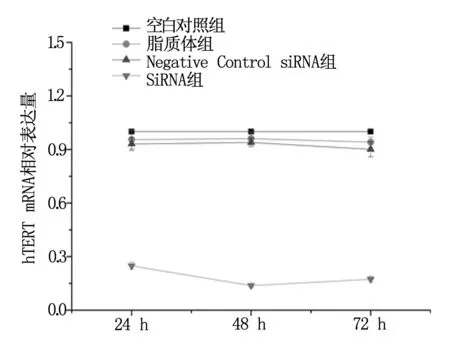
图2 siRNA-1组及对照组hTERT mRNA相对表达量
2.3 流式细胞术检测细胞凋亡
凋亡率=早期凋亡率+晚期凋亡率。转染24 h后hTRET siRNA转染组凋亡率为(75.83±2.18)%,与A组[(0.18±0.07)%]比较有显著差异,而转染48 h时转染组凋亡率增高至(86.48±7.18)%,转染72 h凋亡率较48 h下降(83.41±5.81)%。比较转染24 h各组早期细胞凋亡率:siRNA-1组[(75.83±2.18)%]明显高于C组[(2.11±0.08)%]、B组[(0.32±1.22)%]和A组[(0.18±0.07)%],差异均有统计学意义(P<0.05);hTRET siRNA转染组坏死细胞和晚期细胞凋亡率[(18.02±2.71)%]同样明显高于C组[(2.03±0.10)%]、B组[(0.36±1.02)%]和A组[(0.08±0.02)%],差异均有统计学意义(P<0.05)。
2.4 MTT法检测hTERT SiRNA转染后SiHa/DDP细胞生长曲线
转染24 h、48 h、72 h后分别采用MTT比色法检测各组SiHa/DDP细胞OD490均值:siRNA-1组分别为(0.103±0.006)、(0.080±0.004)、(0.032±0.0006);空白细胞对照组分别为(0.118±0.008)、(0.151±0.005)、(0.190±0.003);脂质体对照组分别为(0.111±0.006)、(0.143±0.003)、(0.179±0.001),Negative Control siRNA对照组分别为(0.110±0.004)、(0.127±0.004)、(0.168±0.005);同一时间点各组OD490均值单因素方差分析比较,siRNA-1组明显低于其余3组,差异具有统计学意义(P<0.05)。以OD490均值为纵坐标,时间为横坐标绘制细胞生长曲线,见图3。
3 讨论
端粒酶是1种RNA蛋白复合体,由三个部分组成:端粒酶自身RNA模板、端粒酶逆转录酶(TRET)、端粒酶相关蛋白,其以自身的RNA为模板合成端粒重复序列使端粒长度得以维持[1],而人端粒酶逆转录酶(telomerase reverse transcriptase,hTERT)是其活性表达的关键组份和限速因子[2]。端粒的主要功能是在染色体末端形成帽子结构,使染色体不会随着复制后RNA引物的降解而缩短,也使染色体末端无有害融合,从而维持染色体结构的稳定性和完整性。Zheng等[3]研究发现宫颈病变时端粒酶被激活,宫颈上皮内瘤变(CIN)时即可检测到端粒酶的表达,而宫颈癌时激活程度更高,发现端粒酶激活概率随宫颈癌病变进展而升高,并认为TERC基因扩增检测可以提供一个有效的非侵入性的方法用来评估鉴别宫颈疾病病变级别高低。Jin等[4]采用液基薄层原位杂交(FISH)细胞病理学检查和检测扩增的荧光在130多名妇女进行人类乳头状瘤病毒DNA 检测、阴道镜活检和组织病理学检查。结果人类乳头状瘤病毒DNA 检测、阴道镜活检和组织病理学检查均显示在宫颈高度鳞状上皮病变患者中hTERC基因扩增率高于宫颈高度鳞状上皮病变患者。并认为FISH检测hTERC基因扩增可能是区分低级别和高级别的宫颈鳞状细胞疾病的诊断的一种有效的辅助细胞学或病理学检查。多数学者认为,在宫颈癌组织中hTERT mRNA高表达与端粒酶激活关系密切,对宫颈脱落细胞进行端粒酶活性检测或hTERT mRNA异常高水平表达,既可当作早期诊断宫颈癌的一个标志,还可以辅助判断宫颈病变级别高低。
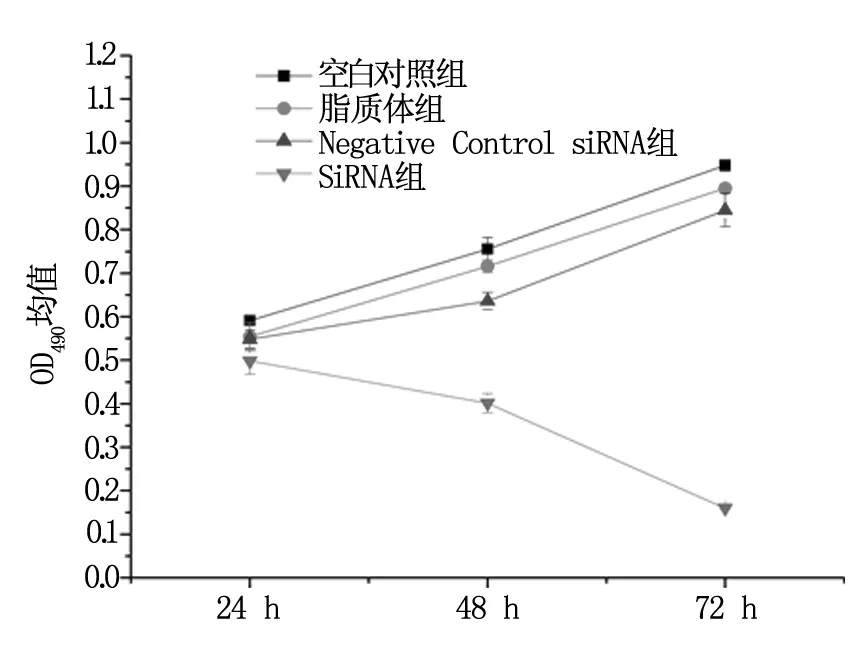
图3 hTRET SiRNA-1对SiHa/DDP细胞体外增殖的抑制作用
我们先期有相关研究[5]针对江西省2499例30~49岁农村妇女进行了以病理为金标准的宫颈癌筛查发现在CINⅡ及以上病变hTERC基因扩增明显;且随着宫颈病变程度的增加,hTERC基因表达率增加。由此可见,hTERC基因异常的染色体不稳定性与宫颈癌的发生关系密切。可见hTERT与宫颈癌密切关系,但通过hTERT SiRNA手段对宫颈鳞癌细胞凋亡实际效果的细胞及分子水平的研究报道较少。hTERT作为端粒酶的关键组分维持端粒长度,能直接参与肿瘤细胞增殖和生长的调控,它的表达受多个水平多个因子精密调控,与宫颈鳞癌的临床病理指标具有相关性,是宫颈癌基因干扰实验的良好靶基因。通过有效siRNA片段抑制hTERT表达能抑制细胞生长增殖并促进凋亡,至于siRNA转入细胞后作用场所这点目前尚无定论,有研究支持是在细胞核内作用[6],有研究认为其限于在细胞浆作用[7],具体明确还待进一步研究。
靶向RNA干扰对肿瘤的端粒酶的抑制作用是一个多阶段、多因素的复杂过程,目前端粒酶分子机制尚未被完全明确。此外,端粒的延长也还存在着不依靠端粒端粒酶活性的方式。因此可以推测不可能所有类型的肿瘤对端粒酶抑制剂产生良好的抑制反应。而且在细胞周期的不同阶段的端粒酶活性各不相同,如何在不同的阶段的肿瘤细胞进行有针对性的抗端粒酶治疗,这也仍然是一个问题。已有的靶向治疗端粒酶研究多针对体外各种细胞系的,动物模型研究相对缺乏,因此建立合适的动物模型进行研究是一个迫切的问题。目前的RNAi靶向端粒酶大部分主要是抑制端粒酶的单个组件,因此这不可能完全抑制或逆转肿瘤的生长,随后的RNA干扰技术的研究应该考虑利用同一基因家族的多个基因有的同源片段,因为此片段有高度保守的特性,所以如果成功设计出有效的同源序列的siRNA分子片段,则有可能实现在同一时间较强效果地除去各期端粒酶活性。即便如此,RNA干扰技术在肿瘤基因靶向治疗完全抑制端粒酶活性的实际临床应用仍然有很多目前尚未解决的难题。虽然目前有多种siRNA的体内递送方法,但它们应用于人体临床治疗的安全性仍然是一个重大的问题。
[1] Masaharu A,Osamu Y,Naotoshi K,et a1.Telonlerase overelpression in K562 leukemia cells protects against apoptosis by serum deprivation and double-slranded DNA break inducing agents,but not against DNA synthesis inhibitors〔J〕.Cancer Lett,2002,178(2):187-197.
[2] Massaki S,Fumihiko K,Hisashi H,et al.Detection of telomerase activity,telomerase RNA component,and telomerase reverse transcriptase in human hepatocellular carcinoma〔J〕.Science,2004,29(1):31-38.
[3] Tu Z,Zhang A,Wu R,et al.Genomic amplification of the human telomerase RNA gene for differential diagnosis of cervical disorders〔J〕.Cancer Genet Cytogenet,2009,191(1):10-16.
[4] Jin Y,Jia-Ping L,Dan H,et al.Clinical Significance of Human Telomerase RNA Gene (hTERC) Amplification in Cervical Squamous Cell Lesions Detected by Fluorescence in Situ Hybridization〔J〕.Asian Pac J Cancer Prev,2011,12(5):1167-1171.
[5] 李 凌,江 维,李隆玉,等.荧光原位杂交技术检测hTERC基因预测宫颈上皮内瘤样病变1级自然转归的前瞻性研究〔J〕.中国肿瘤临床,2013,40(1):25-28.
[6] Jose Emesto B,Dayson Friaca M.RNA interference against human cancers:a perspective〔J〕.Applied Cancer Res,2009,29(4):512-514.
[7] Zhongji M,Song Q,Xiaoyong Z,et al.Inhibition of woodchuck hepatitis virus gene expression in primary hepatocytes by siRNA enhances the cellular gene expression〔J〕.RNA,2009,384(1):88-96.
