乳源金黄色葡萄球菌9种肠毒素基因的检测*
2014-05-31谢秀兰刘溪源王建东范春梅康晓冬
谢秀兰,刘溪源,王建东,范春梅,康晓冬*,薛 伟
(1.宁夏农林科学院草畜工程技术研究中心,宁夏银川 750002;2.宁夏大学农学院,宁夏银川 750021;3.宁夏银川市金凤区农牧水务局,宁夏银川 750002)
乳源金黄色葡萄球菌9种肠毒素基因的检测*
谢秀兰1,刘溪源2,王建东1,范春梅3,康晓冬1*,薛 伟1
(1.宁夏农林科学院草畜工程技术研究中心,宁夏银川 750002;2.宁夏大学农学院,宁夏银川 750021;3.宁夏银川市金凤区农牧水务局,宁夏银川 750002)
为比较临床型和隐性奶牛乳房炎金黄色葡萄球菌肠毒素基因的分布差异,采用PCR方法对70株临床乳房炎和55株隐性乳房炎金黄色葡萄球菌(SA)菌株进行9种肠毒素基因的检测。结果表明,在临床乳房炎SA中,肠毒素基因的携带率为65.7%,各型肠毒素基因的检出率分别为SEA 12.9%(9株)、SEE 4.3%(3株)、SEI 60.0%(42株),没有检出 SEB、SEC、SED、SEG、SEH、SEJ,携带1种肠毒素基因的占55.7%(38株),同时携带2种及以上肠毒素基因的占11.4%(8株);在隐性乳房炎SA中,肠毒素基因的携带率为89.1%,各型肠毒素基因的检出率分别为 SEA 10.9%(6株)、SEB 25.5%(14株)、SEC 7.3%(4株)、SED 5.5%(3 株)、SEE 25.5%(14株)、SEG 47.3%(26株)、SEH 29.1%(16株)、SEI 10.9%(6株)、SEJ 32.7%(18株)。其中携带1种肠毒素基因的占29.1%(16株),同时携带2种及以上肠毒素基因的占60.0%(33株)。结果表明,奶牛乳房炎SA菌株中,肠毒素基因的携带率很高,在临床型乳房炎中以SEI为主,而隐性乳房炎中,肠毒素基因检出率更高、肠毒素基因种类更多,组合型也更复杂。
奶牛;乳房炎;金黄色葡萄球菌;肠毒素;聚合酶链反应
金黄色葡萄球菌(Staphylococcusaureus,SA)是引起奶牛乳房炎的最主要病原菌之一,可引起奶牛临床和隐性乳房炎,携带有金黄色葡萄球菌的奶牛可直接污染奶源,给奶牛场带来很大的经济损失[1]。金黄色葡萄球菌的致病力强弱主要取决于其产生的毒素和侵袭性酶,包括肠毒素(Staphylococcal enterotoxins,SE)、溶血毒素、杀白细胞素(paton-valentine leukocidin,PVL)、血浆凝固酶等。肠素素是其中起主要作用的致病因子,具有多个基因型,它是由一组结构相关、毒力相似、抗原性不同的细胞外蛋白组成,除了SEA、SEB、SEC、SED、SEE 5种传统的血清型外,还发现了SEG、SEH、SEI、SEJ等新型的肠毒素[2-4]。本研究以PCR技术为基础,对宁夏部分地区奶牛场的临床和隐性乳房炎金黄色葡萄球菌的9种肠毒素基因进行检测,为该地区奶牛及其产品的安全评估提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株 70株临床型乳房炎金黄色葡萄球菌菌株,55株隐性乳房炎金黄色葡萄球菌菌株分离自宁夏吴忠、石嘴山和灵武奶牛养殖园区,由本实验室保存。金黄色葡萄球菌(ATCC29213)菌株,由中国兽药监察所提供。
1.1.2 主要试剂 溶菌酶、细菌基因组DNA提取试剂盒、Master PCR Mix、DNA Marker DL 2 000为北京天根生物技术有限公司产品;PCR引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 基因组DNA的提取 采用细菌基因组DNA提取试剂盒提取金黄色葡萄球菌的DNA,具体操作步骤按说明书进行,提取的基因组DNA溶于80μL TE溶液中,置-20℃保存。
1.2.2 PCR检测nuc基因 由于一些非金黄色葡萄球菌菌株可能会产生活性很高的假凝固酶,从而导致假阳性,所以本研究采用PCR技术扩增耐热核酸酶基因(nuc)的方法[5]对所有SA菌株进一步验证,以减少假阳性,引物序列见表1。PCR扩增执行以下程序:以提取的DNA为模板,使用一管便捷式PCR扩增试剂盒,反应体系25μL,体系内各组分按说明书加样。PCR反应条件:94℃,3min;94℃1min,55℃30s,72 ℃1.5min,35个循环;72 ℃3.5min,12℃结束反应。

表1 nuc基因引物序列Table 1 The primer sequences of nuc gene
1.2.3 9种肠毒素基因PCR引物的设计与PCR扩增 根据刘继超等[6]报道进行 SEA、SEB、SEC、SED、SEE、SEH基因的引物合成和扩增条件,根据Peles F等[7]报道进行SEG、SEI、SEJ基因的引物合成和扩增条件。为减少干扰,每种肠毒素基因均单独进行检测,引物序列见表2。9种肠毒素基因的PCR扩增均执行以下反应体系:以提取的DNA为模板,使用一管便捷式PCR扩增试剂盒,反应体系25μL,体系内各组分按说明书加样。SEA、SEB、SEC、SED、SEE、SHE基因的PCR扩增条件:94℃4min;94℃1min,48℃45s,72℃1min,35个循环;72℃10min,12℃结束反应。SEG、SEI、SEJ基
因的PCR扩增条件:94℃4min;94℃1min,56℃50s,72℃1min,35个循环;72℃10min,12℃结束反应。
1.2.4 电泳 PCR产物进行琼脂糖凝胶电泳,凝胶浓度为15g/L,利用标准DNA Marker,观察电泳完成后的扩增片段,并统计结果。
2 结果
2.1 PCR验证结果
对SA菌株的nuc基因PCR检测结果表明,70株临床型乳房炎SA菌株,55株隐性型乳房炎SA菌株的均为nuc基因阳性。部分SA菌株的PCR鉴定结果见图1。

表2 9种肠毒素基因PCR扩增引物Table 2 The primers of 9staphylococcal enterotoxin genes
图1 nuc基因PCR产物电泳图Fig.1 Electrophoresis of nuc gene PCR products
2.2 肠毒素基因的PCR检测结果
通过对125株金黄色葡萄球菌的PCR检测,检出了 SEA、SEB、SEC、SED、SEE、SEH、SEG、SEI、SEJ 9种肠毒素基因。扩增片段大小如图2所示,分别为120、478、257、319、170、375、704、630、142bp。

图2 9种肠毒素基因PCR扩增产物电泳图Fig.2 Electrophoresis of PCR products of 9enterotoxin genes
2.3 肠毒素基因的分布
在70株临床乳房炎SA菌株中,9种肠毒素基因的携带率为65.7%,在隐性乳房炎SA菌株中,9种肠毒素基因的携带率为89.1%。各种肠毒素基因的检出情况见表3。由表3可见,在临床乳房炎SA菌株中,SEI的检出率最高,没有检测到SEB、SEC、SED、SEH、SEG、SEJ基因。在隐性乳房炎SA菌株中,SEG、SEJ、SHE的检出率最高,9种肠毒素都有检出。各种肠毒素基因的组合流行情况见表4,临床型乳房炎SA菌株中,携带1种肠毒素基因的有38株(54.3%),2种的有8株(11.4%);隐性乳房炎SA菌株中,携带1种肠毒素基因的有16株(29.1%),2种及以上的有33株(60.0%),其中同时携带2种的有15株(27.3%),同时携带 3种的有12株(21.8%),同时携带4种的有5株(9.1%),同时携带5种的有1株(1.8%)。
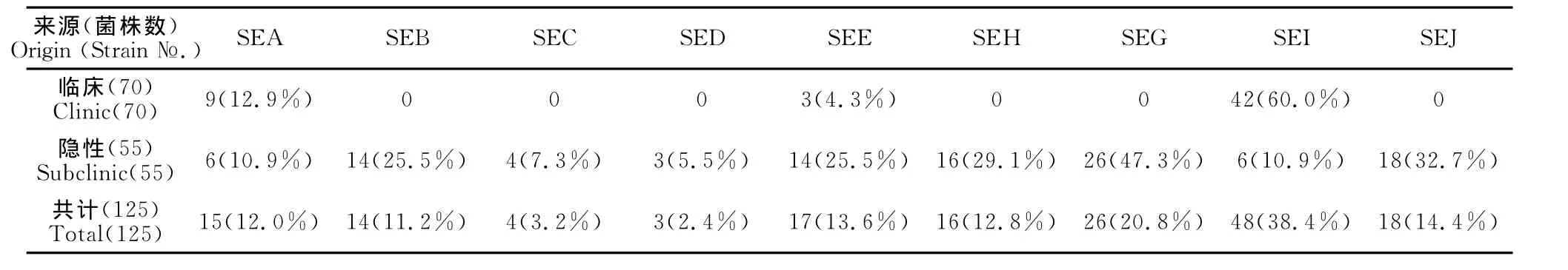
表3 奶牛乳房炎金黄色葡萄球菌菌株肠毒素基因分布Table 3 Distribution of enterotoxins genes of S.aureus from bovine mastitis
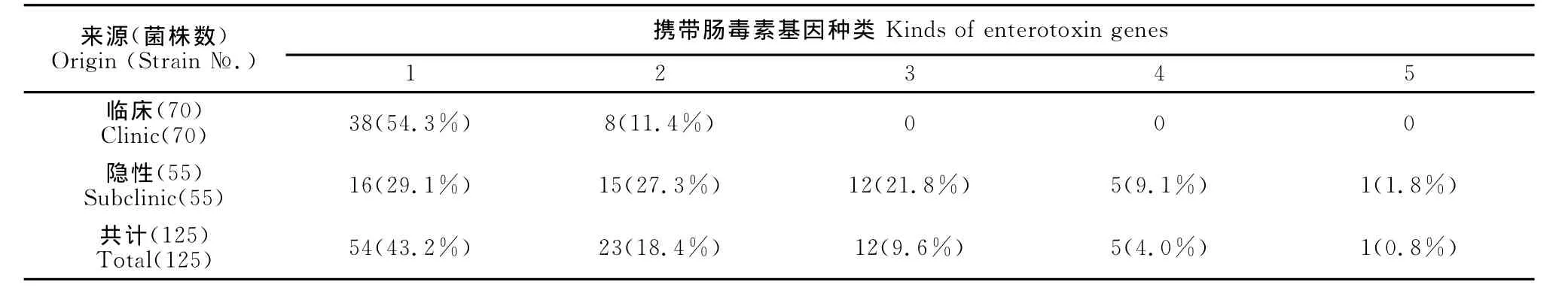
表4 肠毒素基因的组合流行情况Table 4 Combination epidemics of S.aureus enterotoxin genes
3 讨论
研究所用的125株SA菌株分离自宁夏吴忠、石嘴山、灵武大型奶牛养殖园区,对其肠毒素基因的研究,可为宁夏地区奶牛及其产品的安全评估提供一定理论依据。
研究结果表明,临床型和隐性型乳房炎肠毒素基因的携带率分别为65.7%和92.7%。而国内王新等[8]报道的临床型和隐性型乳房炎奶牛金黄色葡萄球菌肠毒素基因的阳性比例分别为34.6%和7.0%,马保臣等[9]报道的临床型乳房炎27.42%和隐性型乳房炎1.41%,夏胜超等[10]报道的临床型乳房炎31.3%和隐性型乳房炎47.1%,张静等[11]报道临床型乳房炎的检出率为77.19%,国外报道肠毒素基因检出率在4%~67%[3-4,12],说明奶牛乳房炎金黄色葡萄球菌肠毒素基因的流行病学可能存在地域相关性,同时研究结果表明宁夏地区的奶牛场存在着很大的安全隐患,尤其是隐性乳房炎携带的肠毒素基因更多,揭示了乳及乳制品从来源到成品都存在很大的安全风险。
此外,临床型乳房炎中,肠素素基因携带率最高的是SEI基因(42株,60.0%),这一结果与国内外大多数学者的研究结果相似。此外,研究结果发现,临床型乳房炎和隐性乳房炎中都含有一定量的含有2个或2个以上基因型的肠毒素基因,但其中隐性乳房炎金黄色葡萄球菌菌株携带的肠毒素基因检出率更高,肠毒素基因种类更多,组合型也更复杂,其原因尚不清楚。
[1]王桂琴,杨萌萌,邢 燕,等.宁夏地区奶牛乳房炎金黄色葡萄球菌耐药性分析[J].动物医学进展,2011,32(10):59-62.
[2]Rall V L,Vieira F P,Rall R,et al.PCR detection of staphylococcal enterotoxin genes inStaphylococcusaureusstrains isolated from raw and pasteurized milk[J].Vet Microbiol,2008,132(3-4):408-413.
[3]Besime G,Aslantas O,Demir C.Detection of superantigenic toxin genes inStaphylococcusaureusstrains from subclinical bovine mastitis[J].Tropical Animal Health and Production,2011,43(8):1633-1637.
[4]Boynukara B,Gulhan T,Alisarli M,et al.Classical enterotoxi-genic characteristics ofStaphylococcusaureusstrains isolated from bovine subclinical mastitis in Van,Turkey[J].Int J Food Microbiol,2008,125(2):209-211.
[5]Brakstad O G,Aasbakk K,Maeland J A.Detection ofStaphylococcusaureusby polymerase chain reaction amplification of the nuc gene[J].Clin Microbiol,1992,30(7):1654-1660.
[6]刘继超,姜铁民,姜阿赤,等.多重PCR检测金黄色葡萄球菌六型肠毒素基因的研究[J].食品科技,2012,37(6):304-307.
[7]Peles F,Wagner M,Varga L,et al.Characterization ofStaphylococcusaureusstains isolated from bovine milk in Hungary[J].Int J Food Microbiol,2007,118(2):186-193.
[8]王 新,韦艺媛,张 静,等.乳房炎奶牛金黄色葡萄球菌毒素基因的检测及PFGE分型研究[J].畜牧兽医学报,2011,42(7):974-980.
[9]马保臣,柴同杰,秦卓明,等.用PCR与ELISA、RPLA对照检测乳腺炎金黄色葡萄球菌肠毒素和毒素休克综合征毒素-1[J].中国兽医学报,2008,28(8):901-905.
[10]夏胜超,吴聪明,王绍琛,等.奶牛乳房炎病例中金黄色葡萄球菌毒素基因的检测[J].中国兽医杂志,2007,43(4):23-24.
[11]张 静,于三科,王 新,等.原料乳和临床乳房炎金黄色葡萄球菌毒力基因检测及药敏分析[J].中国兽医学报,2012,32(5):759-770.
[12]Sahebekhtiari N,Nochi Z,Eslampour M A,et al.Characterization ofStaphylococcusaureusstrains isolated from raw milk of bovine subclinical mastitis in Tehran and Mashhad[J].Acta Microbiologica et Immunologica Hungarica,2011,58(2):113-121.
Detection of 9 Enterotoxin Genes inStaphylococcusaureusFrom Milk of Cows with Mastitis
XIE Xiu-lan1,LIU Xi-yuan2,WANG Jian-dong1,FAN Chun-mei3,KANG Xiao-dong1,XUE Wei1
(1.ResearchCenterofGrassandLivestock,NingxiaAcademyofAgricultureandForestrySciences,Yinchuan,Ningxia,750002,China;2.AgriculturalCollege,NingxiaUniversity,Yinchuan,Ningxia,750002,China;3.JinfengBureauofAgriculture,WaterandAnimalHusbandry,Yinchuan,Ningxia,750002,China)
The aim of this study was to compare the difference of occurrence of 9enterotoxin genes inStatphylococcusaureusrecovered from milk of cows with clinical or subclinical mastitis.70and 55S.aureusstrains from cows with clinical and subclinical mastitis were isolated,respectively,and 9enterotoxin genes were tested by using PCR method.The results showed that an overall of 65.7%isolates from cows with cinical mastitis carried enterotoxin genes,and the detection rates of SEA,SEE and SEI were 12.9% (9 isolates),4.3%(3isolates)and 60.0%(42isolates),respectively.Among these isolates,55.7% (38isolates)of them possessed one type of enterotoxin gene,while 11.4% (8isolates)of them possessed more than two gens.For isolates from cows with subclinical mastitis,89.1%of them carried enterotoxin genes,and the detection rates of SEA,SEB,SEC,SED,SEE,SEG,SEH,SEI and SEJ were 10.9% (6isolates),25.5%(14isolates),7.3%(4isolates),5.5%(3isolates),25.5%(14isolates),47.3% (26isolates),29.1% (16isolates),10.9% (6isolates)and 32.7% (18isolates),respectively.Among these isolates,29.1% (16isolates)of them possessed one type of enterotoxin gene,while 60.0% (33isolates)of them possessed more than two gens.Our results indicated that enterotoxin genes were wildly distributed in mastitis-relatedS.aureusstrains.It is also suggested that inS.aureusstrains related with clinical mastitis,SEI was the prominent enterotoxin,while in strains related with subclinical mastitis,more types and more complex of enterotoxin genes were presented.
cow;mastitis;Statphylococcusaureus;enterotoxin;polymerase chain reaction(PCR)
S852.611
A
1007-5038(2014)07-0025-04
2013-12-30
宁夏自然科学基金项目(NZ12255)
谢秀兰(1980-),女,宁夏平罗人,助理研究员,硕士,主要从事动物病原分子生物学研究。* 通讯作者
