猪A群轮状病毒VP6的表达及IgG抗体ELISA检测方法的建立与初步应用
2014-05-31陈淑华库旭钢闫贵伟丁振江何启盖
陈淑华,库旭钢,闫贵伟,丁振江,何启盖*
(1.农业微生物学国家重点实验室,湖北武汉 430070;2.华中农业大学动物医学院,湖北武汉 430070)
猪A群轮状病毒VP6的表达及IgG抗体ELISA检测方法的建立与初步应用
陈淑华1,2,库旭钢1,2,闫贵伟1,2,丁振江1,2,何启盖1,2*
(1.农业微生物学国家重点实验室,湖北武汉 430070;2.华中农业大学动物医学院,湖北武汉 430070)
为建立猪A群轮状病毒抗体间接ELISA检测方法,用于开展对该病毒感染的流行病学调查和免疫抗体评估,进行了猪A群轮状病毒TM-a株内衣壳VP6基因的表达,用SDS-PAGE和Western blot鉴定分析。目的蛋白得到表达,大小约70ku,Western blot表明,该蛋白与猪A群轮状病毒阳性血清反应。用该蛋白作为包被抗原,通过对条件优化,包被抗原浓度为2μg/mL,待检血清稀释倍数为1∶40倍,标记抗体的稀释倍数为1∶4 000倍,建立了检测猪轮状病毒血清IgG抗体的间接ELISA方法。用该方法检测临床样品142份,并与间接免疫荧光试验(IFA)对比,结果显示,两者阳性符合率为94.6%,阴性符合率为83.4%,总符合率为91.5%,表明该方法有效可行。用建立的方法检测临床上不同年龄阶段的猪血清639份,分析其临床感染情况。结果证明该方法可用于猪轮状病毒流行病学调查、猪群抗体水平评估。
猪轮状病毒;内衣壳蛋白;间接ELISA
轮状病毒(Rotavirus,RV)属呼肠病毒科轮状病毒属,是引起婴幼儿和幼龄动物腹泻的一种病原[1],感染猪轮状病毒(Porcine rotavirus,PoRV)的仔猪以厌食、呕吐、腹泻和脱水为主要临床特征,严重的排水样粪便,导致仔猪死亡[2]。在全国发生大规模的仔猪病毒性腹泻,给养猪业带来巨大的经济损失,猪轮状病毒也是引起仔猪腹泻的重要病原之一[3]。
轮状病毒基因组由11个dsRNA片段组成,分别编码病毒6个结构蛋白和6个非结构蛋白(NSP),结构很稳定[4]。VP6蛋白是重要的群抗原,属于内层衣壳蛋白,占病毒蛋白总量的51%,能够产生特异性抗原决定簇,而且在病毒的复制和装配过程中发挥重要的作用[5-8]。RV根据其基因组结构和抗原性分为A~G等7个组。A组、B组和C组可引起人类和动物感染,而D组、E组、F组和G组主要引起动物感染。其中A组RV在人类和动物中感染最为普遍[9]。因此,本研究利用猪A群轮状病毒的群抗原VP6蛋白作为包被抗原,建立了检测猪A群轮状病毒抗体的间接ELISA检测方法,为猪A群轮状病毒的流行病学调查奠定基础。
1 材料与方法
1.1 材料
1.1.1 毒株、细胞、血清 猪A群轮状病毒TM-a株由华中农业大学农业微生物学国家重点实验室分离保存;细胞MA-104由中国典型培养物保藏中心提供;猪轮状病毒(PoRV)阳性血清、猪轮状病毒(PoRV)阴性血清、猪传染性胃肠炎病毒(TGEV)阳性血清、猪流行性腹泻病毒(PEDV)阳性血清、猪瘟病毒(CSFV)阳性血清、猪繁殖与呼吸综合征病毒(PRRSV)阳性血清、猪伪狂犬病病毒(PRV)阳性血清,由华中农业大学农业微生物学国家重点实验室保存或制备。
1.1.2 主要试剂 限制性内切酶为宝生物工程(大连)有限公司产品;载体pGEX-KG,由本实验室保存;脱脂奶粉为BD公司产品;BSA为AMRESCO公司产品;Tween-20为Sigma公司产品;HRP标记的羊抗猪IgG为AbDSerotec公司产品;TMB底物显色液为3,3,5,5、四甲基联苯氨、6孔酶标板为Costar公司产品;Theromo-MK 3型酶标仪为赛默飞世尔(上海)有限公司产品;其他化学试剂为分析纯。
1.1.3 菌株 大肠埃希菌JM105菌株,由本实验室保存。
1.2 方法
1.2.1 猪轮状病毒阳性和阴性血清的制备 选用45日龄的保育猪6头,分成2组,每组各3头,1组攻毒、1组对照。毒株为猪A群轮状病毒TM-a株,此毒株病毒滴度为108.5TCID50/mL。用该毒株攻毒,45日龄首次攻毒,攻毒剂量为5mL每头;75日龄先采血再攻毒,攻毒剂量为5mL每头,105日龄采血。对照不攻毒,同样时间段采血,其血清为阴性血清。
1.2.2 检测猪轮状病毒的间接免疫荧光试验 间接免疫荧光试验操作步骤:取长满的MA-104细胞1瓶,将细胞吹散,细胞悬液200μL/孔加入96孔细胞板中,在体积分数为5%的二氧化碳培养箱于37℃培养;待细胞长成单层后,接毒(猪A群轮状病毒TM-a株)100μL/孔,37℃培养1h后,再加入MEM细胞维持液100μL/孔,同时设不接毒的空白对照组;在细胞发生病变之前,弃去96孔细胞培养板中的 MEM 维持液,用PBS洗涤,200μL/孔,每次3min,洗涤5次,拍干;加入-20℃冷丙酮,100μL/孔,放入-20℃冰箱,固定30min;用PBS洗涤,200μL/孔,每次3min,洗涤5次,拍干,将96孔板自然晾干;加入1∶40倍稀释的阳性和阴性血清各100μL,37 ℃培养30min;用 PBS洗涤,200μL/孔,每次3min,洗涤5次,拍干,加入1∶60倍稀释的羊抗猪FITC标记的荧光二抗50μL,37℃培养30min;用PBS洗涤,200μL,每次3min,洗涤5次,拍干;在荧光显微镜下观察。
1.2.3 重组菌的构建 将PoRV TM-a株接种MA-104细胞,待出现病变后,反复冻融细胞3次,离心取上清液,用于提取病毒总 RNA[10],RT-PCR扩增轮状病毒的VP6全基因,构建重组菌。引物为VP6F:CCGAATTCATGGAGGTTCTGTACTCATT,VP6R:CCCGTCGACTCACTTAATCAA-CATGCTTC,其中VP6F带有EcoRⅠ酶切位点,VP6R带有SalⅠ酶切位点(下划线为相应酶切位点)。扩增条件为:94℃5min;94℃50min,56℃1min,72 ℃ 1min,35个循环;72 ℃ 10min,4 ℃5min。回收PCR产物,将PCR回收产物和pGEXKG载体分别用EcoRⅠ+SalⅠ双酶切后连接转化于大肠埃希菌JM105感受态细胞中,经测序鉴定正确后用于VP6蛋白的诱导表达。
1.2.4 VP6蛋白的诱导表达及鉴定 重组菌接种于LB液体培养基复苏,37℃培养过夜后,按1∶100接种于含有10μg/mL氨苄青霉素的LB培养基中,放37℃摇床中培养至OD 630nm值约为0.5时,加IPTG至终浓度为1mmol/L,继续培养6h,每隔1h取1.5mL菌液进行SDS-PAGE制样。将菌液于4℃、8 000r/min离心5min,沉淀用50μL灭菌水重悬,煮沸10min,冰浴10min后,于4℃、8000r/min离心5min,取上清与等量2XLoading buffer混匀后水浴煮沸10min,用于SDS-PAGE电泳分析。
重组菌经放大体系IPTG诱导后,在蛋白最大表达量时收集菌液,用buffer A重悬,反复冻融3次,超声波破碎后于4℃、12 000r/min离心10min,沉淀用SDS-PAGE检测,将提取的包涵体用含GST标签的层析柱纯化。纯化后进行 Western blot鉴定。蛋白浓度用蛋白仪器测定。
1.2.5 间接ELISA方法的建立
1.2.5.1 蛋白包被浓度及血清稀释倍数的确定利用方阵滴定原理[11],将蛋白依次稀释成10、8、6、4、2、1、0.5、0.25μg/mL,阳性和阴性血清依次稀释成1∶20、1∶40、1∶80、1∶160、1∶320、1∶640,计算对应的P/N值,P/N值最大的为蛋白包被浓度和血清稀释倍数。
1.2.5.2 包被条件的确定 以确定的最佳蛋白包被浓度进行包被,分别于37℃孵育1h后4℃过夜,37℃孵育2h,依次封闭、一抗反应、二抗反应、显色、终止反应,用测得的OD 630nm值计算P/N值,P/N值最大的为包被条件。
1.2.5.3 封闭液和封闭时间的确定 以确定的最佳蛋白包被浓度、包被条件进行包被,用5种不同封闭液(5g/L BSA,50g/L脱脂奶粉,4g/L的明胶,20g/L的海藻糖,20g/L的PEG8000)依次进行封闭、一抗反应、二抗反应、显色、终止反应,用测得的OD 630nm值计算P/N值,以P/N值最大的组确定封闭液。将选择的封闭液分别在37℃封闭1、1.5、2、2.5、3h,随后一抗反应、二抗反应、显色、终止反应,用测得的OD 630nm值计算P/N值,以P/N值最大的组确定封闭时间。
1.2.5.4 待检血清反应时间的确定 在已优化反应条件的基础上,按反应时间分成5组,分别为37℃孵育30、45、60、90、120min,经洗涤、显示、终止反应,用测得的OD值630nm计算P/N值,以P/N值最大的组确定一抗即待检血清反应时间。
1.2.5.5 标记抗体工作浓度和反应时间的确定在已优化反应条件的基础上,根据二抗使用说明书,按二抗浓度不同分成5组,分别为1∶4 000、1∶5 000、1∶6 000、1∶7 000、1∶8 000。经洗涤、显色、终止反应,用测得的OD 630nm值计算P/N值,以P/N值最大的组确定二抗工作浓度。已优化反应条件的基础上,将二抗分别在37℃孵育15、30、45、60min这4个不同时间段反应。经洗涤、显色、终止反应,用测得的OD 630nm值计算P/N值,以P/N值最大的组确定二抗工作时间。
1.2.5.6 底物反应时间的确定 在已经优化的反应条件的基础上,按底物的作用时间分成4组,37℃作用5、10、15、20min,终止反应,用测得的OD 630nm值计算P/N值,以P/N值最大的组确定底物反应时间。
1.2.5.7 判定标准的确定 选择20份经间接免疫荧光试验确定为阴性的血清,根据统计学原理,当样本OD 630nm值≥X+3SD时,可以在99.9%的水平上判定为抗体阳性,当样品OD 630nm值<X+3SD时,可以在99.9%的水平上判定为抗体阴性。
1.2.6 特异性试验 在相同的条件下对PEDV,TGEV、CSFV、PRV、PRRSV阳性血清进行检测,同时设PoRV的阳性和阴性对照和空白孔对照,评价ELISA 的特异性[12]。
1.2.7 敏感性试验 对标准阳性血清进行1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256、1∶512、1∶1 024、1∶2 084 倍 稀 释[13],分 别 用 建 立 的ELISA方法和间接免疫荧光试验检测,对试验结果进行对比,评价ELISA的敏感性。
1.2.8 与间接免疫荧光试验方法的比较 随机抽取142份血清,分别用建立的ELISA方法和间接免疫荧光试验检测,对试验结果进行对比。
1.2.9 临床初步应用检测 用建立的ELISA方法对来自湖北、河北、江西、四川、福建等省份的临床样品639份进行检测,对结果进行分析。
2 结果
2.1 获得猪轮状病毒阳性和阴性血清
制备的猪轮状病毒阳性血清(第2次采血的血清)用间接免疫荧光试验检测,出现强阳性信号,获得猪轮状病毒阳性血清(图1);制备的猪轮状病毒阴性血清(第2次采血)用间接免疫荧光试验检测,无阳性信号,获得猪轮状病毒阴性血清(图2)。

图1 猪轮状病毒阳性血清间接免疫荧光试验Fig.1 Results of porcine rotavirus positive serum detected by IFA

图2 猪轮状病毒阴性血清间接免疫荧光试验Fig.2 Results of porcine rotavirus negative serum detected by IFA
2.2 VP6基因的扩增
反转录-聚合酶链反应(RT-PCR)扩增猪轮状病毒TM-a株VP6基因结果见图3。
2.3 重组质粒pGEX-KG-VP6的双酶切鉴定
重组质粒经EcoRⅠ+SalⅠ双酶切得到2条大小分别为1 194bp和5 006bp的片段,分别为插入的VP6基因和载体质粒(图4)。
2.4 SDS-PAGE分析
试验结果显示,重组菌经IPTG诱导后,在约70ku处出现特异性蛋白条带。经不同时间诱导表达,诱导4h时蛋白表达量最大,对照质粒在相应的条带处无表达(图5)。

图3 VP6基因PCR扩增产物的凝胶电泳图Fig.3 Gel electrophoresis of VP6gene products amplified by PCR
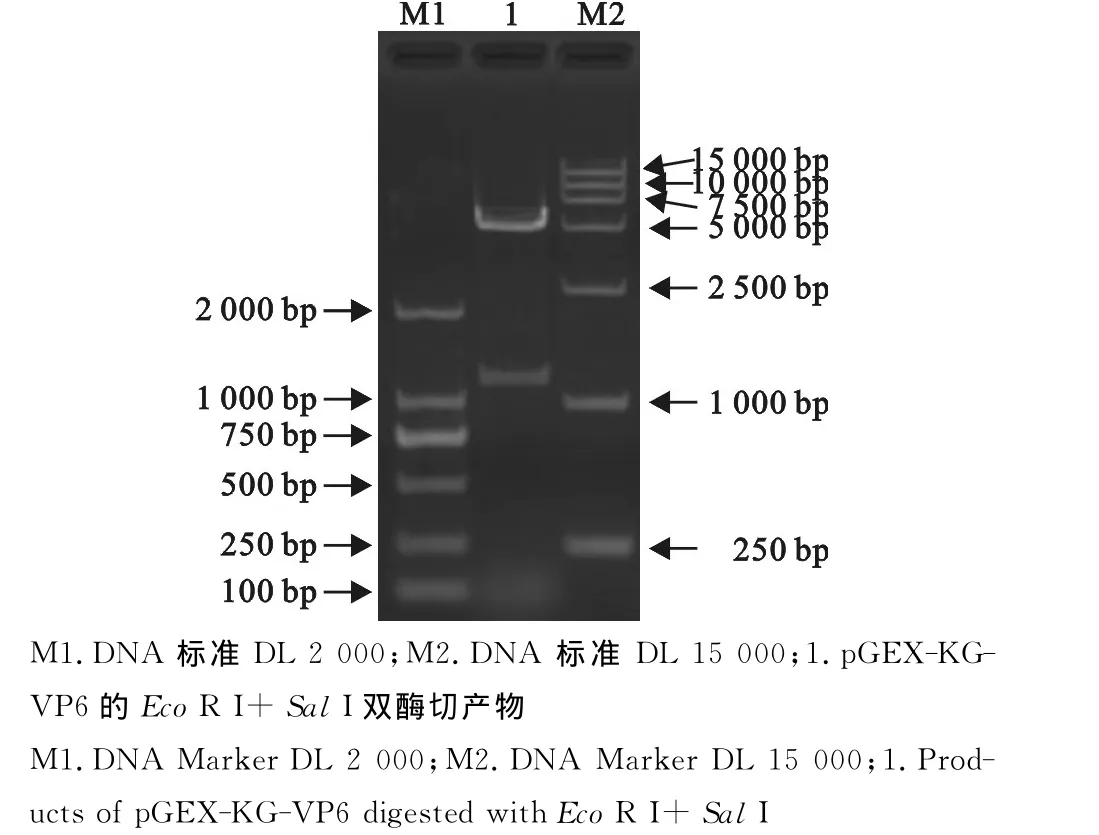
图4 重组表达质粒pGEX-KG-VP6的酶切鉴定Fig.4 Enzyme digestion identification of pGEX-KG-VP6

图5 重组菌pGEX-KG-VP6不同时间诱导表达的SDS-PAGE分析Fig.5 SDS-PAGE analysis of the expressed proteins from the induced pGEX-KG-VP6 in different time
2.5 Western blot分析
重组菌经破碎仪破碎后,沉淀包涵体用GST纯化柱纯化,经Western blot分析,结果显示,目的条带初步得到纯化(图6)。并表明该蛋白具有生物学活性,可作为抗原用于本研究的ELISA方法建立。

图6 目的蛋白的Western blot分析Fig.6 Western blot analysis of the expressed proteins
2.6 间接ELISA方法的建立
利用方阵滴定原理及各项试验条件的优化,最终确定间接ELISA方法的工作流程如下:以pH 9.6磷酸盐作为包被缓冲液,VP6蛋白包被量为2μg/mL,每孔100μL,37℃孵育1h后4℃包被过夜;200μL的PBST洗涤5次,每次3min,最后1次拍干,每孔加200μL的50g/L脱脂奶粉于37℃封闭2h;200μL的PBST洗涤5次,每次3min,最后1次拍干,每孔加1∶40稀释的待检血清100μL,37℃孵育1h;200μL的PBST洗涤5次,每次3min,最后1次拍干,每孔加羊抗猪酶标二抗100μL,37 ℃孵育30min;200μL的 PBST 洗涤5次,每次3min,最后1次拍干,依次加入底物A、底物B,各50μL,避光反应10min,最后加终止液50μL,10min内用波长为630nm测每孔光吸收值。
间接免疫荧光鉴定的20份阴性血清,用建立的ELISA方法测定OD 630nm值,经检测,这20份阴性血清OD 630nm值的平均值为0.267,标准偏差为0.049,所以,当 OD 630nm 值≥0.267+3×0.049即OD 630nm值≥0.414时为阳性,OD 630nm值<0.414时为阴性。
2.7 特异性试验
对PEDV、TGEV、PRRSV、CSFV、PRV、PoRV这6种病毒阳性血清进行ELISA检测,根据检测结果进行统计学分析,结果显示,与PoRV的阳性血清相比,其他5种阳性血清差异显著,低于阳性判定值,说明建立的间接ELISA检测方法特异性良好,无交叉反应(图7)。
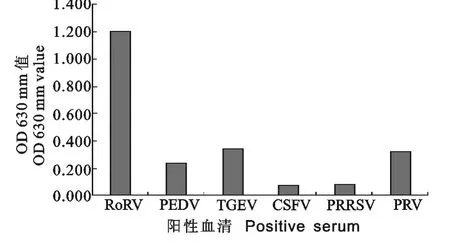
图7 不同病毒抗体间交叉反应结果Fig.7 The ELISA results of cross reaction with antibodies against other viruses
2.8 敏感性试验结果
对标准阳性血清进行4、8、16、32、64、128、256、512、1 024、2 084倍稀释,分别用建立的ELISA方法和间接免疫荧光试验检测。用建立的ELISA方法检测,当阳性血清稀释256倍时,OD 630nm值为0.563;而用间接免疫荧光检测,当阳性血清稀释128倍时,无阳性信号。因此,建立的间接ELISA方法比间接免疫荧光试验的敏感高。
2.9 样品检测结果
检测142份样品进行符合率对比,建立的间接ELISA方法检测为阴性37份,阳性105份;间接免疫荧光试验检测为阴性31份,阳性111份。以间接免疫荧光试验为标准,阴性符合率为83.4%,阳性符合率为94.6%,总符合率为91.5%。然而检测来自湖北、河北、江西、四川、福建等省份的临床样品639份,用于初步的流行病学调查,其中仔猪样品117份,阴性43份,阳性74份,仔猪感染率为63.2%;保育猪样品65份,阴性13份,阳性52份,保育猪感染率为65.0%;育肥猪样品228份,阴性24份,阳性204份,育肥猪感染率为89.5%;母猪样品229份,阴性8份,阳性221份,感染率为96.5%;总感染率为86.2%。各年龄段猪的感染率见图8。

图8 各年龄阶段猪的猪轮状病毒感染率Fig.8 The porcine rotavirus infection rates in each age stage pigs
3 讨论
轮状病毒属于人畜共患病病原,据相关报道,全世界每年有527 000儿童死于A群轮状病毒感染[14]。2010年冬季以来,我国发生仔猪病毒性腹泻,也给养猪业造成了巨大的经济损失。
VP6蛋白以三聚体形式构成RV的内衣壳层,与外壳蛋白VP7、VP4及核心蛋白VP2相互作用,在维持RV的整体结构中扮演重要角色[15]。同时,VP6蛋白也是轮状病毒重要的群特异性抗原。因此,VP6蛋白是轮状病毒感染血清抗体检测的重要候选抗原[16]。本研究构建猪轮状病毒VP6重组蛋白的表达载体pGEX-KG-VP6,经诱导表达,SDSPAGE和Western blot鉴定分析,重组蛋白获得表达,有生物学活性,可作为本试验建立的ELISA检测方法的包被抗原。其中Western blot鉴定中,发现还有一条与目的条带相近,大小约65ku条带,经分析,推测是由于70ku包涵体蛋白的降解产物,同样有抗原性[17]。
ELISA技术具有操作简便、敏感性高、特异性强、重复性好、价格低廉等优点,在各实验室及基层单位已普遍应用[18]。本研究利用建立的间接ELISA方法检测临床上未免疫猪轮状病毒疫苗的血清639份,分析临床上猪轮状病毒自然感染率,其中,仔猪感染率为63.2%,保育猪感染率为65.0%,育肥猪感染率为89.5%,育肥猪感染率为89.5%,总感染率86.2%。在调查中发现,随着猪日龄的增长,轮状病毒的感染也随之增加。该研究结果为猪轮状病毒的防控提供了技术支持和第一手基础数据。
[1]Junaid S A,Umeh C,Olabode A O,et al.Incidence of rotavirus infection in children with gastroenteritis attending Jos university teaching hospital,Nigeria[J].Virol J,2011(8):233.
[2]王 璐,时红艳,陈建飞,等.2011年-2012年G9型猪轮状病毒流行病学调查及VP7基因遗传进化分析[J].中国预防兽医学报,2013,35(4):276-279.
[3]库旭钢,刘云波.猪病毒性腹泻的流行病调查及分析[J].养猪,2012(5):101.
[4]Straw B E,Zimmerman J J.猪病学[M].9版.北京:中国农业大学出版社,2008:481-483.
[5]Zhu Jiayi,Yang Qing,Cao Liyan,et al.Development of porcine rotavirus vp6protein based ELISA for differentiation of this virus and other viryses[J].Virol J,2013,10:91.
[6]吴奇英.猪轮状病毒TaqMan荧光定量RT-PCR方法的建立及初步应用[D].湖北武汉:华中农业大学,2013.
[7]Hsu G G,Bellamy A R,Yeager M.Projection structure of VP6,the rotavirus inner capsid protein,and comparison with bluetongue VP7[J].J Mol Biol,1997,272(3):362-368.
[8]张洪英,高 艳.轮状病毒研究进展[J].畜牧兽医科技信息,2007(6):3-6.
[9]杨 盟,周建国,马海利.A组轮状病毒的基因组及其蛋白研究进展[J].中国动物传染病学报,2012,20(2):75-80.
[10]袁 静,潘小霞,滕玉梅,等.轮状病毒结构蛋白VP6的原核表达及作为检测抗原在病毒检测中的应用[J].中国生物制品学杂志,2012,25(6):730-733.
[11]折尕才措.猪伪狂犬病病毒间接ELISA检测方法的建立[J].动物医学进展,2012,33(9):128-132.
[12]杨俊兴,曹琛福,曾少灵,等.牛病毒性腹泻病毒双单克隆抗体夹心ELISA检测方法的建立及初步应用[J].动物医学进展,2013,34(5):11-16.
[13]时红艳,冯 力,陈建飞,等.猪轮状病毒重组VP7蛋白抗原间接ELISA诊断方法的建立[J].中国预防兽医学报,2008,30(3):236-237.
[14]Wakuda M,Ide T,Sasaki J.Porcine rotavirus closely related to novel group of human rotaviruses[J].Emerg Infert Dis,2011,17(8):1491-1493.
[15]汤璘珊,陈兰举.轮状病毒结构蛋白的研究进展[J].医学综述,2013(1):19.
[16]Kohli E,Pothier P,Tosser G.et al.Invitroreconstitution of rotavirus transcriptional activity using viral cores and recombinant baculovirus expressed vp6 [J].Arch Virol,1993,133(34):451-458.
[17]Robert E S,Sharon E K,Nadine B C.Cloning and expression of the major inner capsid protein of SA-11simian rotavirus inEscherichiacoli[J].Gene,1989,79(2):239-248.
[18]朱立平,陈学清.免疫学常用实验方法[M].北京:人民军医出版社,2000:342-363.
Expression of VP6 and Development of An ELISA for Detection of IgG Antibodies against Porcine Rotavirus Group A
CHEN Shu-hua1,2,KU Xu-gang1,2,YAN Gui-wei1,2,DING Zhen-jiang1,2,HE Qi-gai1,2
(1.StateKeyLaboratoryofAgriculturalMicrobiology,Wuhan,Hubei,430070,China;2.CollegeofVeterinaryMedicine,HuazhongAgriculturalUniversity,Wuhan,Hubei,430070,China)
The aim of this research was to establish an indirect ELISA method for clinically detection of antibodies against porcine rotavirus Group A (PoRV)in pigs.VP6protein of Group A PoRV TM-a strain was successfully expressedinvitro.This recombinant protein was confirmed through SDS-PAGE and Western blot.The size of recombinant protein was 70ku and can be recognized by positive serum against PoRV.After optimization,2μg/mL of the protein was used to coat the plate,the dilution of clinical serum and HRP-conjugated antibody were 1∶40and 1∶4 000,respectively.The indirect ELASA detection method was established and used to detect clinical samples.Totally,142clinical samples were detected as positive according to our method and confirmed through indirect immunofluorescence assay(IFA).The agreement of negative and positive were 83.4%,94.6%,resulting the general agreement of 91.5%between ELISA and IFA.This ELISA was further used to detect 638serum samples collected from different ages of swine to analyse the infection rate of PoRV in swine farm.The developed ELISA could be a convenient and accurate method for the epidemiological investigation of PoRV infection in pigs.
Porcine rotavirus;inner capsid protein VP6;indirect ELISA
S852.659.4;Q789
A
1007-5038(2014)07-0001-06
2014-01-10
国家生猪产业技术体系项目(CARS-36)
陈淑华(1987-),女,福建漳州人,兽医硕士,主要从事猪传染病防控研究。* 通讯作者
