甲基丙烯酸缩水甘油酯GMA单分散微球的制备及表征
2014-03-09张建平梁力曼周世蛟任艳军侯文龙赵永光
张建平,赵 莹,梁力曼,周世蛟,任艳军,侯文龙,赵永光
(河北科技师范学院化学工程学院,河北秦皇岛,066600)
介质是其液相色谱核心技术之一,介质的研究水平一直制约着液相色谱技术的发展[1]。在以生物大分子为目标产物的分离中,由于生物大分子自身的特殊性,使得对分离介质的要求也比较严格。早期应用最多的材料是多糖基质,但由于只能在较低流速下操作,限制了其应用[2]。对于硅胶介质,能够承受较高的压力,但是只能在较低的pH下稳定操作[3]。之后发展的刚性有机树脂介质有很好的性能,但表面积小、柱容量不高,且装柱难度大,一般来说宜用于分析而不利于制备分离[4]。因此,Afeyan等[5]引入了一个新的色谱概念:灌注色谱。这种色谱介质的基质是高分子材料,它带有两类孔,一类是穿透孔,流体以对流形式通过;另一类是扩散孔,跟一般介质具有的孔一样,流体以扩散的形式通过。穿透孔与扩散孔相连,保证了介质的大比表面积和溶质吸附容量,同时大大降低了利用传统介质进行色谱分离的扩散传质阻力(图1)。而这类介质主要为微米级聚合物微球,作为功能高分子材料,微米级聚合物微球在分析化学,生物化学,免疫医学及某些高新技术领域中有着广泛应用前景。而商品化的流通色谱介质存在着成本高、制备工艺复杂等缺点。因此,新型灌注色谱介质微球的制备一直是研究的热点。
聚甲基丙烯酸缩水甘油酯(PGMA)微球是一种富含环氧基的功能高分子材料,既具备特定的物理结构,又有良好的化学反应性能[6],以此类微球为介质的液相色谱适用于生物大分子,尤其是蛋白质的分离纯化。笔者利用分散聚合法制备粒径可控的微米级PGMA单分散种子微球,以期优化合成工艺,对该微球进行结构表征,确定该介质的静态吸附容量。

1 材料与方法
1.1 仪器与试剂
1.1.1 实验设备 旋转蒸发仪(RE-25C,上海亚荣生化仪器厂生产),水浴振荡器,光学显微镜(Motic Digital Microscope Motic B5,麦克奥迪实业集团有限公司生产),扫描电镜(SEM,KYKY-2800,北京中科科仪有限公司生产),真空干燥箱(ZD79-A,天津中环实验电炉有限公司生产),紫外可见分光光度计(752N,上海精密科学仪器有限公司生产)。
1.1.2 实验药品 甲基丙烯酸缩水甘油酯(GMA,质量分数 >0.99),二甲基丙烯酸乙二醇酯(EDMA,质量分数>0.98),牛血清白蛋白(BSA),上海晶纯生化科技股份有限公司生产;偶氮二异丁腈(AIBN),天津大沽化工股份有限公司生产;聚乙烯吡咯烷酮(PVP),天津市风船化学试剂科技有限公司生产;聚乙烯醇(PVA 1788),十二烷基苯磺酸钠(SDS),正辛醇,天津光复精细化工研究所生产;甲苯,天津市化学试剂三厂生产。以上均为分析纯。
2 单分散多孔微球的制备
2.1 单分散微球的制备
按比例在100 mL茄形瓶中加入单体(GMA)、引发剂(AIBN)、分散剂(PVP),无水乙醇和水,超声10 min充分溶解成均相溶液。通入N2排O2。于70℃恒温水浴中旋转加热,一定时间后,产物静置沉降,倾去上层清液。沉降物以无水乙醇洗涤、沉降3次。再用2次水洗涤、沉降3次,得到微球,改变配比重复上述操作以优化反应条件。
2.2 多孔微球的制备
步骤a:将上述制备所得微球储存于PVA的溶液中,分散成100.0 g·L-1匀浆液。取20mL匀浆液分散于100 mL,PVA的质量分数为0.01,SDS的质量分数为0.01的水溶液中,得到种子分散液。
步骤b:在烧瓶中,准确加入一定比例的GMA,EDMA,甲苯,正辛醇,AIBN,超声使完全溶解,加入PVA的质量分数为0.20和SDS的质量分数为0.05水溶液100 mL。反复超声乳化,使油相完全乳化,液面上层无油滴,获得O/W型乳液。
步骤c:将步骤b中的O/W型乳液以2 mL·min-1的速率滴加到含步骤a所得种子分散液的500 mL圆底烧瓶中,在20℃下溶胀12 h后,通N220 min后,N2保护下70℃恒温搅拌反应,聚合24 h,得到聚甲基丙烯酸缩水甘油酯/二甲基丙烯酸乙二醇双酯交联微球[7]。
将聚合物微球转入网孔尺寸为0.037 mm的尼龙袋中,在索氏提取器中利用乙醇抽提24 h,以除去聚合物中残存的有机致孔剂和其它可溶性组分,真空干燥后备用。采用文献[8]所述方法,用二乙胺对双孔微球进行表面修饰。
2.3 微球的形貌表征
在室温下,真空干燥计算产率。用光学显微镜(Motic Digital Microscope Motic B5)和Motic Image Advanced 3.0系统观察微球的形貌,测量粒径及粒径分布。以扫描电镜观察双孔微球的表面形貌。
3 结果与分析
3.1 单分散微球制备过程的优化
设计单因素试验,调节4个变量GMA,AIBN,PVP,醇水比中的某一变量,控制其他3个变量不变,合成微球。综合考虑产率、粒径大小及分布因素,讨论影响微球制备的因素。
3.1.1 醇水比对微球合成的影响 控制GMA,AIBN,PVP的量不变,调节醇水比,合成微球。结果表明,随着乙醇中水的比例的增加,合成的PGMA微球产率略微下降,微球粒径是一直增加,但是单分散性也随之变差(图2)。当V(无水乙醇)∶V(水)=46∶4时,得到PGMA微球粒径分散指数达2.267,>1.05,不再是单分散微球。根据溶液理论,溶解度参数越接近则溶解性越好。在反应体系中,分散剂PVP溶度参数与乙醇相近,所以乙醇含量高时PVP分子更为舒展,从而对聚合物微球具有很好的保护能力。反之,当无水乙醇含量减少时PVP溶解性变差,对微球保护能力下降,聚合物微球发生粘结、聚并,导致分散变宽直至不能成球。由此可知,分散介质中醇与水的比例对微球的形成以及粒径分布非常重要,V(无水乙醇)∶V(水)≥47∶3都可以形成单分散微球。
3.1.2 单体用量对微球合成的影响 控制AIBN,PVP,醇水比的量不变,调节单体GMA的量,合成微球。结果表明,随着单体在体系中的质量分数的增加,PGMA微球产率先升后降,在单体的质量分数为0.10时达到最大(图3)。随着单体在体系中的质量分数的增加,微球粒径是增加的,单体的质量分数达到0.12及以后时粒径增加不明显。而在所实验的单体的质量分数在0.06~0.14范围内,微球粒径均符合单分散性要求。综合考虑上述数据,选择单体的质量分数为0.08~0.10的比例时最合适。
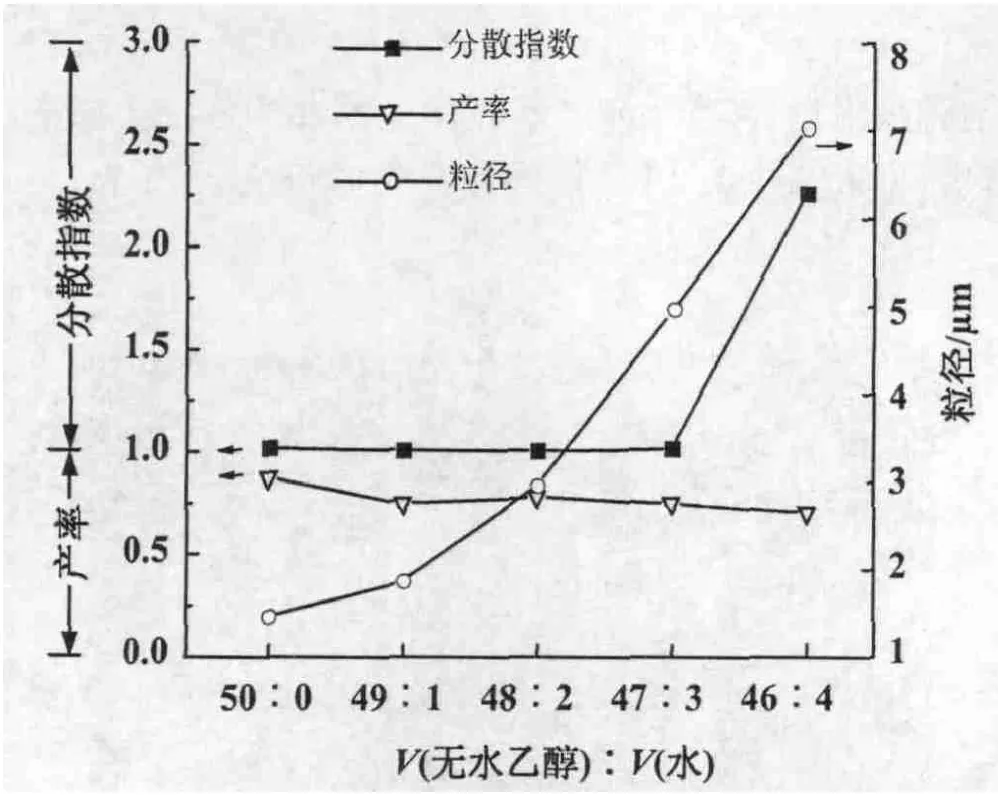
图2 醇水比对微球合成的影响
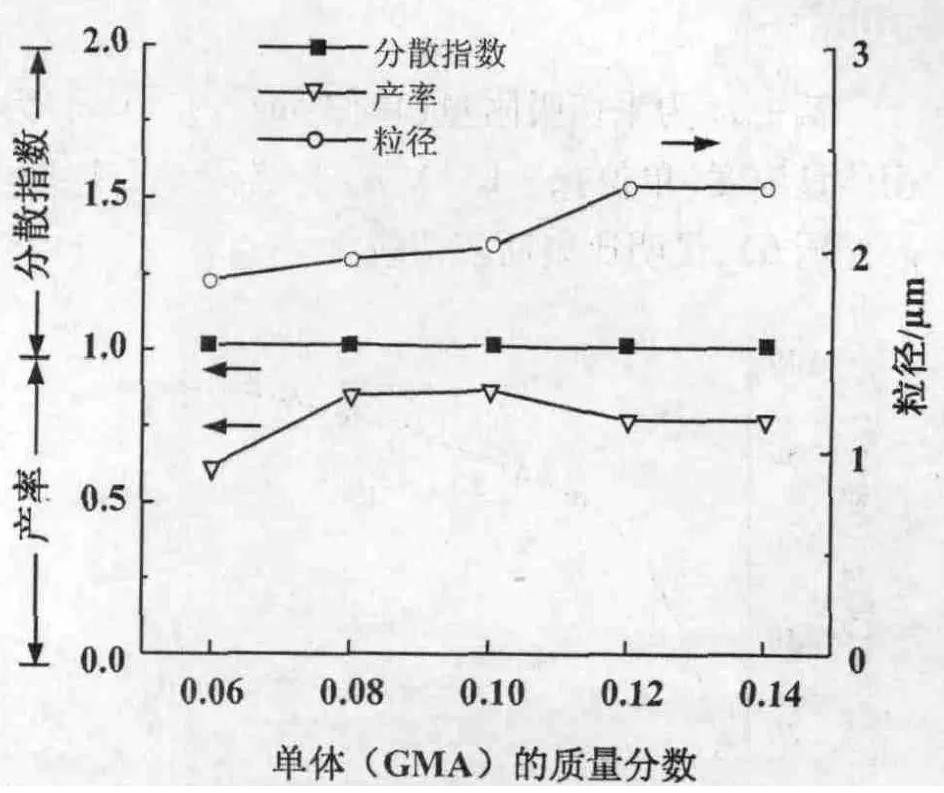
图3 单体用量对微球合成的影响
3.1.3 引发剂用量对微球合成的影响 控制GMA,PVP,醇水比的量不变,调节引发剂AIBN质量占投入单体质量的比例,合成微球。结果表明,PGMA微球产率随引发剂用量的增加呈先升后降的变化趋势,在引发剂用量为投入单体质量的0.025倍时达到最大(图4)。随引发剂用量的增加,平均粒径呈先降低后增加的变化趋势。随引发剂用量的增加,微球粒径分布呈先变窄而后又略微变宽的变化趋势,引发剂用量为投入单体质量的0.017~0.025倍范围内合成的微球符合单分散要求。综合考虑,引发剂的用量为单体质量的0.021~0.025倍时结果比较好,微球粒径可控,粒径分布较窄。这与一般分散聚合规律类似。
3.1.4 分散剂PVP用量对微球合成的影响 控制其它因素(GMA,AIBN,醇水比)的量不变,调整分散剂PVP占分散介质质量的比例,合成微球。结果表明,随着分散剂用量的增大,PGMA微球产率呈先升高后降低的变化趋势,在分散剂用量为分散介质质量的1.7×10-3倍时达到最高(图5)。随着分散剂用量的增大,微球粒径呈先降低后升高的变化趋势,在分散剂用量为分散介质质量的1.7×10-3倍时最小。随着分散剂用量的增大,合成的微球其分散指数开始变窄而后又呈现增宽趋势,分散剂用量为分散介质质量的1.7×10-3~2.1×10-3倍范围内符合单分散要求。当分散剂用量比较小时,对形成的微球稳定效果差,微球容易发生聚并,得到平均粒径较大的微球,微球的粒度分布变得较宽;当稳定剂用量较大时,对微球的稳定效果比较好,微球之间的聚并少,得到的微球的平均粒径较小,微球的粒度分布也比较窄;但当稳定剂用量过大时,聚合物成核后部分能吸附更多的分散剂形成更大的微球,同时聚合物在微核上的沉积不均匀造成微球粒径大小不均一,粒径变大,但是分布比较宽。上述现象与一般分散聚合规律类似[9,10]。

图4 引发剂用量对微球合成的影响
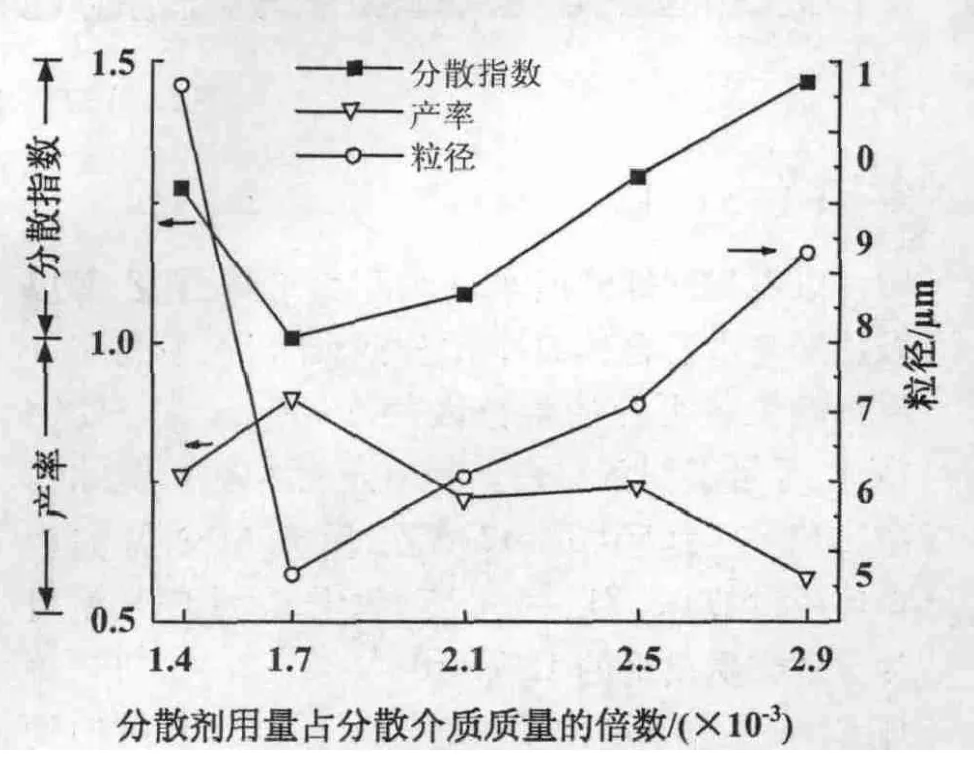
图5 分散剂用量对微球合成的影响
3.2 静态吸附容量
利用标准间歇式吸附操作测定改性多孔微球对BSA的静态吸附等温线[11]。
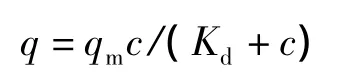
其中,q为平衡吸附量(单位:mg·g-1),qm为饱和吸附量(单位:mg·g-1),c为水相中蛋白质的平衡质量浓度(单位:g·L-1),Kd为吸附平衡解离常数(单位:g·L-1)。其饱和吸附容量为93.1 mg·g-1(图6),说明比表面积值较大。
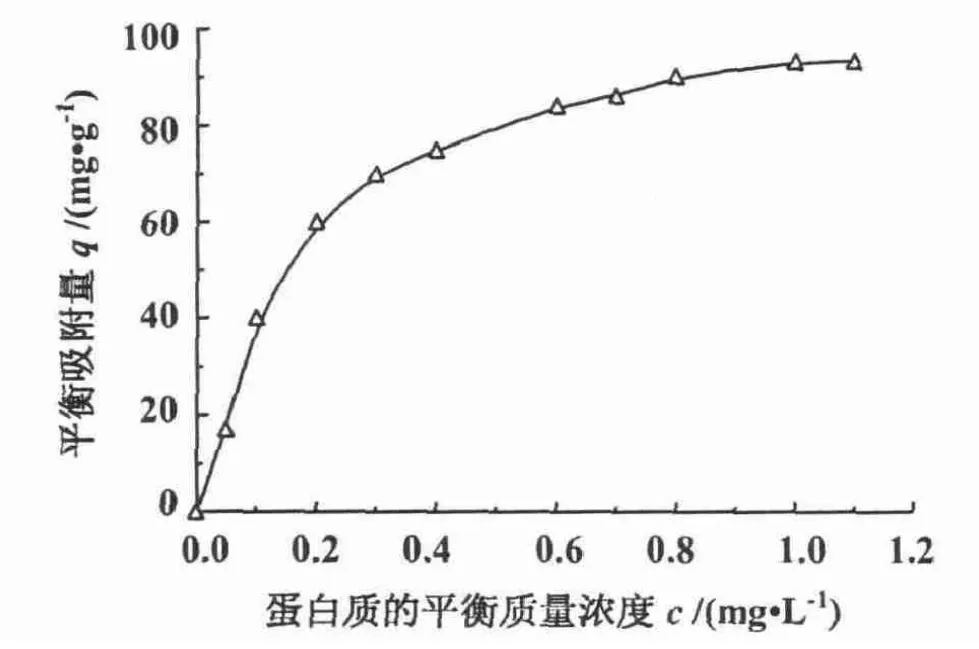
图6 双孔微球静态吸附等温线
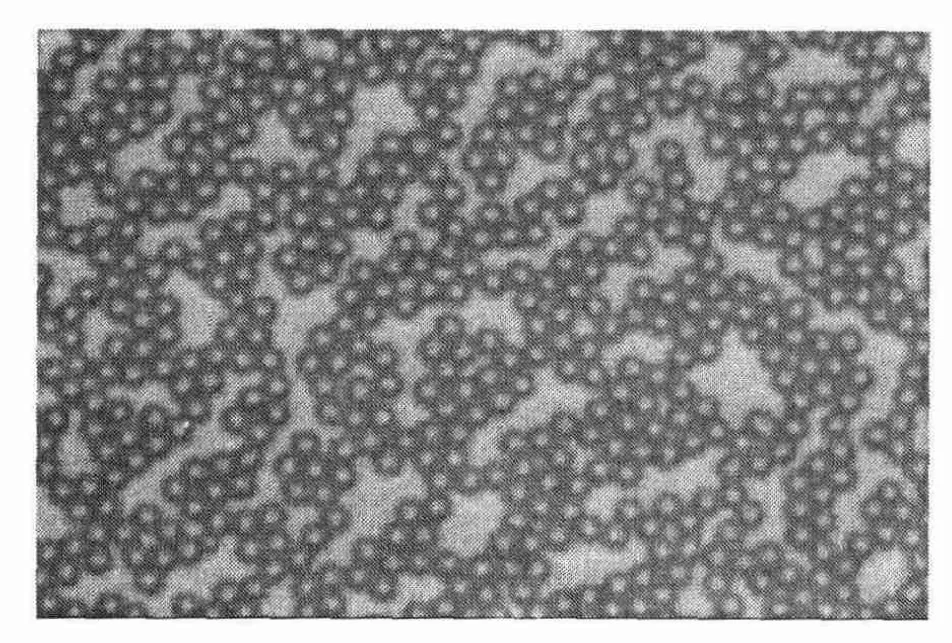
图7 单分散微球的光学显微镜照片
3.3 形貌表征结果
图7为光学显微镜下的种子微球表面形貌,粒径5~6μm,而且分布均匀、单分散系数<1.05,符合单分散要求。图8为微球在扫描电镜下的微球照片,粒径均匀、表面光滑并无微孔。图9为经一步溶胀法合成的改性多孔微球,从电镜照片中可以看出表面粗糙有许多微孔。

图8 单分散微球扫描电镜照片
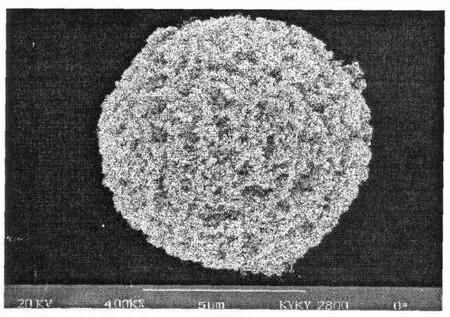
图9 改性微球扫描电镜照片
4 结 论
以甲基丙烯酸缩水甘油酯为单体,在乙醇以及乙醇与水混合体系中用分散聚合法,制备了一系列的粒径可控的单分散的1~8μm的PGMA微球,考量了制备工艺。其中分散体系V(无水乙醇)∶V(水)为 50∶0~47∶3,引发剂 AIBN 用量为单体质量的0.021~0.025倍,分散剂 PVP用量为分散介质质量的 1.7 ×10-3~2.1 ×10-3倍,单体GMA在体系中的质量分数为0.06~0.14时均能得到单分散的微球。经改性得到的多孔微球其对BSA的静态吸附量高达93.1 mg·g-1,在蛋白质分离方面有很好的应用前景。
致谢:感谢河北科技师范学院分析测试中心在样品测试中的帮助和指导!
[1] 师治贤,王俊德.生物大分子的液相色谱分离和制备[M].第二版.北京:科学出版社,1999.
[2] Garcia MC,Marina ML,Torre M.Perfusion chromatography:an emergent technique for the analysis of food proteins[J].Chromatogr A,2000,880(1-2):169-187.
[3] Boschetti E,Guerrier L,Girot P,etal.Preparative high-performance liquid chromatographic separation of proteinswith HyperD ion-exchange supports[J].Chromatogr B,1995,664:225.
[4] Hosoya K,Yoshizako K,Shirasu Y,etal.Molecularly imprinted uniform-size polymer-based stationary phase for HPLC[J].Chromatgr A,1996,728:139-147.
[5] Afeyan N B,Gordon N F,Mazasaroff I,etal.Flow through particles for the high-performance liquid chromatographic separation of biomolecules:perfusion chromatography[J].Chromatgr A,1990,519:1-29.
[6] 赵中璋,杨树明,杨彦果,等.分散聚合制备粒度均匀的聚甲基丙烯酸环氧丙酯微球[J].高分子学报,1999(1):31-36.
[7] 赵睿,刘吉众,黄嫣嫣,等.双孔微米级聚甲基丙烯酸环氧丙酯—甲基丙烯酸乙二醇双酯交联微球及其制备方法:中国,102617804 A[P].2012-08-01.
[8] Sun G Y,Shi Q H,Sun Y.Novel biporous polymeric stationary phase for high-speed protein chromatography[J].Chromatogr A,2004,1 061:159-165.
[9] 周晓英,张光华.大粒径单分散聚合物微球的制备及其在LCD中的应用进展[J].塑料,2008,37(5):37-40,51.
[10] 邱磊,苏向东,韩峰.分散聚合制备单分散聚合微球[J].化学工程与装备,2010(12):13-15.
[11] Yu Y H,Sun Y.Macroporous Poly(Glycidyl Methacrylate-Triallyl Isocyanurate-Divinylbenzene)Matrix as an Anion-Exchange Resin for Protein Adsorption[J].Chromatrogr A,1999,855:129-136.
