磁共振技术在急性缺血性卒中出血转化预测中的应用
2014-03-08金信春楼敏
金信春,楼敏
缺血性卒中是我国居民致残率及致死率极高的疾病之一,国内外指南推荐的4.5 h内接受重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)静脉溶栓治疗是缺血性卒中急性期治疗的唯一有效方法[1],但同时存在出血转化(hemorrhagic transformation,HT)风险[2]。影像学检查能够为溶栓后HT提供必要的预测信息。近年,多模式磁共振技术不仅应用于明确缺血性卒中诊断,同时,与传统计算机断层扫描(computed tomography,CT)相比,能够通过反映细胞代谢障碍,组织灌注缺损,血脑屏障(bloodbrain barrier,BBB)破坏等生理机制[3]而提高HT的预测能力。本文将对磁共振技术对预测缺血性卒中溶栓后HT的研究进展做综述如下。
1 磁共振弥散成像和表观弥散系数
磁共振弥散成像(diffusion weighted imaging,DWI)是基于水分子布朗运动来检测早期缺血病灶的成像技术。缺血性卒中早期脑组织发生细胞毒性水肿[3],胞内肿胀限制了胞外分子的布朗运动,在DWI上呈高信号。表观弥散系数(apparent diffusion coefficient,ADC)图像可量化水分子在缺血组织中的弥散受限程度,ADC值的降低与脑组织细胞毒性水肿的程度呈正相关[4]。弥散和灌注影像评估卒中进展(the Diffusion and perfusion imaging Evaluation For Understanding Stroke Evolution,DEFUSE)研究将基线DWI高信号体积≥100 ml定义为“恶性征象”,发现其与静脉溶栓后的HT风险密切相关[5]。Tong等发现,在HT区内ADC≤550×10-6mm2·s-1的像素比例明显大于无HT区,Selim等进一步发现基线梗死区内ADC≤550×10-6mm2·s-1的体积越大,溶栓后HT越多[6-7]。但上述关于DWI和ADC的研究也存在不足,包括样本量不足,入组标准及治疗方式未统一等。故在应用该技术预测HT时,确定其适用患者就极为重要。
2 磁共振成像液体衰减反转恢复序列
缺血性卒中早期磁共振成像液体衰减反转恢复序列(fluid-attenuated inversion recovery,FLAIR)高信号可能为缺血性细胞毒性水肿所致,可间接反映局部缺血的严重性,故推测其可能预测HT[8]。Campbell等研究认为,基线FLAIR上脑实质高信号出现时间很重要,发病3 h内出现的FLAIR高信号能预测HT,但超过3 h后出现则不能预测,由此推测3 h内就出现FLAIR高信号者缺血损伤更严重[9]。今年Ruchira等将梗死区内FLAIR高信号的信号值与对侧相比,获得FLAIR比值(FLAIR ratio,FR),发现发病9 h内缺血性卒中患者的高FR值与基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)水平的升高,以及HT的发生显著相关,推测缺血后早期出现FLAIR高信号意味着BBB破坏,进而更易发生HT[10]。
3 动态磁敏感对比增强灌注成像
动态磁敏感对比增强灌注成像(dynamic susceptibility contrast-perfusion weighted imaging,DSC-PWI)是基于造影剂磁敏感效应的成像技术。造影剂首次通过毛细血管床时,其磁敏感效应会导致T2或T2*信号减少。连续追踪测量这种信号改变,可以得到时间-信号强度曲线,并由此计算出脑血容量(cerebral blood volume,CBV)、脑血流量(cerebral blood flow,CBF)、脑血流平均通过时间(mean transit time,MTT)、脑血流达峰时间(Tmax)等反映组织灌注情况的参数[11]。
3.1 脑血流达峰时间 Tmax间接代表了造影剂达到最大浓度所需时间,Tmax延迟越严重,脑组织缺血程度越严重[12]。Kim等研究以大脑中动脉为责任血管的缺血性卒中患者时,发现基线Tmax≥8 s的体积越大,其灌注缺损越严重,治疗后HT的风险越高[13]。Mlynash等对多中心数据库进行回顾性研究发现,基线Tmax≥8 s的体积不小于85 ml与再灌注患者的预后及HT的关系更密切,但对未再灌注的患者则无明显预测效应[14]。目前Tmax虽已被多个研究证实可用于预测HT,但仍缺乏一个公认的阈值。
3.2 极低脑血容量 CBV代表特定时间内通过脑组织的血容量,通常反映脑组织的不可逆性损伤,CBV降低越严重,灌注缺损越严重。Campbell等分别对以0%、2.5%、5%和10%为阈值标准确定的极低脑血容量(very low cerebral blood volume,VLCBV)区域进行研究,发现以2.5%确定的基线VLCBV体积大于2 ml者在rt-PA溶栓治疗后发生血肿型HT的风险较高,尤其适用于治疗后发生再灌注的患者[15]。最近,Hermitte等的研究也验证了该结论,认为以2.5%界定的VLCBV体积大于2 ml能预测溶栓治疗后的血肿型HT[16]。血肿型HT者预后不良,VLCBV对其的预测作用有利于溶栓决策。
4 血脑屏障通透性评估技术
急性缺血性卒中发生HT的风险随BBB完整性的破坏而增加,因此血脑屏障通透性(blood-brain barrier permeability,BBBP)技术在HT的预测中起着重要的作用。
4.1 基于动态造影剂增强的T1成像 动态造影剂增强(dynamic contrast-enhanced,DCE)3D梯度回波序列(gradient recalled-echo,GRE)的原始影像数据经软件处理后,可生成定量渗透性(quantitative permeability,KPS)影像,在引入的“Patlak”模型(图1)中运用线性回归[17],可以计算出KPS值。
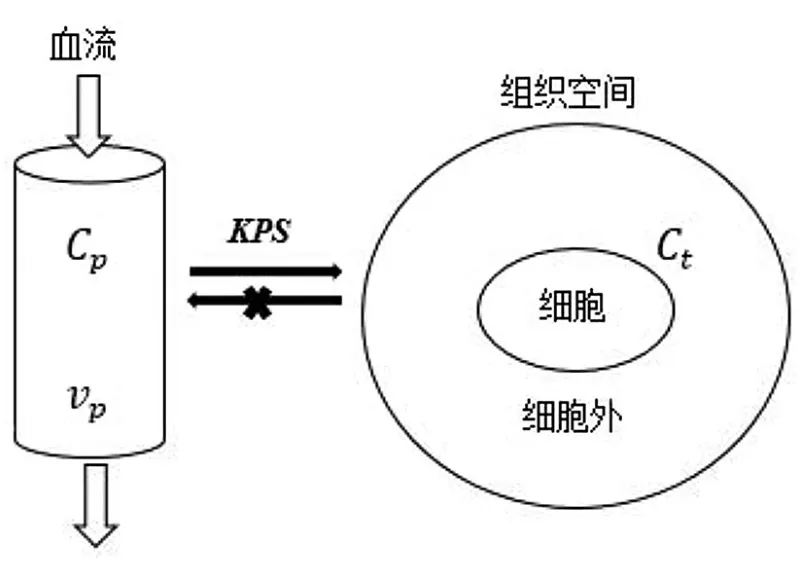
图1 基于一个单向二隔区的示踪剂运动模型计算KPS注::造影剂在组织中的浓度;:造影剂在血管中的浓度;:局部的脑血容量;KPS:定量渗透性
研究表明,KPS值能反映颅内微血管的渗透性,因此KPS最早被运用于脑肿瘤的组织学和病理学分级[18]。此后Kassner验证了KPS值能反映缺血性卒中患者急性期BBB的破坏,并发现若患者的KPS<0.67 ml·100 g-1·min-1,其接受r t-PA治疗后H T的风险较低;若KPS≥0.67 ml·100 g-1·min-1,则溶栓后HT风险增高[19]。但该研究只纳入36例患者,尚需大样本临床研究获得最佳的KPS阈值。
4.2 基于动态磁敏感对比增强的T2*成像 在基于DSC的T2*图像上,每个体素的信号强度(signal intensity,SI)改变得到T2*弛豫率(△R2*),可以通过以下公式计算得到[11]:
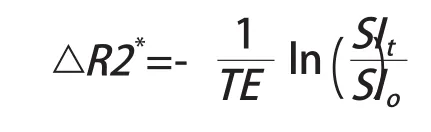
其中回波时间(echo time,TE)是磁共振扫描设定的参数,SIo和SIt分别是所选区域初始和t时刻的信号强度。通过连续追踪测量△R2*的改变,得到△R2*-时间曲线(图2)[11]。
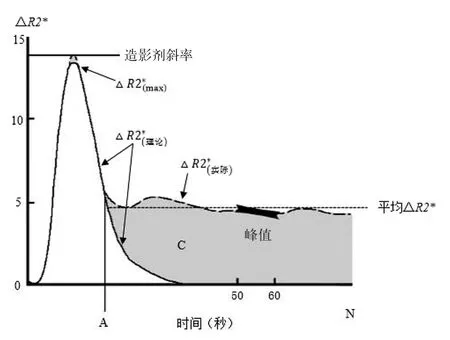
图2 △R2*-时间曲线
在此基础上引入伽马函数产生了理论△R2*-时间曲线。理论曲线可以分离实际曲线上造影剂的首过相和再循环相,通过两条曲线之间的差异可以得到参数:造影剂斜率(contrast slope,CS)、峰点高度(peak height,PH)、相对再循环系数(relative recirculation,rR)和回复百分比(percentage recovery,%R),其间接反映了BBBP(如图2)。研究发现,rR值的增大、%R值的减小、CS出现负值均提示BBB破坏,而此类患者HT的风险增高[20]。2013年,Scalzo等在一项263例卒中患者的多中心研究中分别引入了线性和非线性的预测模型,证实了上述参数对HT的预测作用,并发现%R是预测HT的最佳参数[21]。
4.3 增强T1扫描 动物研究中已证实,增强T1加权像上脑实质高信号与再通治疗后HT相关,原因可能为BBB破坏、小的造影剂分子外渗到血管外所致[22]。Eung等对55例起病6 h内的卒中患者回顾性分析发现,基线增强T1上存在脑实质高信号的5例患者均发生了HT,提示早期T1强化对预测HT有较高的特异性[23]。
5 静脉显像:毛刷征
6 其他
除上述磁共振系列之外,还有一些磁共振技术可用于预测HT,例如FLAIR上的血管高信号[26],磁敏感成像(susceptibility weighted imaging,SWI)上的微出血[27]等,都可能预示着HT的发生。
现今,基于磁共振特定序列的参数和影像能提供全面而详细的信息,帮助临床医师评估患者缺血的严重程度以及发生HT风险,决定其是否适合接受溶栓治疗。不过较长的扫描时间,明显延长了患者起病至接受治疗的时间,因此对于起病时间短,诊断明确的患者,磁共振技术在急性期的价值还有待商榷。但是在面临起病时间较长,甚至已经超过4.5 h,或是起病时间未知,诊断不明确的患者时,磁共振技术不仅能够明确诊断,还可以提高rt-PA静脉溶栓的安全性,延长部分患者的治疗时间窗,其价值是毋庸置疑的。而在基线有多种影像数据时,如何将它们与临床资料结合起来综合性地评估患者的病情和发生HT的风险就极为重要,最终使更多的患者能够得到最有效的治疗,降低缺血性卒中所带来的危害。
1 重组组织型纤溶酶原激活剂治疗缺血性卒中共识专家组. 重组组织型纤溶酶原激活剂静脉溶栓治疗缺血性卒中中国专家共识(2012版)[J]. 中华内科杂志, 2012,51:1006-1010.
2 Albers GW, Olivot JM. Intravenous alteplase for ischaemic stroke[J]. Lancet, 2007, 369:249-50.
3 Simard JM, Kent TA, Chen M, et al. Brain oedema in focal ischaemia:molecular pathophysiology and theoretical implications[J]. Lancet Neurol, 2007,6:258-268.
4 Hasegawa Y, Fisher M, Latour LL, et al. MRI diffusion mapping of reversible and irreversible ischemic injury in focal brain ischemia[J]. Neurology,1994, 44:1484-1490.
5 Albers GW, Thijs VN, Wechsler L, et al. Magnetic resonance imaging profiles predict clinical response to early reperfusion:the Diffusion and perfusion imaging Evaluation For Understanding Stroke Evolution(DEFUSE) study[J]. Ann Neurol, 2006, 60:508-517.
6 Tong DC, Adami A, Moseley ME, et al. Prediction of hemorrhagic transformation following acute stroke:role of diffusion - and perfusion-weighted magnetic resonance imaging[J]. Arch Neurol, 2001,58:587-593.
7 Selim M, Fink JN, Kumar S, et al. Predictors of hemorrhagic transformation after intravenous recombinant tissue plasminogen activator:Prognostic value of the initial apparent diffusion coefficient and diffusion-weighted lesion volume[J]. Stroke, 2002,33:2047-2052.
8 Kufner A, Galinovic I, Brunecker P, et al. Early infarct FLAIR hyperintensity is associated with increased hemorrhagic transformation after thrombolysis[J]. Eur J Neurol, 2013, 20:281-285.
9 Campbell BC, Costello C, Christensen S, et al. Fluidattenuated inversion recovery hyperintensity in acute ischemic stroke may not predict hemorrhagic transformation[J]. Cerebrovasc Dis, 2011, 32:401-405.
10 Ruchira J, Thomas WKB, Ly P, et al. Fluid-attenuated inversion recovery hyperintensity correlates with matrix metalloproteinase-9 level and hemorrhagic transformation in acute ischemic stroke[J]. Stroke,2014, 45:1040-1045.
11 Rosen BR, Belliveau JW, Vevea JM, et al. Perfusion imaging with NMR contrast agents[J]. Magn Reson Med, 1990, 14:249-65.
12 Shih LC, Saver JL, Alger JR, et al. Perfusion-weighted magnetic resonance imaging thresholds identifying core, irreversibly infarcted tissue[J]. Stroke, 2003,34:1425-1430.
13 Kim JH, Bang OY, Liebeskind DS, et al. Impact of baseline tissue status (diffusion-weighted imaging lesion) versus perfusion status (severity of hypoperfusion) on hemorrhagic transformation[J].Stroke, 2010, 41:e135-e142.
14 Mlynash M, Lansberg MG, De Silva DA, et al. Refining the definition of the malignant profile:insights from the DEFUSE-EPITHET pooled data set[J]. Stroke, 2011, 42:1270-1275.
15 Campbell BC, Christensen S, Butcher KS, et al.Regional very low cerebral blood volume predicts hemorrhagic transformation better than diffusionweighted imaging volume and thresholded apparent diffusion coefficient in acute ischemic stroke[J].Stroke, 2010, 41:82-88.
16 Hermitte L, Cho TH, Ozenne B, et al. Very low cerebral blood volume predicts parenchymal hematoma in acute ischemic stroke[J]. Stroke, 2013,44:2318-2320.
17 Ewing JR, Knight RA, Nagaraja TN, et al. Patlak plots of Gd-DTPA MRI data yield blood-brain transfer constants concordant with those of14C-sucrose in areas of blood-brain opening[J]. Magn Reson Med,2003, 50:283-292.
18 Roberts H, Roberts TPL, Brasch RC, et al.Quantitative measurement of microvascular permeability in human brain tumors achieved using dynamic contrast-enhanced MR imaging:correlation with histologic grade[J]. AJNR Am J Neuroradiol,2000, 21:891-899.
19 Kassner A, Roberts TPL, Moran B, et al. Recombinant tissue plasminogen activator increases blood-brain barrier disruption in acute ischemic stroke:an MRI permeability study[J]. AJNR Am J Neuroradiol, 2009,30:1864-1869.
20 Thornhill RE, Chen S, Rammo W, et al. Contrastenhanced MR imaging in acute ischemic strokemeasures of blood-brain barrier permeability and their relationship to T1estimates and hemorrhagic transformation[J]. AJNR Am J Neuroradiol, 2010,31:1015-22.
21 Scalzo F, Alger JR, Hu X, et al. Multi-center prediction of hemorrhagic transformation in acute ischemic stroke using permeability imaging features[J]. Magn Reson Imaging, 2013, 31:961-969.
22 Neumann-Haefelin C, Brinker G, Uhlenkuken U, et al. Prediction of hemorrhagic transformation after thrombolytic therapy of clot embolism:an MRI investigation in rat brain[J]. Stroke, 2002, 33:1392-1398.
23 Kim EY, Na DG, Kim SS, et al. Prediction of hemorrhagic transformation in acute ischemic stroke:role of diffusion-weighted imaging and early parenchymal enhancement[J]. AJNR Am J Neuroradiol, 2005, 26:1050-1055.
24 Morita N, Harada M, Uno M, et al. Ischemic findings of T2*-weighted 3-tesla MRI in acute stroke patients[J].Cerebrovasc Dis, 2008, 26:367-375.
25 Yuka T, Nobuaki Y, Ryoma M, et al. Brush sign on 3-T T2*-weighted MRI as a potential predictor of hemorrhagic transformation after tissue plasminogen activator therapy[J]. Stroke, 2014, 45:274-276.
26 Hohenhaus M, Schmidt WU, Brunecker P, et al.FLAIR vascular hyperintensities in acute ICA and MCA infarction:a marker for mismatch and stroke severity?[J]. Cerebrovasc Dis, 2012, 34:63-69.
27 Shoamanesh A, Kwok CS, Lim PA, et al.Postthrombolysis intracranial hemorrhage risk of cerebral microbleeds in acute stroke patients:A systematic review and meta-analysis[J]. Stroke, 2013,8:348-356.
