血管内超声指导切割球囊在冠状动脉重度钙化病变介入治疗中有效性及安全性的评价*
2014-03-02汤喆白静王禹苏绍萍马清华刘谟焓田进文高磊宋康兴李彦华
汤喆,白静,王禹,苏绍萍,马清华,刘谟焓,田进文,高磊,宋康兴,李彦华
冠心病研究
血管内超声指导切割球囊在冠状动脉重度钙化病变介入治疗中有效性及安全性的评价*
汤喆,白静**,王禹,苏绍萍△,马清华,刘谟焓,田进文,高磊,宋康兴,李彦华
目的:利用血管内超声评价切割球囊在冠状动脉重度钙化病变介入治疗中的有效性及安全性。
冠状动脉钙化;切割球囊;血管内超声;经皮冠状动脉介入治疗
(Chinese Circulation Journal, 2014, 29:12.)
冠状动脉钙化病变广泛存在于冠状动脉粥样硬化斑块中,弥漫重度钙化病变如同坚硬的钢环一般紧箍在血管壁上。普通球囊往往难以预扩,即使高压球囊也难以成功,而且增加球囊破裂、冠状动脉撕裂、穿孔和无复流等手术风险[1,2],成为介入医生的难题。血管内超声可以从弧度、长度以及部位等精确地评价血管钙化的程度及分布,是诊断冠状动脉钙化病变的金标准[3]。血管内超声对于斑块特征及支架置入后的评价也有肯定的优越性。可以通过其定性斑块性质,测量术前、术后管腔面积改变,支架置入后评价提供精确数据。切割球囊作为介入治疗的一项新技术,主要应用于支架内再狭窄,对于冠状动脉开口病变、分叉病变、以及小血管病变也有明确的有效性及安全性[4-6]。但是目前少见随机对照的研究验证切割球囊在重度弥漫钙化病变中的有效性及安全性。本研究利用血管内超声综合考虑钙化弧度与钙化长度定义重度钙化病变,评价切割球囊治疗重度钙化病变中的效果。
1 对象和方法
研究对象:连续选取2012-03至2013-03在我院行冠状动脉造影及血管内超声检查的冠心病患者110例。纳入标准:造影示缺血相关血管狭窄>70%,需置入支架治疗;缺血相关病变在血管内超声观察下为重度钙化病变(定义为最大钙化弧度≥90°,钙化长度比≥0.5)。排除标准:靶病变为支架内再狭窄的病变;靶病变为桥血管;极度成角弯曲病变;左主干病变;球囊扩张前存在夹层的病变。按随机号将110例患者分为常规球囊组54例与切割球囊组56例。患者所有临床资料收集均于入院时完成。两组患者的年龄、性别、体重指数、高血压、糖尿病史及诊断等临床基本特征差异均无统计学意义(P均>0.05)。表1
冠状动脉造影术及支架置入术:术前12 h内常规服用阿司匹林300 mg,氯吡格雷300 mg,年龄>70岁及估算肾小球滤过率(eGFR)<60 ml/(min.1.73 m2)者,术前12 h内给予水化治疗。常规造影后由介入经验丰富的同一名医生根据中国当前经皮冠状动脉介入治疗(PCI)指南标准,决定手术的具体操作策略。所有钙化病变均给预充分预扩张,根据随机分组选用合适型号的常规球囊或切割球囊。常规球囊组中造影示狭窄血管直径约为3 mm左右,先选择直径为2.5 mm的球囊,如不能通过则换用直径为2.25 mm的球囊,如狭窄血管直径远小于3 mm,则先选用直径为2.25 mm球囊。根据情况顺序预扩至与参考血管管径相当程度并记录使用的最大的球囊直径。切割球囊组中,先选择直径为2.5 mm的球囊,如造影示病变狭窄程度较大或病变较弯曲时则先选择直径为2.25 mm的切割球囊。如病变坚硬不能顺利扩张,则顺序换用直径为2.5 mm、2.75 mm等较大直径的切割球囊,记录使用的最大的切割球囊。扩张后两组均置入药物洗脱支架。血管内超声引导下视情况给予非顺应性球囊后扩张。术后所有患者接受阿司匹林、氯吡格雷双联抗血小板以及他汀类药物调脂等常规冠心病二级预防治疗。
表1 两组临床基本资料特点
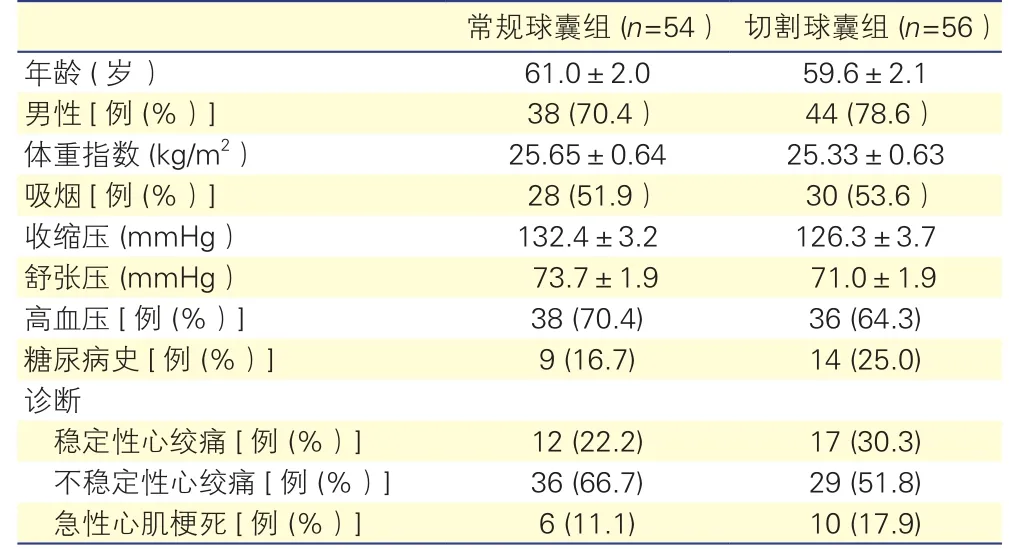
表1 两组临床基本资料特点
注:1 mmHg=0.133 kPa
常规球囊组 (n=54) 切割球囊组 (n=56)年龄 (岁) 61.0±2.0 59.6±2.1男性[例 (%)] 38 (70.4) 44 (78.6)体重指数 (kg/m2) 25.65±0.64 25.33±0.63吸烟[例 (%)] 28 (51.9) 30 (53.6)收缩压 (mmHg) 132.4±3.2 126.3±3.7舒张压 (mmHg) 73.7±1.9 71.0±1.9高血压[例 (%)] 38 (70.4) 36 (64.3)糖尿病史[例 (%)] 9 (16.7) 14 (25.0)诊断稳定性心绞痛[例 (%)] 12 (22.2) 17 (30.3)不稳定性心绞痛[例 (%)] 36 (66.7) 29 (51.8)急性心肌梗死[例 (%)] 6 (11.1) 10 (17.9)
血管内超声操作及分析:于支架置入前与支架置入后分别对病变血管行血管内超声检查。对于一些重度钙化病变,血管管腔<1.7 mm2,于球囊扩张或切割后行血管内超声检查。血管内超声仪器为VOLCANO S5 imaging system(VOLCANO CORPORATION ;探测深度≥ 16 mm;分辨力≤ 0.2 mm),Eagle Eye®Gold 超声导管(2.9 F,30 MHz,最大晶体处直径3.5 F,最大工作长度150 cm,最大导引钢丝0.014'')。超声导管送至病变远端,采用VOLCANO 公司自动回撤装置,以0.5 mm/s 自动回撤至冠状动脉窦口。所有影像资料刻录在DVD光盘以供不知道临床及造影结果的技术人员脱机分析。同一血管有最小管腔横截面积的病变截段纳入分析,PCI术前利用血管内超声测量病变段最小管腔面积、外弹力膜面积、最大钙化弧度、钙化长度及病变长度,支架置入后测量最小支架横截面积、最大支架横截面积,计算即刻管腔获得面积、即刻管腔获得率、支架对称指数、支架膨胀率,评价支架贴壁情况,有无夹层。
研究终点:造影成功定义为:造影证实术后冠状动脉残余狭窄≤20%,前向血流心肌梗死溶栓治疗临床试验(TIMI)3 级,无急性管腔闭塞、急诊冠状动脉旁路移植术。主要不良心脏事件(MACE)定义为:死亡、心肌梗死、靶血管血运重建。死亡为全因死亡。非致命性心肌梗死定义为:心肌缺血性症状、肌酸激酶同工酶正常上限两倍以上,伴或不伴ST段抬高。靶血管血运重建定义为:靶血管重复接受手术治疗,PCI或冠状动脉旁路移植术。
随访:术后1个月、6个月进行门诊随访,记录死亡、心肌梗死、靶血管血运重建、MACE等数据。
统计学分析:利用SPSS 16.0统计软件分析数据。计量资料以均数±标准差表示,如为正态分布且方差齐,两组间比较用双侧独立t检验,如非正态或方差不齐,用两组间矫正t检验或非参数秩和检验。分类资料以例数(百分比)表示,两组间检验用χ2检验。P<0.05认为差异有统计学意义。
2 结果
2.1两组冠状动脉造影及支架置入前血管内超声资料
两组中病变血管部位差异均无统计学意义(P>0.05)。支架置入前血管内超声测量病变管腔最小管腔面积、最大钙化弧度及钙化长度比,两组差异均无统计学意义(P均>0.05)。表2
表2 两组冠状动脉造影及支架置入前血管内超声资料
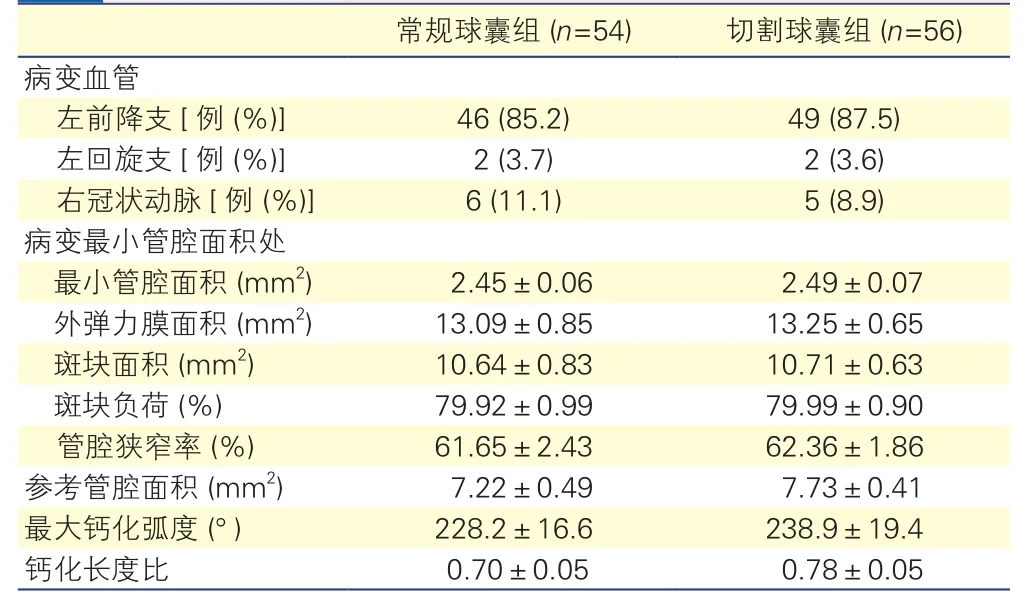
表2 两组冠状动脉造影及支架置入前血管内超声资料
常规球囊组 (n=54) 切割球囊组 (n=56)病变血管左前降支[例 (%)] 46 (85.2) 49 (87.5)左回旋支[例 (%)] 2 (3.7) 2 (3.6)右冠状动脉[例 (%)] 6 (11.1) 5 (8.9)病变最小管腔面积处最小管腔面积 (mm2) 2.45±0.06 2.49±0.07外弹力膜面积 (mm2) 13.09±0.85 13.25±0.65斑块面积 (mm2) 10.64±0.83 10.71±0.63斑块负荷 (%) 79.92±0.99 79.99±0.90管腔狭窄率 (%) 61.65±2.43 62.36±1.86参考管腔面积 (mm2) 7.22±0.49 7.73±0.41最大钙化弧度 (°) 228.2±16.6 238.9±19.4钙化长度比 0.70±0.05 0.78±0.05
2.2两组术中操作血管内超声资料
在常规球囊组中有6例(11.1%)预扩效果不良失败,转为切割球囊处理(统计时未归入切割球囊组),术中及术后特点比较中,常规球囊组为48例,切割球囊组为56例。在切割球囊组中有42例患者切割后又使用常规球囊进行充分前扩,与常规球囊组相比前扩球囊直径及前扩压力差异均无统计学意义(P均>0.05)。两组置入支架直径及长度以及支架释放压力差异均无统计学意义(P均>0.05)。常规球囊组有40例进行后扩,切割球囊组有44例进行后扩;切割球囊组后扩球囊直径高于常规球囊组,差异有统计学意义(P<0.05);两组后扩压力差异无统计学意义(P>0.05)。表3
表3 两组术中操作血管内超声资料
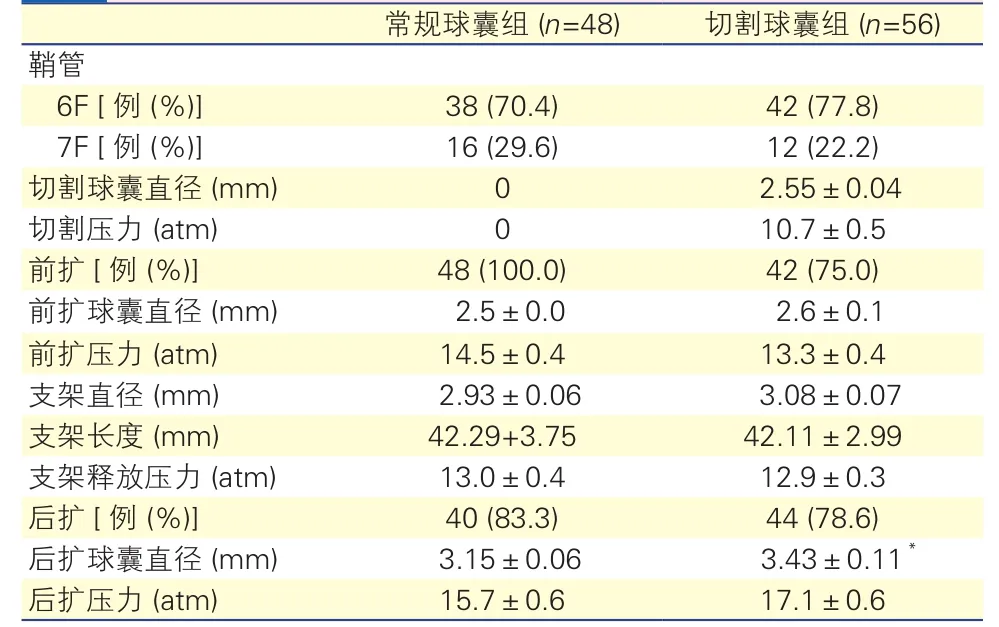
表3 两组术中操作血管内超声资料
注:与常规球囊组比*P<0.05。 1 atm=101.325 kPa
常规球囊组 (n=48) 切割球囊组 (n=56)鞘管6F [例 (%)] 38 (70.4) 42 (77.8) 7F [例 (%)] 16 (29.6) 12 (22.2)切割球囊直径 (mm) 0 2.55±0.04切割压力 (atm) 0 10.7±0.5前扩[例 (%)] 48 (100.0) 42 (75.0)前扩球囊直径 (mm) 2.5±0.0 2.6±0.1前扩压力 (atm) 14.5±0.4 13.3±0.4支架直径 (mm) 2.93±0.06 3.08±0.07支架长度 (mm) 42.29+3.75 42.11±2.99支架释放压力 (atm) 13.0±0.4 12.9±0.3后扩[例 (%)] 40 (83.3) 44 (78.6)后扩球囊直径 (mm) 3.15±0.06 3.43±0.11*后扩压力 (atm) 15.7±0.6 17.1±0.6
2.3两组支架置入后复查血管内超声资料
切割球囊组最小支架面积、即刻管腔获得及即刻管腔获得率均大于常规球囊组,差异均有统计学意义(P均<0.05)。两组支架膨胀率、支架对称性、血管丢失和血管夹层,差异均无统计学意义(P均>0.05)。表4
表4 两组支架置入后复查血管内超声资料
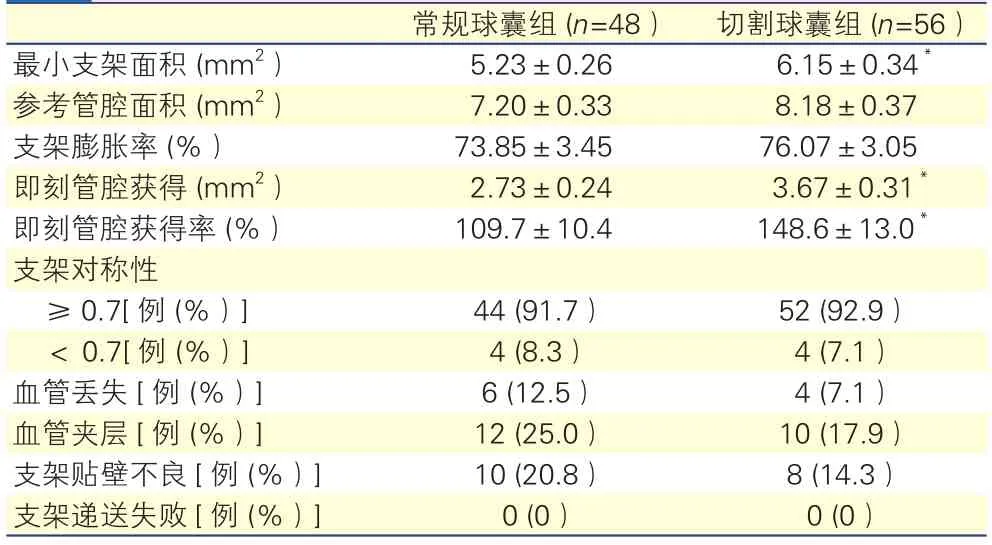
表4 两组支架置入后复查血管内超声资料
注:与常规球囊组比*P<0.05
组 (n=56)最小支架面积 (mm2) 5.23±0.26 6.15±0.34*参考管腔面积 (mm2) 7.20±0.33 8.18±0.37支架膨胀率 (%) 73.85±3.45 76.07±3.05即刻管腔获得 (mm2) 2.73±0.24 3.67±0.31*即刻管腔获得率 (%) 109.7±10.4 148.6±13.0*支架对称性≥0.7[例 (%)] 44 (91.7) 52 (92.9)< 0.7[例 (%)] 4 (8.3) 4 (7.1)血管丢失[例 (%)] 6 (12.5) 4 (7.1)血管夹层[例 (%)] 12 (25.0) 10 (17.9)支架贴壁不良[例 (%)] 10 (20.8) 8 (14.3)支架递送失败[例 (%)] 0 (0) 0 (0)
2.4两组1个月、6个月随访结果
两组1个月随访率均为100%,常规球囊组有1例(2.1%, 1/48)行靶血管血运重建。常规球囊组和切割球囊组6个月随访率分别为94%(45/48)与95%(53/56),6个月总的MACE分别占2.2%(1/45)与1.9%(1/53),靶血管血运重建两组各为1例,差异均无统计学意义(P均>0.05)。
3 讨论
既往大部分研究冠状动脉钙化的研究多依据钙化弧度定义钙化程度,2011年Hsu 等[7]首次提出钙化长度比这一概念,并提出钙化长度也是影响PCI术预后的因素。本研究两组的平均钙化弧度分别为(228.2±16.6)°与(238.9±19.4)°,平均钙化长度比分别为0.70±0.05与0.78±0.05。
支架置入前血管内超声基线资料表明,两组缺血相关血管最小管腔面积及参考段管腔面积差异未见统计学意义,支架置入后切割球囊组最小支架面积以及即刻管腔获得率明显高于常规球囊组,表明利用切割球囊处理高度钙化病变,对于支架良好膨胀是有效果的。Song等[8]有关预测药物支架术后支架内再狭窄的最小支架面积的研究中初步认为,在西罗莫司涂层支架术后,预测再狭窄的最小支架面积的临界值为5.5 mm2,佐他莫司涂层支架为5.3 mm2,依维莫司涂层支架为5.4 mm2,三种药物支架的临界值相似。本研究中常规球囊处理后的支架最小面积为(5.23±0.26)mm2,切割球囊组的支架最小面积平均值为(6.15±0.34)mm2。提示切割球囊处理重度钙化病变可能会减少支架内再狭窄的发生,但是尚需进一步的随访证实。
本研究切割球囊组中有42例在使用切割球囊后,又使用常规球囊对病变进行充分预扩,此部分预扩所选球囊尺寸及扩张压力与常规球囊组相比差异无统计学意义。常规球囊组中有40例使用了后扩,切割球囊组中44例使用后扩,切割球囊组中后扩球囊尺寸选择以及后扩压力大于常规球囊组。既往研究表明,切割球囊对于斑块的作用主要是切割与挤压,而不是血管壁的扩张,Hara等[9]的研究发现在球囊即刻扩张后血管内超声测量表明,切割球囊组的最小管腔与常规球囊组并无差异,但是斑块负荷与外弹力膜面积都小于常规球囊组。切割球囊的作用主要是裂解斑块,改变斑块结构,而普通球囊主要通过对斑块的挤压。本研究提示,在重度钙化病变,使用切割球囊使钙化环断裂,置入支架后给预充分后扩可以获得有效的管腔面积。
2011年美国AHA冠状动脉经皮介入治疗指南指出[10],对于重度钙化及纤维化病变,旋磨术做为Ⅱa类推荐证据,但目前上市的旋磨头尺寸为(1.25~2.75)mm,在中国最大尺寸为1.75 mm。且较大的旋磨头会使转速下降,目前研究并不提倡使用大的旋磨头[11],因此对于较大的管腔会存在旋磨不充分,不能触到血管壁的情况,且旋磨的费用较贵。指南推荐切割球囊用于支架内再狭窄及分支开口病变,现在随着药物洗脱支架对裸金属支架的逐步替代,支架内再狭窄的发生率降低,而我国人口高龄化的现象,使冠状动脉重度钙化的发生率增加。本研究表明切割球囊用于重度钙化病变的介入治疗与常规球囊相比,取得了良好的效果,显著增加支架置入后的最小管腔面积与即刻管腔获得率。提示在重度钙化病变中,可以考虑使用切割球囊配合常规球囊以达到良好的管腔获得。
由于本研究为单中心,样本量有限,进一步大规模的临床研究及更长时间的随访尚待进行以进一步证实此结果。
[1] Kawaguchi R, Tsurugaya H, Hoshizaki H, et al. Impact of lesion calcification on clinical and angiographic outcome after sirolimuseluting stent implantation in real-world patients. Cardiovasc Revasc Med, 2008, 9: 2-8.
[2] Huang ZY, Qian JY, Ge JB. Very late stent thrombosis due to multiple stent fracture and stent malapposition. Chin Med J (Engl), 2013, 126: 186-189.
[3] Maurovich-Horvat P, Christopher L, Alkadhi H, et al. Differentiation of Early from Advanced Coronary Atherosclerotic Lesions: Systematic Comparison of CT, Intravascular US, and Optical Frequency Domain Imaging with Histopathologic Examination in ex Vivo Human Hearts1. Radiology, 2012, 265: 393-401.
[4] Albiero R, Silber S, Di Mario C, et al. Cutting balloon versus conventional balloon angioplasty for the treatment of in-stent restenosis. J Am Coll Cardiol, 2004, 43: 943-949.
[5] Ajaui AE, Kim HS, Castagna M, et al. Clinical utility of the cutting balloon. J Invasive Cardiol, 2001, 13: 554-557.
[6] 陈纪林,高润霖,高立建,等. 应用切割球囊预扩张后置入金属裸支架治疗冠状动脉开口病变的4年临床随访. 中国循环杂志, 2007, 22:408-410.
[7] Hsu JT, Kyo E, Chu CM, et al. Impact of calcification length ratio on the intervention for chronic total occlusions. Int J Cardiol, 2011, 150: 135-141.
[8] Song HG, Kang SJ, Ahn JM, et al. Intravascular ultrasound assessment of optimal stent area to prevent in-stent restenosis after zotarolimus-, everolimus- and sirolimus-eluting stent implantation. Catheter Cardiovasc Interv, 2012, 19. [Epub ahead of prit]
[9] Hara H, Nakamura M, Asahara T, et al. Intravascular ultrasonic comparisons of mechanisms of vasodilatation of cutting balloon angioplasty versus conventional balloon angioplasty. Am J Cardiol, 2002, 89: 1253-1256.
[10] Levine GN, Bates ER, Blankenship JC, et al. 2011 ACCF/AHA/ SCAI Guideline for Percutaneous Coronary Intervention. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions. J Am Coll Cardiol, 2011, 58: e44-e122.
[11] 叶慧明,卢明瑜,王伟民,等. 冠状动脉旋磨术联合药物洗脱支架治疗冠状动脉严重钙化病变的临床研究. 中国循环杂志,2012,27: 258-261.
Efficacy and Safety Evaluation on Cutting Balloon Angioplasty for Treating the Patients With Severe Coronary Calcification Lesions Under Intravascular Ultrasound Guidance
TANG Zhe, BAI Jing, WANG Yu, SU Shao-ping, MA Qing-hua, LIU Mo-han, TIAN Jin-wen, GAO Lei, SONG Kang-xing, LI Yan-hua.
Department of Geriatric Cardiology, Chinese PLA General Hospital, Beijing (100853), China Corresponding Author: WANG Yu, Email: wangyuheart@yeah.net
Objective: To evaluate the efficacy and safety on cutting balloon angioplasty for treating the patients with severe coronary calcif i cation lesions under intravascular ultrasound (IVUS) guidance.Methods: A total of 110 consecutive patients with at least 1 severe coronary calcification lesion confirmed by coronary angiography and IVUS in our hospital from 2012-03 to 2013-03 were studied. The patients were divided into 2 groups. General balloon (BA) group, n=54 and Cutting balloon (CB) group, n=56. IVUS was performed before and after percutaneous coronary intervention (PCI) to observe the operational characteristics and to evaluate the immediate eff i cacy with complications. The MACE for in-hospital, 1 month and 6 months after PCI were recorded in all patients.Results: Before PCI, the mean ratio of calcif i cation arc to length and the minimum lumen area were similar between 2 groups, P>0.05. After PCI, compared with BA group, CB group showed larger minimum lumen area and larger immediate lumen gain area, P<0.05. The occurrence of post PCI dissection, vessel losing and the in-hospital, 1 month and 6 months post PCI MACE were similar between 2 groups, P>0.05.Conclusion: The cutting balloon angioplasty could effectively increase the post PCI lumen gain without increasing the complication in patients with severe coronary calcif i cation lesions.
Coronary calcification; Cutting balloon angioplasty; Intravascular ultrasound; Percutaneous coronary intervention
2013-06-24)
(编辑:王宝茹)
中国人民解放军总医院苗圃基金(基金编号:13KMZ02)
100853 北京市,中国人民解放军总医院 老年心血管病研究所(汤喆、白静、王禹、刘谟焓、田进文、高磊、宋康兴、李彦华),门诊部(苏绍萍);山东省临沂市沂水中心医院 心血管内科(马清华)
汤喆 住院医师 硕士 研究方向为冠状动脉钙化病变影像学表现、临床干预以及预后 Email: 1988612tz@sina.com
王禹Email:wangyuheart@yeah.net**为共同第一作者△为共同通讯作者
R54
A
1000-3614(2014)01-0012-04
10.3969/j.issn.1000-3614.2014.01.005
方法:自2012-03至2013-03在我中心行冠状动脉造影及血管内超声检查的至少有一处病变为重度钙化的110例冠心病患者,随机分为常规球囊组54 例及切割球囊组56例。在支架置入前及置入后均行血管内超声检查,观察术中操作特征,评价支架置入即刻效果及术中即刻并发症。观察记录患者院内、术后1个月和6个月的主要不良心脏事件。
结果:两组支架置入前钙化弧度、钙化长度比、最小管腔面积,差异均无统计学意义(P>0.05)。切割球囊组支架置入后最小支架面积、即刻管腔获得面积均大于常规球囊组,差异均有统计学意义(P<0.05)。两组术后出现夹层及血管丢失的比例,差异无统计学意义(P>0.05)。两组院内及术后1个月和6个月的主要不良心脏事件,差异无统计学意义(P>0.05)。
结论:在重度钙化病变中使用切割球囊可以有效增加支架置入后的管腔获得,未见介入相关并发症明显增加。
