辣椒素酯类物质研究进展
2013-12-23辛嘉英张超越陈林林
辛嘉英,王 艳,张超越,陈林林
(1.哈尔滨商业大学,黑龙江省高校食品科学与工程重点实验室,黑龙江 哈尔滨 150076;2.中国科学院兰州化学物理研究所,羰基合成与选择氧化国家重点实验室,甘肃 兰州 730000)
辣椒素酯类(capsiate)物质,是20世纪80年代末从日本的一种甜椒品种中分离得到的一种结构类似辣椒素的酯类物质(图1),生物活性与辣椒素类似[1-2],动物实验表明它具有促进能量代谢、增强肌体免疫功能等作用,细胞毒性比辣椒素低,有替代辣椒素的广阔应用前景,特别是由于它无辣味,在增加实验鼠的儿茶酚胺分泌、促进能量代谢、抑制体内脂肪积累方面有替代辣椒素类物质的巨大潜力,因此越来越受到人们的青睐[3-11]。
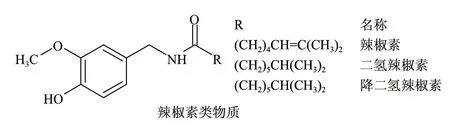
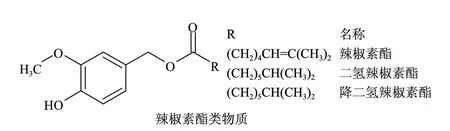
图 1 辣椒素类物质和辣椒素酯类物质的结构Fig.1 Structures of capsaicinoids and capasinoids
1 辣椒素酯类物质合成的研究进展
国外关于辣椒素酯类物质的研究最早始于日本,而目前具有一定意义的研究成果也大部分来自于日本,俄罗斯的研究者Edmundo等[12]也于2007年开始对辣椒素酯类物质进行研究,而在我国最早进行辣椒素酯类物质研究的是董新荣[13-14]、李雨虹[15]等,对丙酮中化学-脂肪酶法催化辣椒素与香草醇合成辣椒素酯类物质及其生物活性进行了研究,在开发新型用于辣椒素酯类物质合成的脂肪酶上也作出了一定的贡献。
1.1 辣椒素酯类物质化学合成的研究进展
当香草醇(vanilly alcohol)与相应的辣椒素的脂肪酸形成的酯类化合物被定义为辣椒素酯类物质(capsinoids)后,Kobata等[1]为了确认其结构,进行了二氢辣椒素的化学合成研究。首先8-甲基壬酸与SOCl2作用转化为酰氯,再与香草醇在吡啶介质中反应,生成的产物用硅胶柱色谱法进行纯化的目标化合物,收率为36.8%。Kouzou等[16]为了研究辣椒素酯类化合物在不同有机溶剂中的稳定性,用同样的方法合成了包括壬酸香草醇酯等的辣椒素酯类化合物及其衍生物。主要合成通式如图2所示。
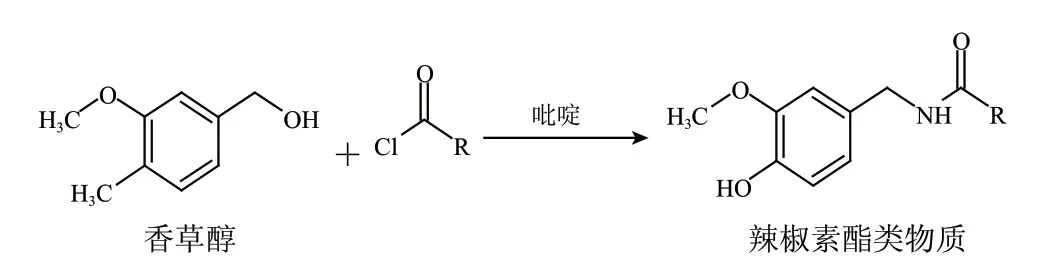
图 2 辣椒素酯类物质的化学合成路线Fig.2 Route of chemical synthesis of capasinoids
1.2 辣椒素酯类物质酶催化合成的发展历程
Hideshi等[17]于1980年,首次从酶催化的角度进行辣椒素酯类物质生物合成的研究,在酶催化香草胺与C9~C11的脂肪酸合成辣椒素酯类物质中酶的催化特性和从辣椒细胞中分离出来的酶对不同链长的脂肪酸的催化活性等方面进行了研究。他们的研究成果为进一步研究酶催化辣椒素的酯类物质的合成奠定了必要的理论基础并提供了可靠的技术指导。使由酶直接催化合成辣椒素酯类物质成为可能,但此项技术并没有迅速发展起来,直到1996年才有了进一步的研究成果。辣椒素酯类物质的酶催化合成主要是通过用不同碳链长度的脂肪酸(C4~C16)将辣椒素上的酰胺键替换成相应的酯键而获得的一类物质。还包括将取代芳香环上的—OH和—OCH3取代后而获得的一系列物质[18]。
1996年,Kobata等[19]用牛肝的丙酮干粉催化香草胺的卤化物和一些脂肪酸合成没有辛辣味的辣椒素类似物。此研究进一步证实辣椒素的类似物可以通过酶催化的方法合成,为生物合成辣椒素酯类物质开拓了新的研究方向。1998年,该研究组[20]研究发现一些脂肪酶可以催化香草胺和脂肪酸反应生成辣椒素酯类物质,而且催化活性较好,其中较为适宜的是Lipase PS和Novozym 435两种脂肪酶,同时也对不同碳链的脂肪酸对产量的影响进行了研究,14个碳的脂肪酸的产量最高。此研究为生物合成辣椒素酯类物质找到了较为理想的催化剂,是脂肪酶催化天然辣椒素酯类物质的生物合成的开端。在此之后,更多研究者开始对酶催化反应的反应机理进行深入研究。Dolores等[21]于2000年发现辣椒素可以在一定条件下通过酶催化发生水解反应,水解成香草胺和8-甲基-6-壬酸。并通过实验发现脂肪酶Novozym 677 BG和Novozym 435、酯酶、胰蛋白酶和青霉素酰化酶都可以使辣椒素发生不同程度的水解,但在Novozym 435的催化下辣椒素的转化率最高。此发现为研究者之后将辣椒素转酯化成辣椒素酯类物质提供了参考,将辣椒素酯类物质合成的关注点由酶催化酯化合成转移到了酶催化转酯化合成上,使得辣椒素酯类物质的合成产生了许多具有突破意义的研究成果。2001年,Hiroki等[22]用化学-酶法进行离子液中辣椒素与糖基反应生成辣椒素糖类物质的研究,首先是辣椒素在离子液中,在有乙氰、碳酸钾和甲醇存在的条件下与四乙酰-α-D-葡萄糖氟化物经化学反应生成辣椒素-β-D-吡喃葡萄糖苷,之后辣椒素-β-D-吡喃葡萄糖苷在有氯化钙存在和环糊精葡聚糖转移酶的催化下与淀粉发生糖基化反应生成辣椒素低聚糖类物质。该类物质不仅保留了辣椒素的一些生物活性而且水溶性的提高使其更易于人体消化吸收,生物活性和药理作用更易于发挥,使得辣椒素糖基类物质更适合在食品和医药行业上应用,从而大大提高了其应用价值。2002年,Kobata等[23]以脂肪酶为催化剂,以脂肪酸甲酯与香草醇在二氧六环的500μL反应体系中通过酯交换合成了包括脂肪酸链为C6/C9/C14/C18的一系列类似化合物,产物最终以制备型高效液相色谱纯化,收率达到59%~77%。在取得酶催化的合适反应条件后,再以化学-酶法进行了天然辣椒素转化为天然辣椒素酯的实验研究,也就是先用甲醇醇解辣椒素,醇解后获得的相应脂肪酸再由脂肪酶催化与香草醇发生酯化反应生成目标产物辣椒素酯类物质。2007年,Edmundo等[12]研究出了一条新型的辣椒素酯类物质的合成途径,即正己烷中脂肪酶催化辣椒素酯类物质的一步合成法(图3),此方法是完全由一种脂肪酶催化的生物合成法,在整个过程中辣椒素并没有发生水解而是发生了醇解反应,在脂肪酶的催化下辣椒素分解释放出香草胺后剩余的部分与脂肪酶形成了酶-酰基复合物,之后该复合物再与香草醇发生转酯化反应生成辣椒素酯类物质并释放出酶,从而完成整个反应。该方法省去了辣椒素用化学法甲醇醇解的工艺流程,避免了化学-酶法合成辣椒素酯类物质的一些弊端(无有机溶剂的引入、节能、减少污染等),简化了合成工艺。同年,Edmundo等[18]在之前的研究基础上,通过改变酰基供体的链长和芳香环上的取代基来进一步研究辣椒素酯类物质的脂肪酶催化合成,通过研究发现辣椒素的酯类物质的初始合成速率与酰基供体的链长无关而与芳香环的取代基有关。

图 3 辣椒素酯类物质的一步合成路线(醇解)Fig.3 Route of one-step synthesis of capasinoids
2010年,Kohji等[24]通过改变条件使辣椒素的水解与酯类物质的合成在一个体系内,在一种脂肪酶的催化下完成。也就是辣椒素在脂肪酶的催化下发生水解生成香草胺和相应的脂肪酸,辣椒素相应的脂肪酸部分再与香草醇在同一脂肪酶的催化下合成了辣椒素的酯类物质,如图4所示。

图 4 辣椒素酯类物质的一步合成路线(水解)Fig.4 Route of one-lipase catalyzed synthesis of capasinoids
2011年,刘绍等[25]对脂肪酶Novo435在丙酮介质中催化香草醇与壬酸甲酯合成辣椒素酯的反应动力学特性进行了研究,建立了动力学方程。在催化反应过程中,甲醇生成对酶催化反应的速率有一定的抑制作用。本反应中甲醇的最大生成量为0.45mol/L,对合成反应速率的抑制约为20%。实验中发现香草醇在丙酮中的最大溶解度是0.7mol/L,产物的转化率为65%,因此提出通过对香草醇进行修饰提高其溶解度的方法来提高辣椒素酯类产物的浓度。
1.3 生物合成途径的研究进展

图 5 辣椒素酯类物质的化学-酶法合成路线Fig.5 Route of chemical-enzymatic synthesis of capasinoids
目前,生物合成辣椒素酯类物质有3种途径,包括化学-酶法合成途径、酶水解-酶法合成途径和酶催化转酯化一步反应合成途径。
化学-酶法合成途径[26],是首先将辣椒素用化学法进行甲醇醇解生成香草胺和与辣椒素相应的脂肪酸,这相应的辣椒素的脂肪酸在脂肪酶的催化下与香草醇发生酯化反应合成辣椒素酯类物质,合成工艺如图5所示。
酶水解-酶法合成途径[18],是反应所用的酶既可以使辣椒素发生水解反应(A),同时也可以催化辣椒素相应的脂肪酸与香草醇发生酯化反应(B),首先是辣椒素(1)在脂肪酶的作用下发生水解,生成香草胺(2)和辣椒素相应的脂肪酸(3),后者再与香草醇(4)发生酯化反应生成辣椒素酯类(5)物质,合成工艺如图6所示。可以看出,反应体系中含水量高利于A反应,而低含水量才利于B反应,因此采用合理的方法有效控制反应体系中的含水量是反应朝目标反应进行的关键。
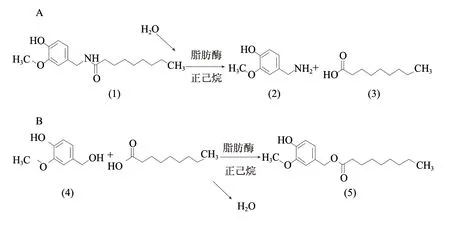
图 6 辣椒素酯类物质的酶水解-酶法合成路线Fig.6 The route of enzymatic hydrolysis-enzymatic synthesis of capasinoids
酶催化转酯化一步反应合成途径(enzymatic transacylation one-pot strategy)[12],是辣椒素在脂肪酶的作用下发生转酯化反应,生成酶-辣椒素相应的脂肪酸酯复合物(EF complex)并释放出香草胺,生成的EF complex在酰基受体香草醇存在条件下再次酯交换生成辣椒素酯类物质并释放出游离酶,合成工艺如图7所示。
这3种途径中,化学-酶法途径是最早研究出来的也是目前应用较为广泛的一种方法,而且其在40h内的转化率则可高达80%以上,但是化学醇解过程的反应条件要求较为严格,而且有机溶剂和加热回流等一系列操作不仅使反应工艺变得繁琐,同时也增加了成本,对环境也造成了污染。而酶水解-酶法合成途径和酶催化转酯化一步反应机制合成途径的主要区别就在于体系内水活度不同,前者需要在一个较为适宜的水活度的条件下才能够达到理想的效果,而后者则是在绝对低水活度的条件下才能实现。除了水活度的条件不同以外,其他的反应条件基本相似,但酶水解-酶法合成途径的反应效果要优于酶的乒乓机制合成途径,前者的转化率在35h内高达60%以上,而后者在80h的转化率仅为前者的一半左右。
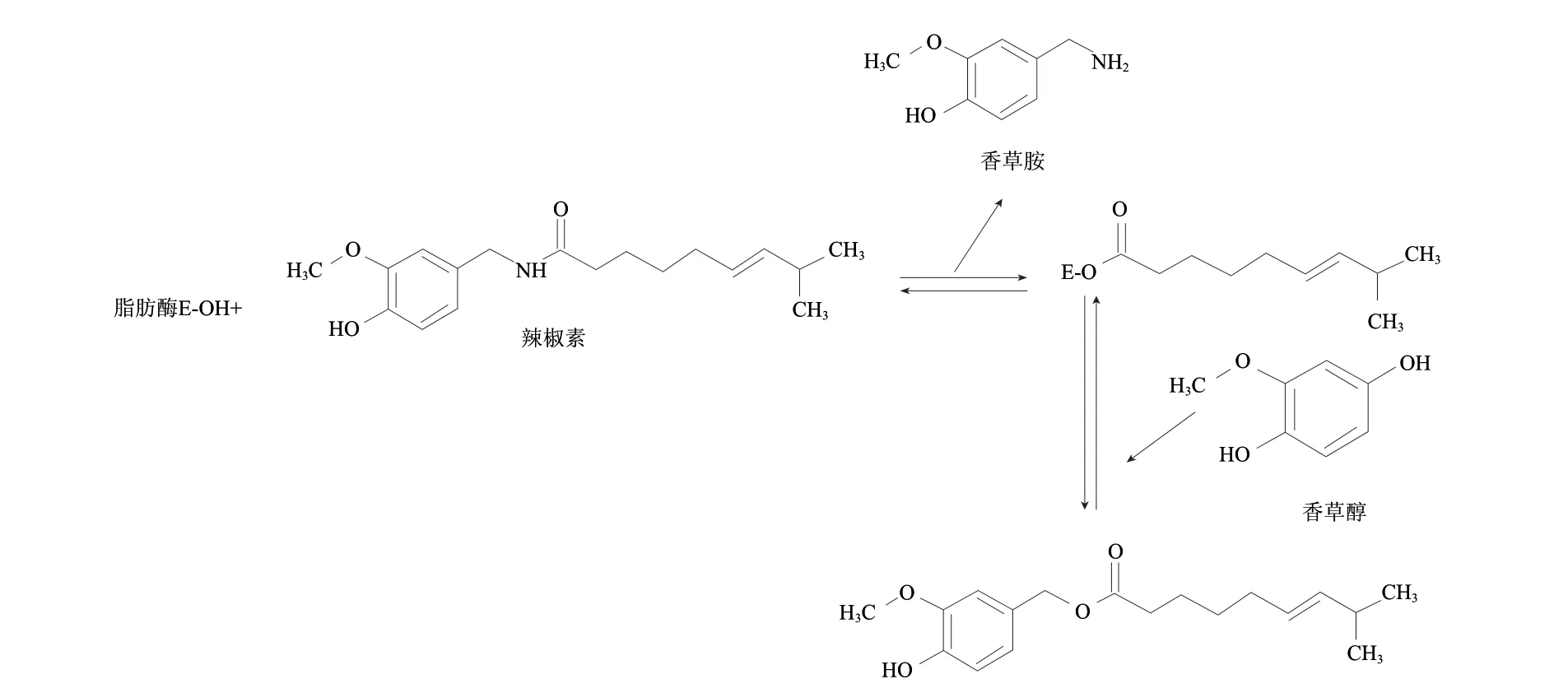
图 7 辣椒素酯类物质的酶催化转酯化一步反应合成路线Fig.7 Route of enzymatic transacylation one-step synthesis of capasinoids
1.4 辣椒素酯类物质的分析方法
无论是从辣椒中提取出来的辣椒素酯类物质还是用现有的3种合成途径合成的辣椒素,都要经过纯化,定性、定量以及化学结构的分析。目前,一般都采用硅胶柱层析法进行纯化,高效液相色谱法进行定性和定量分析,而化学结构则要通过1H NMR和13C NMR以及气质两用技术进行测定[22-24]。
1.4.1 硅胶柱层析纯化条件的研究进展
硅胶柱色谱法纯化起初是从辣椒素的纯化研究借鉴来的,主要的纯化条件是由Kobata等[1]研究得出并一直沿用至今,基本方法条件如下:硅胶G板的制作:将1g左右硅胶G慢慢地加入2mL水中调成糊状,边加边搅拌。然后将调好的浆料倒在玻璃板上,用手左右摇晃,使表面均匀光滑。最后将薄层板放于平台上晾干,于烘箱中110℃活化1h后放置干燥器中备用。展开剂为体积比4∶1的石油醚-乙酸乙酯,上行展开,挥干溶剂后碘蒸气显色[1,16,25]。
1.4.2 HPLC分析条件的研究进展

表 1 HPLC分析条件对比表Table 1 Comparison of analysis conditions for HPLC
1.4.3 GC分析条件的研究进展
气相色谱一般与质谱仪联用,而目标产物的结构通常通过1H NMR和13C NMR来进行分析和确定。气相色谱的主要分析条件也是由日本的Kobata等[1]确定并一直被其他研究者使用。主要分析条件为:HP-innowax毛细管;气化室温度为280℃,紫外检测器,检测器温度为280℃;氢气压力为0.05MPa,空气压力为0.01MPa,柱头压力为0.055MPa;柱温为130℃停留0.5min,然后以2℃/min的升温速度至138℃,15℃/min升至240℃[23-28]。
1.4.41H NMR和13C NMR对辣椒素酯类物质的结果分析[15,19]
用CDCl3溶解待测物,以TMS为内标,1H NMR在399.65MHz而13C NMR在100.40MHz的条件下进行测定。1HNMR谱表明,分子中存在香草基[苯环,6.88(3H, m);酚羟基,5.74(1H, s, b);亚甲基,5.03(2H, s);甲氧基,3.89(3H, s)]及酯类化合物的酰基脂肪链[COCH2,2.33(2H, t);COCCH2,1.63(2H,m);脂肪链CH2x5,1.26(10H, m);脂肪链末端CH3,0.87(3H, t)]。13CNMR谱表明分子中存在香草基(146.4、145.6、127.9、122.0、114.3、111.2为苯环的6C;66.3为ph-CH2-OCO的C;55.8为OCH3的C)及酯类化合物的酰基脂肪链(173.9,C=O;34.3、31.8、29.2、29.1(2C)、24.9、22.6,归属为脂肪链CH2x7;14.1,脂肪链末端CH3),脂肪酰基部分共含有9个碳原子。李雨虹等[12]也利用了紫外分光光度法和红外光谱法对辣椒素酯的结构进行了分析。紫外光谱233nm及28lnm的吸收峰分别为苯环的K及B带吸收。IR光谱3440cm-1吸收为v(Ar单键OH)伸缩振动;1736cm-1吸收为v(C双键O)伸缩振动;1608、1518cm-1吸收为苯环v(C双键C)伸缩振动;1238、1034cm-1吸收为酯键v(C单键O单键C)振动。
1.5 辣椒素酯类物质的生物活性
关于辣椒素酯类物质的生物活性的研究,自从Yazawa等[29]报道了辣椒素酯类物质以来,人们就开始进行了研究。多年的研究表明,它虽然没有辣椒素的辛辣味和细胞毒性,但具有辣椒素类似的生物活性,主要有加强能量代谢、抑制肥胖方面的作用,同时还具有增强免疫系统功能、增强运动忍耐力和止痛等作用。
1994年,Watanabe等[3]报道了辣椒素酯类物质与辣椒素一样具有增强肾上腺儿茶酚胺的分泌作用,因而展现出促进脂肪代谢、抑制肥胖的作用。2001年,Ohnuki等[30]在活鼠实验中发现辣椒素酯类物质可以使小鼠的体温升高。在进一步的研究中发现,辣椒素酯类物质具有辣椒素所没有的促进能量代谢和抑制脂肪积累的作用。他们给5周龄雄性Std ddy鼠以5mL/kg体质量的计量喂食以CH-19 Sweet果肉制成的2g果肉/mL的液体样品,每天3次。同时以含Capsaicin量高的辣椒和不含Capsaicin同时也不含capsiate的辣椒样品进行对照实验。30min后喂食含Capsaicin或Capsiate辣椒老鼠的体温明显高于对照组。2001年,加藤正俊等[31]对辣椒素酯类物质作为镇痛剂以及在食品与饲料添加剂的应用等方面进行了研究。研究表明辣椒素酯类物质与辣椒素一样具有镇痛作用。研究结果显示,以30mg/kg体质量的计量用药30min后具有明显的镇痛效果,2h后效果达到最佳,药效可持续8h。2003年,Iida等[9]研究了辣椒素酯类物质对辣椒素受体(transient receptor potential vanilloid1,TRPV 1)的激活作用及伤害性反应的诱导作用,结果显示,辣椒素酯类物质与辣椒素一样,能短暂激活HEK293细胞中TRPV 1的表达,相同的是在皮下注射时能诱导老鼠的伤害性反应,不同的是,辣椒素酯类物质对表皮、眼睛或口腔没有明显的刺激作用,因此辣椒素酯类物质是直接作用于神经末稍而表现药效的。2007年,Edmundo等[18]研究了辣椒素酯类物质的结构与淀粉酯类物质辛辣刺激性之间的关系。研究结果表明,当脂肪酸的碳链长度为C8和C10时所合成的辣椒素类似物还保留了66%和36%的辛辣刺激性。然而,当碳链长度为C6和C12时所合成的辣椒素类物质仅保留了2.1%和1.2%的刺激性。这说明辣椒素酯类物质的碳链长度与其辛辣刺激性有很大关系。2009年,郭时印[32]对辣椒素类物质的抗疲劳性和机理进行了深入研究。以6~15mg/kg的计量给小鼠灌胃辣椒素类物质,每8h给小鼠灌胃一次,持续28d。28d后小鼠的体重质量无明显变化但小鼠的爬杆和力竭游泳时间得到显著延长,抗缺氧的能力明显提高。同时具有抑制运动后血乳酸和血尿素氮的生成和维持运动后小鼠肝脏和肌肉组织内糖原的含量的作用,具有很好的抗运动疲劳的作用。2010年,Eun等[33]研究发现,辣椒素酯类物质可以抑制紫外线引起的灼烧感。将其涂抹在皮肤的角质层上抑制了细胞间氧的活性,而这些活性氧是细胞分裂、蛋白激酶和细胞核κB因子的激活剂,因此辣椒素可以抑制紫外线引起的灼烧感的这种生物活性,就是通过这种途径起到作用的。2010年,Miyako等[34]研究发现,辣椒素酯类物质同辣椒素一样具有使触发吞咽反射加快的功能,吞咽困难是由吞咽反射延迟引起的,是吸入性肺炎的主要症状,一般年老者常患有这种疾病。由于辣椒素具有辛辣味和一定的刺激性,不利于作为药用和老年人及患有呼吸性疾病的人食用,因此大大限制了辣椒素在这方面生物活性上的应用,而辣椒素酯类物质则可以替代辣椒素很好地展现这一生物活性的应用价值。
多年来的研究使得辣椒素酯类物质的生物活性方面不断被发掘,不仅在某些生物活性上其是辣椒素7的一种很好的替代品,而且也具有一些辣椒素所没有的生物活性。它是一种很有开发潜力的食品辅助剂、药品中主要药效成分和化妆品的功能性成分。
2 结 语
关于辣椒素酯类物质的研究始于20世纪80年代,虽然取得了一定的成果,但该项研究的发展速度较慢,研究内容也比较局限。多年来,该领域的研究一直停留在利用脂肪酶在有机溶剂(正己烷和二氧六环)体系中进行辣椒素酯类物质的合成。因此辣椒素酯类物质的转化率较低、反应时间较长、不易于工业化生产仍是研究者们要继续解决的问题。随着生物技术手段的不断发展,将来人们不仅要在开发新的可以应用的酶和有机溶剂上进行深入研究,也可以通过更多生物技术手段的应用来解决尚存的问题,其中无溶剂体系、拟低共溶体系、超临界二氧化碳和离子液体等一些新技术都具有很大发展前景,这些技术的理论基础扎实,技术较为完善,并且适用于酯化和转酯化反应,必定是将来辣椒素酯类物质研究的发展方向。
基于辣椒素酯类物质不仅具有多种生物活性而且没有辛辣味和细胞毒性,其可能是食品和药品理想的添加剂。目前辣椒素酯类物质的应用面较广,需求量与日剧增,目前是一种供不应求的存在状态。因此,有关辣椒素酯类物质的研究与开发,产品的实际应用与生产的工业化等方面的研究将具有较大的发展前景和深远的研究意义。
[1] KOBATA K, TODO T, YAZAWO S, et al. Novel capsaicinoidlike, capsiate and dihydrocapsiate, from the fruits of nonpungent cultivar, CH-19 sweet, of pepper(Capsicum annuun L.)[J]. Journal of Agricultural and Food Chemistry, 1998, 46(5): 1695-1697.
[2] KOBATA K, UTOH K, TODO T. Nordihydrocapsiate, a new capsinoid from the fruits of a non pungent pepper, Capsicum annuun[J]. Journal of Natural Products, 1999, 62(2): 335-336.
[3] WATANABE T, KAWADA T, KATO T, et al. Effeets of capsaicin analogs on adrenal catecholamine secretion in rats[J]. Life Sciences, 1994, 54: 369-374.
[4] KOBAYASHI A, OSAKA T, NAMBA Y, et al. Capsaicin activates heat loss and heat production simultaneously and independently in rats[J]. American Journal of Physiology, 1998, 275(1): 92-98.
[5] KAWADA T, HAGIHARA I, IWAIK K. Effects of capsaicin on lipid metabolism in rats died a high fat diet[J]. Journal of Nutrition, 1986, 116: 1272-1278.
[6] YOSHIOKA M, MATSUO T, KIWON L, et al. Effects of capsaicin in abdominal fat and serum free-fatty acids in exercise-trained rats[J]. Nutrition Research, 2000, 20(7): 1040-1045.
[7] ANTONIO M, CONCEPCION L, ROCIO S, et al. Non-pungent capsicinods from sweet pepper synthesis and evaluation of the chemopreventive and anticancer potential[J]. European Journal of Nutrition, 2003, 42(1): 2-9.
[8] KOBATA K, TOYOSHIMA M, KAWAMURA M, et al. Lipasecatalyzed synthesis of capsaicin analogs using natural oils as an acyl donor[J]. Biotechnology Letters, 1998, 20(8): 781-783.
[9] IIDA T, MORIYAMA T, KOBATA K. TRPVl activation and induction of nociceptiver esponse by a non-pungent capsaicin-like compound, capsiate[J]. Meur, 2003, 44: 958-967.
[10] ANTONELLA R, MONIEA D, VIVIANA C, et al. Antioxidant activity of capsinoids[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7396-7401.
[11] 狄云, 蒋健箴, 石正强, 等. 辣椒果实成熟过程中辣椒素的降解[J]. 食品科学, 2000, 21(6): 19-22.
[12] EDMUNDO C, IGNACIO L G, RUBEN D R, et al. Enzymatic synthesis of capsaicin analogs and their effect on the T-type Ca2+channels[J]. Alberto Darszon Biochemical and Biophysical Research Communications, 2007, 356: 424-430.
[13] 董新荣, 刘仲华, 杨建奎, 等. 辣椒素类物质的化学研究进展[J]. 天然产物研究与开发, 2004, 16(5): 486-489.
[14] 董新荣, 刘仲华, 李雨虹, 等. 天然辣椒素酯的酶促合成与生物活性[J]. 天然产物研究与开发, 2009, 21(4): 570-573.
[15] 李雨虹, 董新荣, 谢达平, 等. 辣椒素酯类物质的酶促合成[J]. 化学研究与应用, 2007, 4(19): 427-429.
[16] KOUZOU S, KENJI K, TATSTSUO W. Stability of capsinoid in various solvents[J]. Journal of Agricultural and Food Chemistry, 2001, 49(8): 4026-4030.
[17] HIDESHI F, TETSUYA S, SHINZABURO O, et al. Enzymatic formation of capsaicinoid from vanillylamine and iso-type fatty acids by cell-free extracts of Capsicum annuum var. annuum cv. Karayatsubusa[J]. Agricultural and Biological Chemistry, 1980, 44(12): 2907-2912.
[18] EDMUNDO C, ALEJANDRO T G, PATRICIA S, et al. Lipasecatalyzed synthesis of pungent capsaicin analogues[J]. Food Chemistry, 2007, 100: 1202-1208.
[19] KOBATA K, KOICHI Y, MASAHIRO K, et al. Enzymatic synthesis of capsaicin analogs with liver acetone powder[J]. Tetrahedron Letters, 1996, 37(16): 2789-2790.
[20] KOBATA K, MOBATA M K, MAKIKO T, et al. Lipase catalyzed synthesis of capsaicin analogs by amidation of vanmylamine with fatty acid derivatives[J]. Biotechnology Letters, 1998, 20(5): 451-454.
[21] DOLORES R D, EDMUNDO C, EDUARDO B, et al. Capsaicin hydrolysis by candida antarctica lipase[J]. Biotechnology Letters, 2000, 22: 1811-1814.
[22] HIROKI H, KANEHISA N, TSUTOMU F, et al. Preparation of a new pepper: chemoenzymatic synthesis of capsaicin oligosaccharide and 8-nordihydrocapsaicin oligosaccharide[J]. Journal of Molecular Catalysis B: Enzymatic, 2001, 16: 115-119.
[23] KOBATA K, MANAMI K, WATANABE T. Enzymatic synthesis of a capsinoid by the acylation of vanillyl alcohol with fatty acid derivatives catalyzed by lipases[J]. Bioscience Biotechnology Biochemistry, 2002, 66(2): 319-327.
[24] KOHJI I, SOONIL K, NORIYOSHI M, et al. One-procedure synthesis of capsiate from capsaicin by lipase-catalyzed dynamic transacylation[J]. World Journal of Microbiol Biotechnol, 2010, 26: 1337-1340.
[25] 刘绍, 刘卉琳, 董新荣, 等. 丙酮介质中辣椒素酯的酶催化合成动力学研究[J]. 分子催化, 2011, 25(3): 276-180.
[26] 李雨虹. 有机相中脂肪酶催化合成辣椒素酯的研究[D]. 长沙: 湖南农业大学, 2007.
[27] 杜庆鹏, 田金改, 隗秀荣. 高效液相色谱法测定温辣贴中辣椒素的含量[J]. 药物分析杂志, 2007, 27(9): 1428-1430.
[28] 张继敏, 陈文海, 肖东华. HPLC法测定辣椒风湿膏中辣椒素的含量[J]. 中医药信息, 2005, 22(2): 60-62.
[29] YAZAWA S, SUETOME N, OKAMOTO K, et al. Content of capsaicinoids and capsaicinoid-like substanes in fruit of pepper (Capsicum annuum L.) hybrids made with “CH-19 Sweet” as a parent[J]. Journal of the Japanese Society for Science, 1989, 58: 601-607.
[30] OHNUKI K, HARAMIZU S, WATANABE T. CH-19 Sweet, nonpungent cultivar of red pepper, increased body temperature in mice with vanilloid receptors stimulation by eapsiate[J]. Journal of Nutritional science and Vitaminology, 2001, 47: 295-298.
[31] 加藤正俊, 濑户口裕子. 新規なカプサイシノイド様物質を含有する鎮痛剤、食品及び飼料[N]. 公開特許公報(A), 2001-06-12.
[32] 郭时印. 辣椒素抗疲劳作用及其机理研究[D]. 长沙: 中南大学, 2009.
[33] EUN J L, MYUNG S J, BYUNG D K, et al. Capsiate inhibits ultraviolet b-induced skin inflammation by inhibiting Src family kinases and epidermal growth factor receptor signaling[J]. Free Radical Biology and Medicine, 2010, 48: 1133-1143.
[34] MIYAKO Y, SATORU E, TAKAE E, et al. Effects of capsiate on the triggering of the swallowing reflex in elderly patients with aspiration pneumonia[J]. Geriatrics Gerontology International, 2010, 10: 107-109.
