莲子红衣醇提物的抗氧化和抗褐变活性
2013-12-23高延芬
高 航,高延芬,徐 虹*
(北京工商大学,食品添加剂与配料北京高校工程研究中心,北京市食品风味化学重点实验室,北京 100048)
莲浑身是宝,特别是莲子,自古以来就是我国人民非常喜爱的药食佳品。研究证实莲子不仅营养丰富,而且含有多种活性成分如生物碱、多糖、多酚、原花青素、黄酮等,因而具有良好的生理功效[1-4]。随着生活水平的提高,人们对生活质量、身体健康有了更高的要求,特别是消费者对人工合成化学品安全性问题的关注,使得从天然产物中寻找可利用的酶抑制剂、自由基清除剂、氧化反应阻断剂等逐渐成为近年来的研究热点[5-6]。湖南湘潭地区为我国最大的产莲区。莲子的加工一般要经过干燥、分级、去壳、除衣、去心等工序,湘潭地区的莲子加工主要采用机械除衣的方式,这种生产方式损耗率较高,每加工100kg红莲,就会磨去约15kg红衣粉,只能得到约85kg白莲。目前这层红衣粉尚未得到有效的利用,由于味涩甚至不能作为牲畜饲料,只能大量的堆于田间地头,对环境造成污染。因此,本实验室选取莲子红衣粉为原材料,以60%乙醇为溶剂浸提活性物质并研究其抗氧化及抗褐变能力,以期为莲子加工后的副产物探索新的应用途径并提供理论依据。
1 材料与方法
1.1 材料与试剂
莲子红衣粉由三湘贸易公司提供;烟台红富士苹果购买自本地超市。
NaH2PO4·2H2O、Na2HPO4·12H2O、氯化钠、亚硝酸钠、氢氧化钠、硝酸铝、没食子酸(以上均为分析纯) 天津市光复科技发展有限公司;福林酚(化学纯) 北京普博欣生物科技有限责任公司;过硫酸钾、无水碳酸钠(均为分析纯)、L-酪氨酸(生化试剂) 国药集团化学试剂有限公司;无水乙醇(分析纯) 北京化工厂;L-多巴(L-DOPA)、芦丁(均为国家药品标准物质) 中国食品药品检定研究院;L-酪氨酸酶(1000U/mg)、抗坏血酸(VC) 美国Sigma公司;Trolox、ABTS、曲酸 英国Alfa Aesar公司。
1.2 仪器与设备
JA2003C电子天平 上海越平科学仪器有限公司; FE20实验室pH计 梅特勒-托利多仪器(上海)有限公司;HH-501超级恒温水浴(数显) 常州国华电器有限公司;DHG-9246A型电热恒温鼓风干燥箱 上海精密实验设备有限公司;22PCO2435可见分光光度计、SpectrumLab 53紫外-可见分光光度计 上海棱光技术有限公司;QL-901 VORTEX漩涡混匀器 海门市其林贝尔仪器制造有限公司;ADCI-60-C全自动测色色差计 北京辰泰克仪器科技有限公司;MODULYOD-230真空冷冻干燥机 美国热电公司。
1.3 样品的制备
莲子红衣粉(日照晒干,含水量为8.5%)过60目筛后,按料液比1:10(m/V)加入体积分数60%的乙醇溶液,在室温条件下超声浸提1h,浸提2次,离心后合并浸提液;40℃条件下,真空旋转蒸发,制得浓缩物后置真空冷冻干燥机中干燥,得干燥粗提物,4℃低温保存,备用。
1.4 总酚含量的测定[7-8]
标准曲线的建立:准确称取没食子酸0.100g,蒸馏水溶解并定容至100mL,分别移取0.00、1.00、2.00、3.00、4.00、5.00、10.00mL到7个100mL容量瓶中并用蒸馏水定容,即得到不同质量浓度的没食子酸标准溶液;准确移取没食子酸标准溶液0.1mL,加入到2mL质量浓度为20mg/mL的Na2CO3中,2min后,将0.9mL的福林酚试剂加入到混合物中,反应30min在750nm波长处测定吸光度;以没食子酸质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线。得回归方程:Y=511.32X+36.25(R2=0.9806)。样品测定:适当的加入量,使吸光度在0.2~0.8之间,具体步骤同上,进而通过回归方程得出没食子酸等价含量,即总酚含量。
1.5 总黄酮含量的测定[9-10]
标准曲线的建立:称取芦丁对照品10mg于50mL容量瓶中,加95%乙醇稀释至刻度,即得0.2mg/mL的对照品溶液;精密量取对照品溶液0.0、1.5、3.0、4.5、6.0mL,分别置于15mL具塞试管中,加5g/100mL亚硝酸钠溶液0.5mL,摇匀,放置6min,加10g/100mL硝酸铝溶液0.5mL,摇匀后放置6min,加1g/100mL氢氧化钠溶液6.7mL,用95%乙醇定容至刻度,摇匀,放置15min。以第一管做空白,510nm波长处测其吸光度;以芦丁质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得回归方程:Y=84.898X-0.8879(R2=0.9989)。样品测定:适当的加入量,使吸光度在0.2~0.8 之间,具体步骤同上,进而通过回归方程得出芦丁等价含量,即总黄酮含量。
1.6 ABTS+·清除活性[11-12]
ABTS工作液的配制:配制7mmol/L的ABTS储备液和140mmol/L的过硫酸钾(K2S2O8)溶液,然后取5mL的7mmol/L ABTS储备液和88μL的140mmol/L过硫酸钾溶液混合后得浓度为2.45mmol/L的ABTS储备液。再将该储备液在室温条件下避光储备12~16h。最后将生成的ABTS储备液用无水乙醇稀释,使其在室温、734nm 波长处的吸光度为0.70±0.02,即得到ABTS+·工作液。在试管中加入30μL的待测样品,再加入3.0mL的ABTS+·工作液,混合,室温静置6min,在734nm波长测吸光度。按照公式(1)计算抑制率.
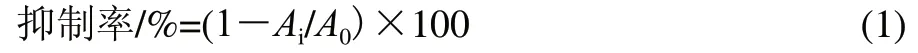
式中:Ai为加入某质量浓度样品溶液的吸光度;A0为样品空白对照即不加样品溶液的吸光度。
实验以Trolox作为阳性对照,作不同浓度的Trolox抑制ABTS能力的曲线,并利用样品对清除自由基动力学模型分别求出醇提物和Trolox的IC50,并比较二者对ABTS+·的清除效果。
1.7 蘑菇酪氨酸酶的抑制活性[13-15]
分别以L-酪氨酸和L-DOPA作为蘑菇酪氨酸酶作用底物,分别研究醇提物对酪氨酸酶单酚酶活性和酪氨酸酶二酚酶活性的抑制效果。在pH6.8的磷酸缓冲液中,25℃条件下,底物L-酪氨酸和L-DOPA被酪氨酸酶催化,经过一系列的氧化反应生成产物多巴色素,其在475nm波长处有最大吸收(A475nm) 。
酪氨酸酶单酚酶(Monophenolase)酶活测定:依次加入0.3mL的10mmol/L磷酸缓冲液(pH6.8),2mL的1mmol/L L-酪氨酸,0.1mL样品水溶液,0.1mL的200U/mL蘑菇酪氨酸酶,混匀,25℃水浴10min后,开始测其在波长475nm吸光度,每1min测一次,共测15次。先以反应时间为横坐标,吸光度为纵坐标,表示酶促反应产物生成的增长曲线,按公式(2)计算抑制率。计算不同质量浓度醇提物在一定反应时间内对酪氨酸酶的抑制率,并以抑制率为纵坐标,反应时间为横坐标作图。

式中:A和A1分别表示空白和含抑制剂条件下在475nm波长处的吸光度。
酪氨酸酶二酚酶(Diphenolase)酶活测定:依次加入0.8mL 10mmol/L磷酸缓冲液(pH6.8),1.5mL 1.5mmol/L的L-DOPA,0.1mL样品水溶液,0.1mL 200U/mL蘑菇酪氨酸酶,混匀,25℃水浴10min后,开始测其在波长475nm处吸光度,每10s测一次,共测30次。先以反应时间为横坐标,吸光度为纵坐标,表示酶促反应产物生成的增长曲线,按公式(3)计算抑制率。计算不同质量浓度醇提物在一定反应时间内对酪氨酸酶的抑制率,并以抑制率为纵坐标,反应时间为横坐标作图。上述酶活的测定均以曲酸作为阳性对照[16]。
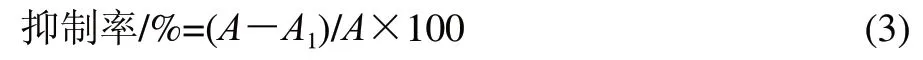
式中:A和A1分别表示空白和含抑制剂条件下在475nm波长处的吸光度。
1.8 抗苹果褐变的测定[17]
将新鲜苹果洗净,晾干,去皮,制成大小均一、厚度为1.5cm的切片。将这些切片分别浸泡在50mL的0.5g/100mL抗坏血酸溶液、0.03g/100mL湘莲红衣醇提物溶液、0.05g/100mL莲子红衣醇提物溶液、0.5g/100mL抗坏血酸+0.03g/100mL莲子红衣醇提物溶液、0.5g/100mL抗坏血酸+0.05g/100mL莲子红衣醇提物溶液中,5min后取出,沥干,室温下保存,开始计时,用色差计分别测其在0、1、2、3、4、5h时L*(黑白色度)、a*(红绿色度)、b*(黄褐色度)。
1.9 数据处理与统计分析[18]
1.9.1 数据处理
提取物对清除自由基效力、抑制酪氨酸酶活性反应模式:醇提物抗氧化和抗褐变活性的动力学模型,可用公式(4)~(6)表示。

式中:ρ为抗氧化剂质量浓度/(mg/mL);k为比例常数;A为任一抗氧化质量浓度对自由基的清除率/%;A*为当平衡时对自由基的清除率/%。
以-ln(1-(A/A*))对抗氧化物质量浓度做图,求线性回归曲线,由图形的斜率(回归曲线方程式的一次项系数)即可求得抗氧化常数(k),求得IC50。
1.9.2 统计分析
使用Excel对数据进行统计分析,经SPSS19.0软件Duncan法检验差异显著性。
2 结果与分析
2.1 莲子红衣醇提物总酚和总黄酮含量
通过福林酚法,测得莲子红衣醇提物中的总酚含量为(233.63±10.16)mg/g;通过亚硝酸钠-硝酸铝法,测得醇提物中总黄酮含量为(166.02±7.31)mg/g。
2.2 ABTS+·清除能力
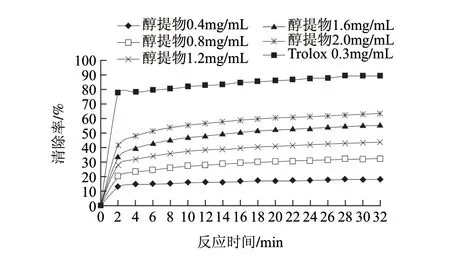
图 1 不同质量浓度莲子红衣醇提物及阳性对照Trolox对ABTS+·的清除能力Fig.1 ABTS+· scavenging activity of the ethanol extract and Trolox at various concentrations
由图1可知,在反应的初始阶段(前2min),当莲子红衣醇提物的质量浓度分别为0.4、0.8、1.2、1.6、2.0mg/mL时,ABTS+·的清除率分别为13.28%、20.34%、28.11%、33.62%、41.81%。清除率在30min内达到稳定。反应30min后,上述质量浓度的醇提物对ABTS+·的清除率分别升高至18.06%、32.39%、43.58%、55.37%、63.43%。由此可见,在一定时间范围内,醇提物对ABTS+·的清除率随时间的延长而提高。结果还表明,醇提物在清除ABTS+·时也存在质量浓度依赖关系,质量浓度越大,其清除率越高。通过线性回归,得出醇提物的半抑制质量浓度(IC50)为(1.385±0.210)mg/mL,其阳性对照物Trolox的IC50为(0.175±0.011)mg/mL,可见醇提物清除ABTS+·的效果较为显著。
2.3 酪氨酸酶抑制活性
酪氨酸酶催化反应可分两个阶段,L-酪氨酸先羟基化成L-多巴,然后L-多巴氧化成多巴醌,进而一系列反应生成引起褐变的色素物质,即酪氨酸酶的单酚酶活性阶段和其二酚酶活性阶段[19]。因此,测定了醇提物对酪氨酸酶分别以L-酪氨酸和L-多巴为底物的反应剂量影响。如图2所示,当莲子红衣醇提物的质量浓度分别为2、4、8、12、16mg/mL时,反应2min时,单酚酶的活性分别下降了53.64%、73.64%、78.18%、59.09%、55.44%。同样上述系列质量浓度的醇提物在反应50s时,二酚酶活性则分别下降了25.56%、50.56%、53.33%、67.78%、59.89%(图3)。但在质量浓度范围4~16mg/mL间,醇提物对单酚酶和二酚酶的抑制效果并没有观察到明显的量效关系,且反应很快就达到了稳定。通过线性回归,测得醇提物对单酚酶和二酚酶活性的IC50分别为(1.665±0.137)mg/mL和(3.777±0.294)mg/mL,阳性对照曲酸对单酚酶和二酚酶活性的IC50分别为(0.021±0.003)mg/mL和(0.068±0.006)mg/mL。可见莲子红衣醇提物对酪氨酸酶活性具有一定的抑制效果。
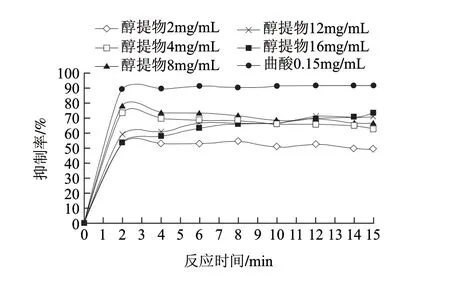
图 2 不同质量浓度莲子红衣醇提物及曲酸对蘑菇酪氨酸酶单酚酶活性的抑制效果Fig.2 Inhibitory effects of the ethanol extract and kojic acid at various concentrations on monophenolase
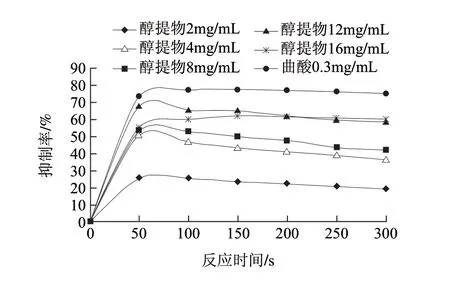
图 3 不同质量浓度莲子红衣醇提物及曲酸对蘑菇酪氨酸酶二酚酶活性的抑制效果Fig.3 Inhibitory effects of the ethanol extract and kojic acid at various concentrations on diphenolase
2.4 对鲜切苹果片自然褐变的影响
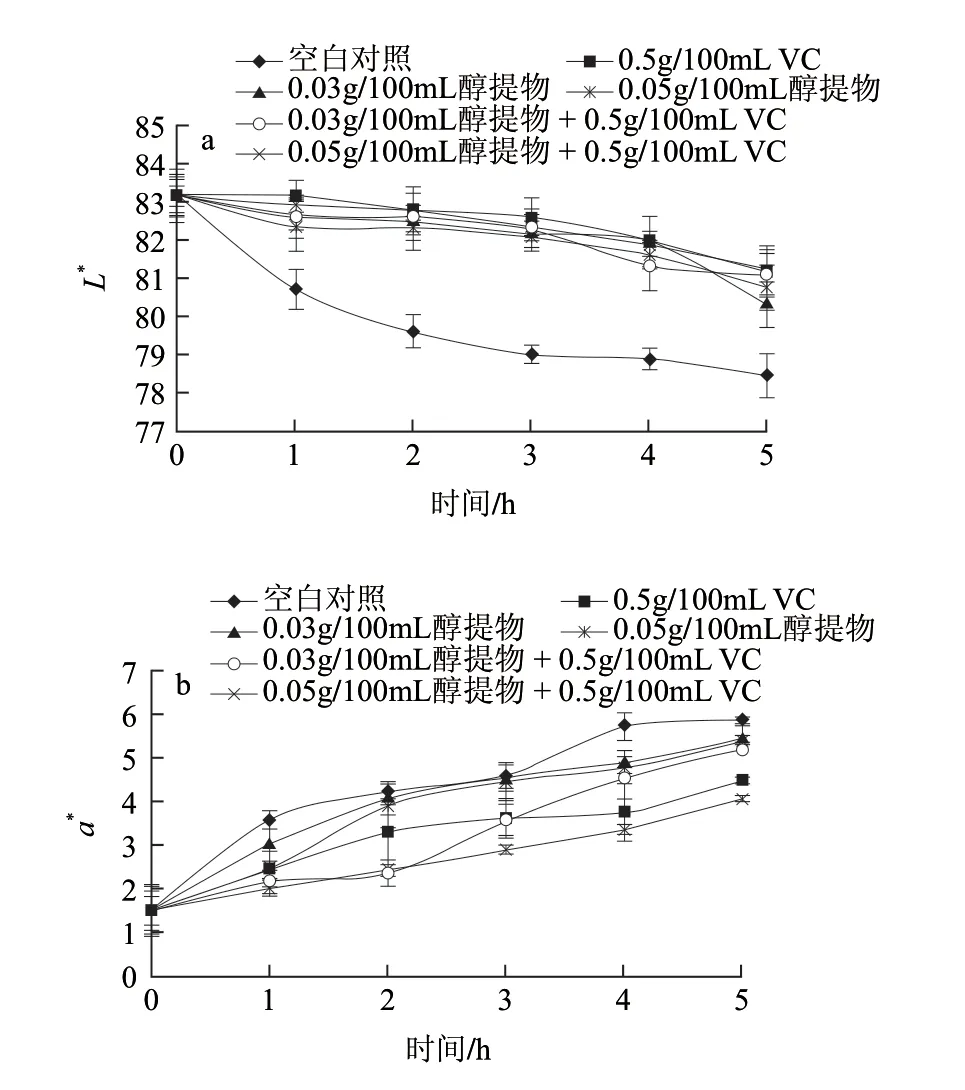
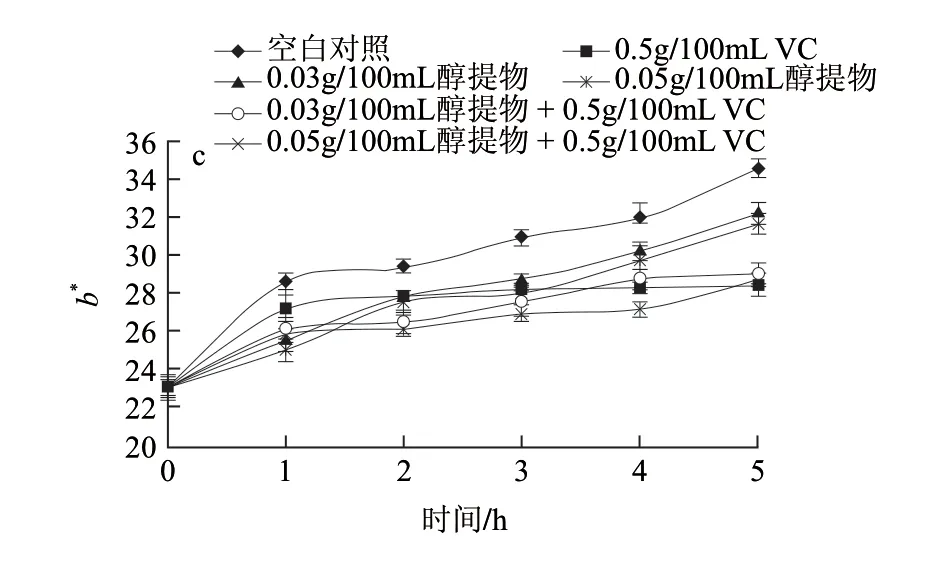
图 4 不同处理对鲜切苹果色泽的影响Fig.4 Effects of different treatments on the L*, a* and b* values of fresh-cut apples
通过测定对鲜切苹果片自然褐变的影响,进一步证实醇提物的抗褐变能力。L*值与褐变程度存在负相关关系,a*值和b*值与褐变程度存在正相关关系。由图4可知,抗苹果褐变能力大小依次为0.5g/100mL VC+0.05g/100mL莲子红衣醇提物>0.5g/100mL VC+0.03g/100mL莲子红衣醇提物>0.5g/100mL VC>0.05g/100mL莲子红衣醇提物>0.03g/100mL莲子红衣醇提物>空白对照(水)。和空白对照组的L*相比,0.05%醇提物和0.03g/100mL醇提物溶液均有显著抗褐变效果(P<0.05)。当0.05g/100mL醇提物和0.03g/100mL醇提物分别与0.5g/100mL VC组合后,抗褐变效果也显著高于阳性对照组0.5g/100mL VC溶液(P<0.05)。但在0.05g/100mL醇提物和0.03g/100mL醇提物两组溶液处理之间,并没有观察到非常显著的差异(P>0.05)。
3 讨 论
我国为产莲大国,莲子在加工生产过程中产生大量的红衣粉,目前多被当作废弃物而浪费,至今没有得到很好的应用,但在先前的初步研究中发现这些废弃物中不乏丰富的营养物质和活性成分[2-4],因而本研究以此为着眼点展开更深入的探索,希望为新资源的开发利用提供更多的理论依据。
经本研究测定莲子红衣醇提物中含有较多的多酚和总黄酮类化合物,其含量分别为233.63mg/g和166.02mg/g。众多研究表明多酚和黄酮类物质都是天然的抗氧化剂[20],如茶多酚和银杏叶黄酮等。多酚结构中的酚羟基可作为供氧体与自由基反应,使之生成相应的离子或分子,淬灭自由基,终止自由基的链锁反应,从而表现其抗氧化活性[21];而黄酮化合物可以和金属离子如铜离子等结合,催化脂质氢过氧化物的分解反应,引起自由基的减少[22]。在本研究中,莲子红衣醇提物对ABTS+·显示出了较强的抑制作用,当质量浓度为2.0mg/mL时,对ABTS+·的清除率可达63.43%。
目前,茶多酚已被广泛应用于果蔬的保鲜[20],也有研究表明银杏叶片提取液对苹果具有良好的保鲜效果。鲜切苹果褐变的发生多因苹果中酚酶催化反应的进行,致使多酚等还原性物质被氧化,因此,抗褐变能力的体现可能也与其中活性物质的抗氧化活性具有内在联系。本研究选取与皮肤色素沉积、果蔬和鱼虾褐变等现象密切相关的酪氨酸酶为研究对象,分别测定了湘莲红衣醇提物对其单酚酶和二酚酶活性的抑制能力。酪氨酸酶是一种含铜离子的氧化还原酶,是催化L-酪氨酸氧化形成黑色素的反应的一种关键酶,同时具有单酚酶和二酚酶的活性[19]。结果显示,在莲子红衣醇提物质量浓度为4mg/mL时,对单酚酶和二酚酶活性的抑制率分别可达73.64%和50.56%。经各种质量浓度莲子红衣醇提物溶液处理的鲜切苹果的褐变过程也明显得到了延缓,尤其是当0.05g/100mL莲子红衣醇提物和0.5g/100mLVC联合使用时抗褐变效果更佳。这可能是莲子红衣醇提物中的黄酮类化合物和酪氨酸酶中的铜离子络合,阻止氧化还原反应,从而抑制酶促褐变。但随着莲子红衣醇提物质量浓度的增加,其对酪氨酸酶活性以及鲜切苹果褐变程度的抑制能力并没有显著提高,推测当莲子红衣醇提物质量浓度为4mg/mL时所含的黄酮物质与酪氨酸酶中的铜离子的络合已几乎达饱和状态,而酶促褐变的产生还有其他途径。
综上所述,莲子红衣醇提物中含有丰富的多酚和黄酮类化合物,并且在清除ABTS+·、抑制酪氨酸酶活性、抗苹果褐变等方面都展示了良好的功效。因此,湘莲红衣粉可以作为提取天然抗氧化和褐变抑制剂的潜在资源而具有被深入开发的良好前景。在今后的研究中,莲子红衣提取物的抑菌作用等功能还需要继续探索。
[1] 蔡和晖, 廖森泰, 施英, 等. 莲的利用价值和产品开发思路[J]. 农产品加工, 2008(4): 40-43.
[2] 曹杨, 徐虹, 王静, 等. 莲天然产物及其生物活性研究进展[J]. 食品工业科技, 2012, 33(8): 402-405.
[3] 徐虹, 王馨仪, 曹杨, 等. 莲子红皮蛋白微波辅助盐提工艺优化[J]. 食品科学, 2011, 32(4): 87-91.
[4] 徐虹, 朱雨薇, 曹杨, 等. 莲子红皮多糖提取工艺研究[J]. 食品工业科技, 2011(2): 266-268.
[5] ZENG Weicai, JIA Lirong, ZHANG Yan, et al. Antibrowning and antimicrobial activities of the water-soluble extract from pine needles of Cedrus deodara[J]. Journal of Food Science, 2011, 76(2): 318-323.
[6] 陈君琛, 李怡彬, 吴俐, 等. 大球盖菇黄酮类化合物提取及抑菌性研究[J]. 北京工商大学学报: 自然科学版, 2010, 28(6): 9-13.
[7] 朱彩平, 夏德水. Folin-Ciocalteu比色法测定石榴皮提取物中的多酚[J]. 光谱实验室, 2012, 29(3): 1356-1360.
[8] ALINE M, LAMIEN C E, ROMITOM, et al. Determination of the total phenolic, flavonoid and proline contents in Burkina Fasan honey, as well as their radical scavenging activity[J]. Food Chemistry, 2005, 91(3): 571-577.
[9] 卢文芸, 许文琴, 于锡忠, 等. 贵州野生蕨菜中总黄酮含量的测定与分析[J]. 贵州农业科学, 2012, 40(5): 47-49.
[10] 董捷, 张红城, 秦健, 等. 十种蜂花粉醇提物中总多酚和总黄酮含量测定[J]. 食品科学, 2008, 29(12): 246-249.
[11] ARTS M, DALLINGA S, VOSS H, et al. A new approach to assess the total antioxidant capacity using the TEAC assay[J]. Food Chemistry, 2004, 88: 567-570.
[12] RE R, PELLEGRINI R, PROTEGGENTE A, et a1.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Rad Biol Med, 1999, 26(1): 1231-1237.
[13] CHEN Q X, KUBO I. Kinetics of mushroom tyrosinase inhibition by quercetin[J]. J Agric Food Chem, 2002, 50(14): 4108-4112.
[14] CHEN Q X, SONG K K, WANG Q, et al. Inhibitory effects of mushroom tyrosinase by some alkylbenzaldehydes [J]. J Enzy Inhibit Med Chem, 2003, 18(6): 491-496.
[15] 杜凌云, 咸小丹, 岳巧秀. 奥扎格雷对蘑菇酪氨酸酶的抑制动力学[J]. 常州工程职业技术学院学报, 2010, 3(3): 42-47.
[16] 金一琼, 陈周谭, 赖富饶, 等. 曲酸与阿魏酸对酪氨酸酶的抑制作用研究[J]. 现代食品科技, 2012, 28(4): 378-381.
[17] 齐海萍, 胡文忠, 姜爱丽, 等. 几种抗褐变剂对鲜切富士苹果褐变的抑制效果[J]. 江苏农业科学, 2011, 39(4): 358-360.
[18] 董婕, 张红城, 李慧, 等. 八种蜂花粉醇提取物的体外抗氧化能力研究[J]. 营养学报, 2010, 32(3): 309-312.
[19] 陈桂霞, 邱凌, 宋康康, 等. 桑黄素对蘑菇酪氨酸酶的抑制作用[J]. 厦门大学学报: 自然科学版, 2006, 45(3): 424-427.
[20] 王佩华, 赵大伟, 迟彩霞, 等. 天然抗氧化剂茶多酚在食品贮藏保鲜中的应用[J]. 贵州农业科学, 2011, 39(3): 210-213.
[21] 张永忠, 陈学颖, 孙艳梅. 四种异黄酮抗氧化活性的比较研究[J]. 食品科学, 2008, 29(2): 383-386.
[22] 李娜, 鲁晓翔. 酪氨酸酶抑制剂的研究进展[J]. 食品工业科技, 2010, 31(7): 406-409.
