蜡状芽孢杆菌磷脂酶C基因在大肠杆菌中的异源表达
2013-12-23刘菲菲顾正华丁重阳石贵阳
刘菲菲,张 梁,*,顾正华,丁重阳,石贵阳
(1.粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2.工业生物技术教育部重点实验室,江苏 无锡 214122)
磷脂酶C(phospholipase C,PLC,EC3.1.4.3),是一种水解甘油磷脂C3位点磷酯酰键生成甘油二酯和磷酸胆碱、磷酸肌醇、磷酸乙醇胺等的脂类水解酶[1]。根据作用底物特异性可以分为磷脂酰胆碱特异性磷脂酶C(PC-PLC)、磷脂酰肌醇特异性磷脂酶C(PI-PLC)和鞘磷脂特异性的鞘磷脂酶(SMase),其中磷脂酰胆碱特异性磷脂酶C除了具有磷脂酰胆碱活性外,还具有磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)活性。磷脂酶C水解产物甘油二酯是一种生理活性物质,在细胞信号传导途径上起着第二信使的作用,能激活蛋白激酶C(PKC)而引起细胞增殖、分化、收缩、分泌和代谢等功能变化[2-3],此外还具有明显的抗血小板黏附、聚集等功能,对抗血小板新型药物及抗静脉血栓医疗方面的研究[4-6]意义重大。随着对磷脂酶C研究的深入及工业发展的需求,磷脂酶C的应用价值逐渐被挖掘开发,已经逐渐从药品生产延伸至油脂精炼[1]、食品加工、磷脂改性等领域[7-8]。例如植物油行业,粗制植物油中含有的磷脂、痕量金属等造成其色泽或口味变差,利用磷脂酶A(PLA)和磷脂酶C的混合物进行酶法脱胶[9]或者说是酶催化精炼,可以完全除去磷脂,比水、酸或苛性碱脱胶具有更好的油产率和经济效益;食品工业中磷脂酶C可用来改善面包的冷冻保存,生面团烤制时在面包表面产生的老化、缓和梨皮状表皮等;而最近磷脂酶C作为一种新型食品添加剂势必会推动磷脂酶C的广泛应用和研究。
微生物来源磷脂酶C较动植物来源磷脂酶C具有生产周期短、结构简单,可工业化大规模培养等优势,但野生菌株产量低、分离纯化耗资大[10],使得高纯度磷脂酶C商业化生产难以实现;而且大多数来源菌株都具有病原性,在食品安全性方面存在一定的隐患。本实验筛选出一株产磷脂酶C菌株Bacillus cereus 12并以其染色体为模板,利用pET系统载体构建磷脂酰胆碱特异性磷脂酶C基因重组大肠杆菌,初步尝试利用该途径实现磷脂酰胆碱特异性磷脂酶C基因的异源高效表达,为后续的工作提供参考。
1 材料与方法
1.1 菌株与质粒
蜡状芽孢杆菌Bacillus cereus 12为本实验所筛选的高产磷脂酶C菌株,E. coli JM109、BL21(DE3)菌株及载体pET28a(+)为本实验室(粮食发酵工艺与技术国家工程实验室)保藏。
1.2 试剂与培养基
限制性内切酶BamHⅠ、EcoRⅠ、DNA marker、Protein marker 加拿大Fermentas公司;T4 DNA连接酶、TaqDNA聚合酶、dNTPs、pMD18-T载体 日本TaKaRa公司;DNA片段纯化试剂盒、质粒小量提取试剂盒、胶回收试剂盒 北京博大泰克生物技术公司;p-NPPC 美国Sigma公司;其他试剂均为国产分析纯试剂。
卵黄LB固体培养基:在LB固体培养基中添加2%卵黄;硼砂卵黄固体培养基:NaCl 0.66g/100mL、硼酸1.09g/100mL、硼砂0.19g/100mL、琼脂1.5g/100mL、卵黄液2%,pH7.2~7.4。
1.3 方法
1.3.1 产磷脂酶C菌株的筛选
以本实验室保藏的600株细菌为出发菌株,分别点种于卵黄LB平板上进行初筛,37℃培养过夜,筛选出乳白色晕圈较大的15株进行发酵培养,于等距放在硼砂卵黄平板上的牛津杯中加入200μL发酵液,每个做3个平行,37℃温育24h进行复筛,挑取晕圈最大的菌株进行保藏。
1.3.2 基因组DNA的提取
蜡状芽孢杆菌基因组DNA的提取参考分子克隆实验指南[11]相关方法进行。
1.3.3 pcplc基因的克隆
以NCBI上报道的ATCC10987的pcplc基因为模板设计PCR引物p1/p2,见表1。
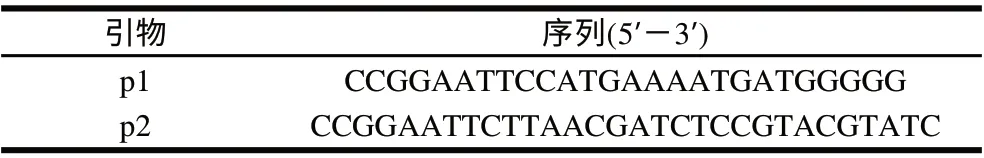
表 1 所用引物Table 1 Primers used in this study
以Bacillus cereus 12染色体为模板,以p1/p2为引物进行PCR扩增。PCR扩增体系为:dNTPs、10×Buffer各2.5μL,上下游引物各0.5μL,模板1μL,灭菌的双蒸水18μL,Taq酶0.3μL。PCR扩增条件为:95℃预变性5min;94℃变性30s,54℃退火30s,72℃延伸90s,30个循环后72℃延伸10min。琼脂糖凝胶电泳进行结果分析,PCR产物纯化后,用T4 DNA连接酶连接,插入pMD18-T载体,转化大肠杆菌JM109,蓝白斑筛选阳性克隆。挑取阳性克隆接种至Amp抗性LB培养基中,提质粒用EcoRⅠ酶切验证。将验证正确的克隆送华大基因测序。测序正确的重组质粒命名为pMD18-pcplc1,-70℃甘油管保存。
1.3.4 大肠杆菌表达质粒的构建
提取pMD18-pcplc1质粒,用EcoRⅠ进行酶切胶回收目的条带后,与经EcoRⅠ线性化的pET28a于16℃培养箱连接过夜,转化E.coli JM109感受态细胞,氨苄抗性平板筛选,挑取转化子用T7启动子引物和目的基因下游引物进行菌落PCR,挑取菌落PCR正确的转化子大提,然后用BamHⅠ酶切验证连接正反。送华大基因用T7启动子/终止子引物测序,正确的重组质粒命名为pET28a-pcplc1,将测序正确的质粒转化宿主菌BL21(DE3),-70℃甘油管保存。
1.3.5 重组菌的诱导表达及SDS-PAGE凝胶电泳检测
将重组菌株pET28a-pcplc1/DE3以及空载对照pET28a/DE3于37℃振荡培养过夜,次日以4%接种量转接至50mL卡那霉素抗性LB液体培养基,37℃、200r/min培养至OD600nm为0.6~0.8时,加入IPTG至终浓度为1.0mmol/L,25℃诱导6h。
诱导结束后6000r/min离心10min收集菌体,并用10mL浓度为25mmol/L Tris-HCl(pH7.2)缓冲液重悬菌体,菌体于冰浴中超声波破碎至澄清,8000r/min离心10min,收集上清,取20μL样品加入5×Loading buffer,煮沸10min,12000r/min离心10min,上样量15μL,采用10%分离胶、5%浓缩胶进行SDS-PAGE鉴定蛋白表达与否。
1.3.6 磷脂酶C的酶活力测定
硼砂卵黄平板牛津杯法测酶活力:取200μL发酵液置于等距放置在硼砂卵黄平板上的牛津杯中,37℃温育24h,所产生的乳白色晕圈的大小即代表酶活力的高低。由于该方法磷脂酶直接作用于底物卵磷脂,所以成本低廉,应用较为广泛。
NPPC底物法测磷脂酶C酶活力:根据磷脂酶C能水解甘油磷脂结构类似物对硝基苯酚磷酸胆碱(p-NPPC)产生有色基团(对硝基苯酚),该物质在410nm波长处有最大吸收峰,可利用p-NPPC为反应底物,于410nm波长处测定反应液的吸光度,并代入标准曲线计算出PLC水解p-NPPC产生对硝基苯酚的量,从而定量检测磷脂酶C活力大小。酶反应系统组成:0.25mol/L Tris-HCl (pH 7.2)、0.1mmol/L ZnCl2、60g/100mL山梨醇、10mmol/L p-NPPC,在反应系统中加入200μL发酵酶液于37℃反应30min,立刻用分光光度计测410nm波长处吸光度。酶活单位的定义:在pH7.2、37℃的条件下,每分钟水解p-NPPC产生1nmol的对硝基苯酚所需的酶量为1个酶活力单位(U)。由于底物昂贵,而且p-NPPC缺乏磷脂尾端结构,不能真实地反映出磷脂酶C的水解程度[2],故初步鉴定采用硼砂卵黄平板牛津杯法。
1.3.7 重组菌株生长曲线的测定
从平板上挑取重组大肠杆菌单菌落接种于装有20mL卡那霉素抗性LB液体培养基的100mL三角瓶中,37℃、200r/min过夜培养,按4%的转接量转接于若干装有50mL卡那霉素抗性LB液体培养基的250mL三角瓶中,37℃、200r/min振荡培养,定点取样测OD600nm值,实验过程中做3组平行实验。
1.3.8 诱导条件的初步优化
诱导时机、诱导温度、诱导剂浓度、诱导时间对产酶的影响随重组蛋白的种类不同而有所不同。本实验在方法1.3.5节的基础上通过改变单因子的方法进行诱导,根据硼砂卵黄平板牛津杯法产生的乳白色晕圈直径大小来鉴定酶活的高低,每个因素做3个平行。
2 结果与分析
2.1 产磷脂酶C菌株的筛选结果
由图1可知,最终筛选出3株晕圈较大的菌株,分别为95-3-3、642-16-4、12-3-1,晕圈直径都达到22mm,经鉴定95-3-3为荧光假单胞菌,642-16-4、12-3-1为蜡状芽孢杆菌。本实验选取642-16-4为出发菌株,重新命名为Bacillus cereus 12。
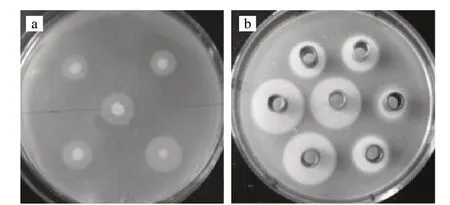
图 1 产PLC的部分初筛(a)和部分复筛(b)结果Fig.1 Screening of PLC
2.2 pcplc基因的克隆
根据NCBI公布的ATCC10987的pcplc基因设计引物时发现该基因由信号肽、前肽和成熟肽构成,考虑前肽的助折叠功能,引物设计中包含前肽。提取蜡状芽孢杆菌Bacillus cereus 12的基因组DNA,用p1/p2引物扩增,琼脂糖凝胶电泳表明在约800bp处有明显的条带如图2所示,命名为pcplc1。用纯化试剂盒回收该片段,与pMD18-T连接后用EcoRⅠ进行酶切验证,验证结果如图3中789bp和2692bp两条带,分别对应目的基因片段大小和载体大小。挑取正确的转化子送华大基因测序,测序结果显示扩增序列与ATCC10987的pcplc基因序列比对相似度97%。
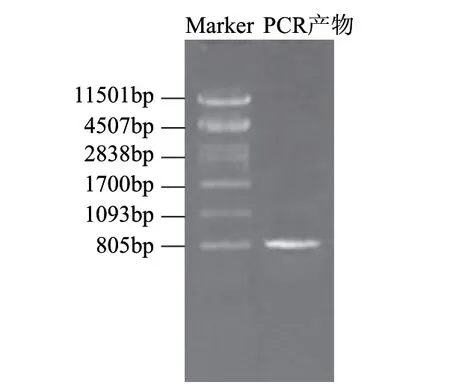
图 2 目的基因扩增结果Fig.2 PCR amplification of the target gene
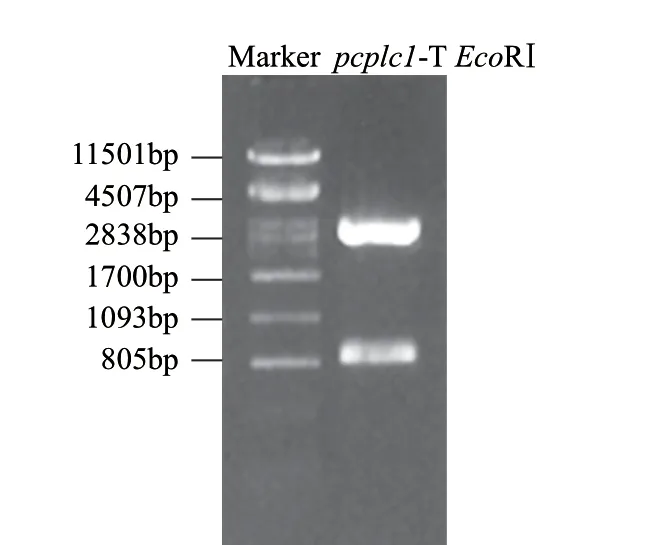
图 3 pcplc1-pMD18-T EcoRⅠ酶切验证Fig.3 Restriction enzyme digestion analysis of pcplc1-PMD18T by EcoRI
2.3 重组表达质粒的构建
该表达质粒利用N端His-Tag融合标签,在EcoRⅠ位点将目的基因连接到载体中,构建方法如1.3.4节。利用目的基因和载体上共有的BamHⅠ位点来验证pcplc1基因插入的正反,如果正接则得到577bp和5578bp两条片段,如果反接则得到225bp和5930bp,结果如图4。挑取验证正确的转化子进行测序,测序结果显示阅读框正确,重组质粒构建成功,将其命名为pET28a-pcplc1。
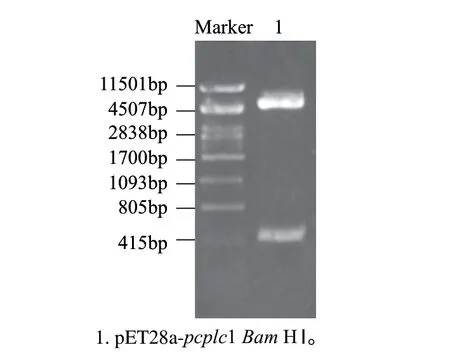
图 4 重组质粒pET28a-pcplc1 Bam HⅠ酶切验证Fig.4 Restriction enzyme digestion analysis of pET28a-pcplc1 by BamHⅠ
2.4 重组质粒在大肠杆菌中的表达
将验证正确的包含前肽的重组质粒pET28a-pcplc1转化感受态表达菌株BL21(DE3),并以空载pET28a(+)和不含前肽的重组质粒pET28a-pcplc2(构建方法同pET28apcplc1)作为对照转化BL21(DE3),按上述1.2.4节方法进行诱导及SDS-PAGE电泳鉴定。结果如图5所示,构建的重组菌pET28a-pcplc1/DE3、pET28a-pcplc2/DE3成功表达了分子质量分别约为33kD和31kD的重组蛋白,与预期值相符,说明磷脂酶C基因pcplc1在大肠杆菌DE3中得以表达。
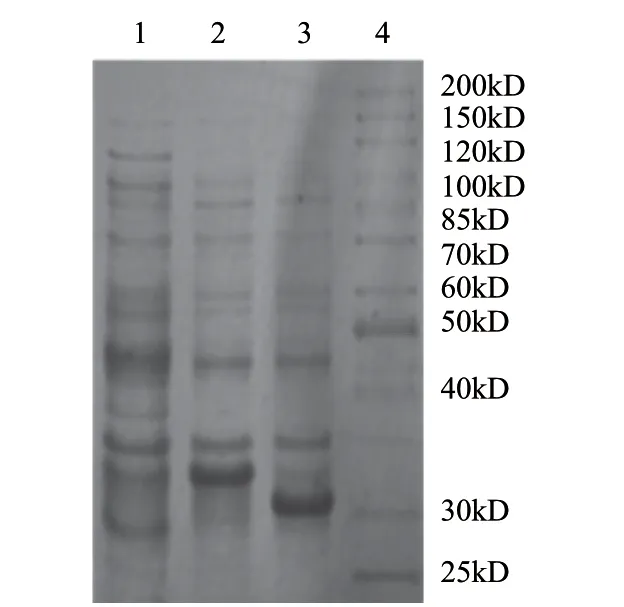
图 5 大肠杆菌重组磷脂酶C的SDS-PAGE电泳Fig.5 SDS-PAGE analysis of recombination PLC
2.5 重组蛋白活性验证
利用1.3.6节所述的卵黄硼砂平板法检测磷脂酶C活性,结果如图6显示,pET28a-pcplc1/DE3破碎上清中的重组蛋白有明显乳白色晕圈,而pET28a-pcplc2/DE3和空载对照均没有,说明含有前肽的重组蛋白具备磷脂酶C活性。原因推测是酶催化位点位于成熟肽N端位置,距离前肽较近,酶活性的体现必须基于前肽的助折叠功能。
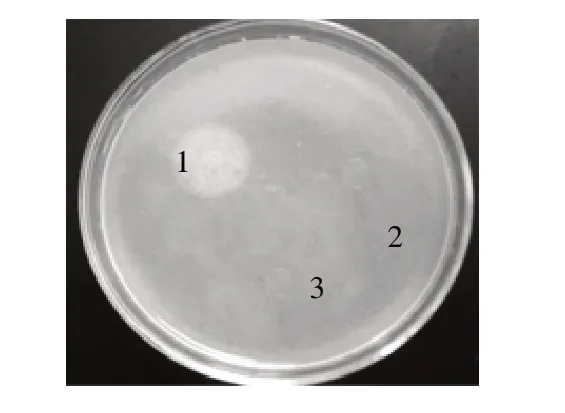
图 6 重组蛋白活性验证Fig.6 Verification of recombinant enzyme activity
2.6 重组菌pET28a-pcplc1/DE3生长曲线的测定及诱导条件的优化
2.6.1 重组菌生长曲线的测定
重组菌的诱导发酵产酶与诱导条件密切相关,在确定最佳的诱导条件之前需要先研究重组菌的生长曲线。根据此生长曲线选择适应期、对数生长前期、对数生长中期、对数生长后期进行诱导。按方法1.3.7节测定生长曲线,结果如图7所示,0~1h为适应期,1~6h为对数生长期。
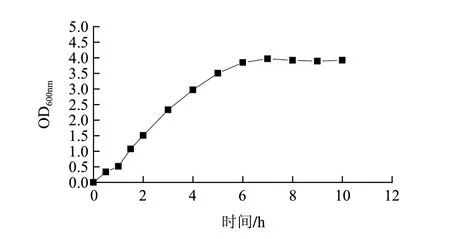
图 7 重组菌生长曲线Fig.7 Growth curve of recombinant strain pET28a(+)-pcplc1/DE3
2.6.2 最佳诱导起始时间的确定
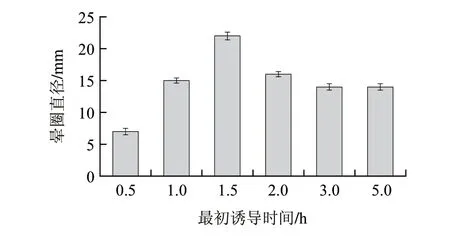
图 8 诱导时机对酶活力的影响Fig.8 Effect of induction time on enzyme activity
诱导时机对菌体产酶有着较大影响,在对数生长期菌体生长状况良好,体内各种酶的代谢处于旺盛阶段,此时诱导利于外源蛋白的合成。诱导时间过早,菌体太少往往会降低外源蛋白产量;诱导时间过迟,细菌过老自身代谢能力下降,不利于外源基因表达。因此按方法1.3.8节,转接后分别选取菌体生长0.5、1、1.5、2、3、5h时添加IPTG进行诱导。结果如图8所示,酶活力随着时间的延长而逐渐增大,在对数前期1.5h达到最大值,随后酶活力基本上保持不变,故最佳诱导起始时间为转接后1.5h。
2.6.3 IPTG最佳浓度的确定
IPTG作为诱导剂,能够启动lac启动子的转录,但本身均有一定的毒性,浓度过高会抑制菌体的生长,另外IPTG价格昂贵,所以IPTG的添加并不是越多越好。按方法1.3.8节,IPTG浓度选取0.1、0.2、0.4、0.6、0.8、1.0、1.2mmol/L进行诱导。由图9可知,在IPTG浓度为0.2mmol/L时酶活力达到最大,酶活力随着IPTG浓度的增加逐渐降低,故最佳诱导剂浓度为0.2mmol/L。
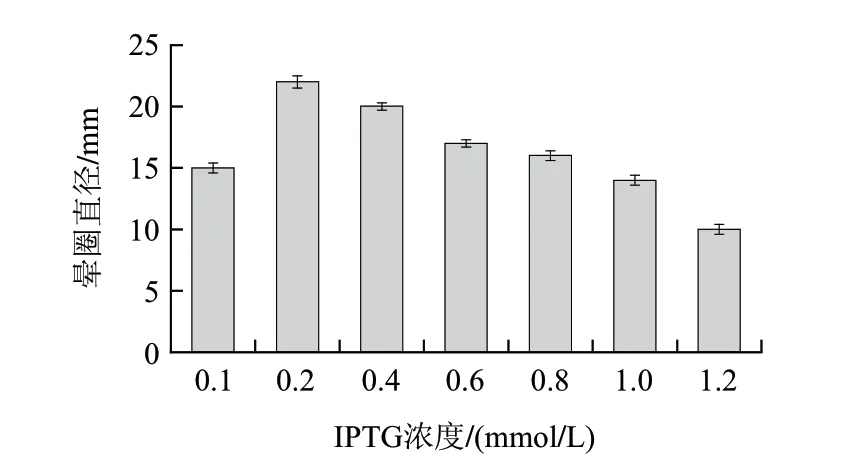
图 9 IPTG浓度对酶活力的影响Fig.9 Effect of IPTG concentration on enzyme activity
2.6.4 最佳诱导温度的确定
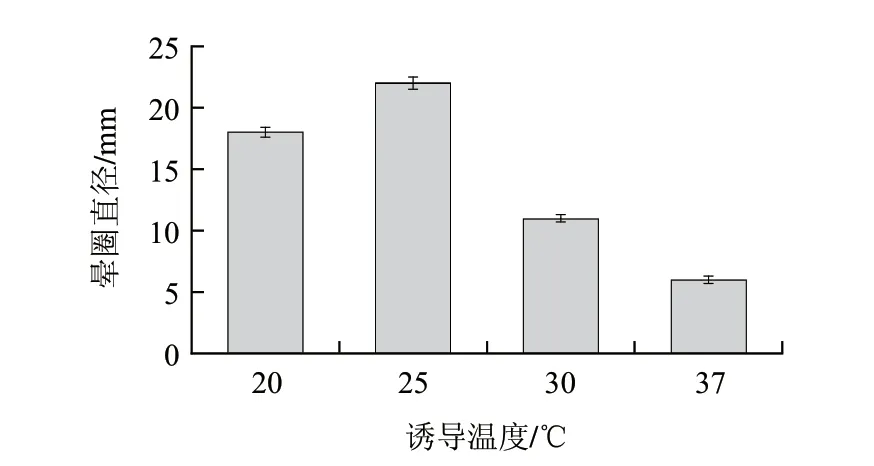
图 10 诱导温度对酶活力的影响Fig.10 Effect of induction temperature on enzyme activity
温度决定着微生物体内新陈代谢的酶催化反应,大肠杆菌的最适生长温度为37℃,诱导温度过高重组蛋白易折叠错误而以包涵体的形式存在;温度过低菌体生长缓慢,表达量降低。本实验依据方法1.3.8选取了4个温度20、25、30、37℃,考察了诱导温度对酶活的影响,结果如图10所示,随着温度的升高酶活在25℃时达到最大,随后降低,故选取发酵产酶的最佳温度为25℃。
2.6.5 最佳诱导时间的确定
依据方法1.3.8节,分别诱导2、4、6、8、10、12h研究诱导时间长短对产酶的影响。结果如图11所示,酶活力在4h达到最大值,随后随着时间的递增而减小,在8h以后酶活力相对变化较小,故最佳的诱导时间为4h。
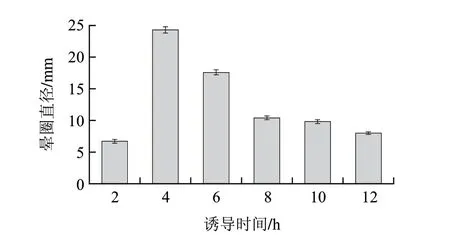
图 11 诱导时间对酶活力的影响Fig.11 Effect of induction time on enzyme activity
2.7 最佳诱导条件下重组菌特性
综上所述,重组大肠杆菌pET28a-pcplc1/DE3最佳诱导条为:转接量4%,37℃培养1.5h后添加IPTG至终浓度为0.2mmol/L,25℃诱导培养4h。在最佳诱导条件下,重组磷脂酶C在硼砂卵黄平板上晕圈直径较优化前增大约9mm,细胞破碎上清中重组磷脂酶C酶比活力为(30.24±0.18)U/mL。
3 讨 论
磷脂酶C基因结构及功能[3]的研究开始于国外20世纪60年代,随后1997年Cristina等[12]在大肠杆菌中以包涵体的形式克隆表达了蜡状芽孢杆菌磷脂酶C基因,近年来开始出现少量不同表达体系的克隆表达[13-14]及有关工业应用的报道[15]。然而目前国内相关研究尚浅,2005年陈涛[16]对产磷脂酶C野生菌株Bacillus cereus Shenzhen754-1进行紫外线和60-γ射线诱变处理将酶活力提高至16.45U/mL;2007年高林等[17]对Bacillus cereus Shenzhen754-1进行培养条件的优化产酶水平提高至26U/mL;同年王常高等[7]对筛选到的一株Bacillus mycoides进行了分离纯化和部分酶学特性研究,结果纯化出的蛋白具有高分解甘油磷脂结构类似物p-NPPC的能力却没有底物卵磷脂的分解能力;2010年詹逸舒[18]筛选到一株Bacillus cereus Z-13优化后酶活力23.31U/mL。由于野生菌株单位产量低,磷脂酶C的分离纯化一般采用硫酸铵沉淀初步分离,然后采用离子交换层析、凝胶柱层析等进行进一步分离纯化。分离过程复杂,硫酸铵消耗量大[19],给成本带来负担。国内关于细菌来源磷脂酶C基因的克隆表达的报道很少,2007年任龙等[10]尝试利用分子克隆的手段提高产量,将Bacillus cereus Shenzhen754-1 磷脂酰肌醇特异性磷脂酶C基因克隆进pGEX-KG载体,在BL21(DE3)中诱导表达出以包涵体形式存在的约38kD大小的重组蛋白,但初始复性没有测到磷脂酶C活性。随着磷脂酶C应用范围的拓展,单纯性从野生菌株出发来提高生产磷脂酶C存在诸多弊端。
本实验利用pET系统载体从分子生物学途径成功实现了磷脂酰胆碱特异性磷脂酶C基因在大肠杆菌BL21(DE3)中的可溶性表达,避免了包涵体复性带来的各种麻烦,而且该重组磷脂酶C的N端带有6HIS融合标签,为下一步的快速分离纯化提供了依据。研究中发现,前肽的存在是保证酶活的前提;直接将成熟肽基因进行克隆表达,得到的是没有活性的重组蛋白。在诱导前提一致的情况下,诱导结束时能产生活性重组蛋白的重组菌菌体浓度是其他两个对照菌体浓度的一半,由此证实了活性蛋白对菌体有一定的毒素作用,从而阻碍菌体的生长,猜测毒素作用是因为该酶的作用底物是磷脂,而且能参与一些代谢调控,从而引起不利于菌体生长的反应。后续工作将利用其N端6HIS标签进行分离纯化,获得的纯酶用于研究重组磷脂酶C的酶学性质及一些应用研究,并将该磷脂酶C基因在芽孢杆菌和毕赤酵母等更优越更安全的表达体系中进行表达,从而获得更高表达量的活性蛋白,为磷脂酶C在产业化及工业应用方面做出贡献。
[1] 孟庆飞, 温其标. 磷脂酶C水解大豆油磷脂提高油脂精炼率的研究[J]. 中国油脂, 2006, 31(1): 36-38.
[2] TITBALL R W. Bacterial phospholipase C[J]. Microbiol Rev, 1993, 57(2): 347-366.
[3] LEVINE L, XIAO D M, LITTLE C. Increased arachidonic acid metabolities from cells in culture after treatment with the phosphatidylcholine-hydrolyzing phospholipase C from Bacillus cereus[J]. Prostaglandins, 1998, 34(5): 633-642.
[4] 陈明锴, 陈蔚, 宋建华, 等. 磷脂酶C对实验性血栓形成和纤溶功能的影响[J]. 中国药理学通报, 2002, 18(4): 477-479.
[5] 陈涛, 宋建华, 陈明锴, 等. 磷脂酶C抗血小板功能的研究Ⅰ: 对血小板聚集率和黏附率的作用[J]. 中国药理学通报, 2003, 19(10): 1107-1111.
[6] 陈明铠, 宋建华, 王散, 等. 磷脂酶C抗血小板功能的研究Ⅱ: 对血小板释放和代谢的作用[J]. 中国药理学通报, 2003, 19(12): 1340-1344.
[7] 王常高, 刘彦昌, 干信, 等. Bacillus mycoides磷脂酶C部分特性研究[J]. 化学与生物工程, 2007, 24(7): 52-54.
[8] 长崎咏子. 新型磷脂酶: 中国, 200680053785.2[P]. 2009-04-15.
[9] 邦奇油类公司. 使用PLA和PLC磷脂酶混合物进行酶法脱胶: 中国, 200880009294.7[P]. 2010-03-03.
[10] 任龙, 杨宁, 陈福生, 等. 蜡状芽孢杆菌深圳株754-1PLC基因的克隆及表达[J]. 武汉工业学院学报, 2007(2): 19-21.
[11] 奥斯伯F M, 金斯顿R E, 塞德曼J G, 等. 精编分子生物学实验指南[M]. 5版. 北京: 科学出版社, 2008.
[12] CRISTINA A T, MICHAE1 J H, MARY F R. Cloning, overexpression, refolding, and purification of the nonspecific phospholipase C from Bacillus cereus[J]. Protein Expression and Purification, 1997, 10: 365-372.
[13] SEO K H. High-level expression of recombint phospholipase C from Bacillus cereus in Pichia pastoris and its characterization[J]. Biotechnology Letters, 2004, 26: 1475-1479.
[14] MARKUS A. High level expression of a recombinant phospholipase C from Bacillus cereus in Bacillus subtilis[J]. Appl Microbiol Biotechnol, 2007, 74: 634-639.
[15] SUGIMORI D, NAKAMURA M. Partial purification and some properties of a phospholipase C from Pseudomonas sp. strain KS3.2[J]. Biosci Biotechnol Biochem, 2006, 70: 535-537.
[16] 陈涛. 高产磷脂酶C菌株的诱变选育[J]. 天然产物研究与开发, 2005, 17(6): 712-716.
[17] 高林, 陈涛, 高智谋. 蜡状芽孢杆菌深圳菌株754-1产磷脂酶C培养条件的优化研究[J]. 安徽农业大学学报, 2007, 34(4): 501-504.
[18] 詹逸舒. 产磷脂酶C菌株的筛选及其酶学性质的研究[D]. 长沙: 湖南农业大学, 2010.
[19] 杨宁, 陈明锴, 仁龙, 等. 重组磷脂酶C的研究[J]. 中国药理学通报, 2006, 22(10): 1263-1265.
