Li2CO3和TiO2合成Li4Ti5O12的工艺优化*
2013-10-17龙云飞吕小艳文衍宣
李 劼 ,龙云飞 ,苏 静 ,吕小艳 ,文衍宣
(1.广西大学化学化工学院,广西南宁 530004;2.广西大学教务处)
锂离子电池不仅是移动电话、笔记本电脑、摄像机等便携式电子产品的主流电源,而且也是电动汽车和电力系统首选的动力电池和储能电池,具有广阔的应用前景和巨大的经济效益[1-2]。尖晶石Li4Ti5O12因其在充放电过程中优异的可逆性、结构稳定性、安全性和较优的锂离子迁移率,成为了一种非常有前途的负极材料,已经成为动力锂离子电池和储能锂离子电池负极材料的研究热点[3-4]。
目前Li4Ti5O12的制备方法有高温固相法、熔融浸渍法、微波化学法、共沉淀法、溶胶-凝胶法、水热反应法等[3-6]。 虽然共沉淀法[7]等湿化学方法可制备电化学性能优良的材料,但是考虑到工艺复杂程度、生产成本和大规模生产等因素,固相反应法仍然是大规模生产Li4Ti5O12的首选方法。近年来,国内外的学者研究了反应温度[8]、反应时间[9]、原料种类与配比[10]、混料工艺[8]等因素对 Li4Ti5O12负极材料的 电化学性能和循环容量的影响。
高温固相反应法通常以TiO2、Li2CO3或LiOH为原料,经过高温固相反应制备Li4Ti5O12。而该法合成Li4Ti5O12的反应动力学,不仅可从定量角度来揭示反应本质,而且也为优化Li4Ti5O12的制备过程提供重要的理论依据。目前,关于高温固相反应合成Li4Ti5O12的动力学研究鲜少报道,仅高玲[11]、吴可[12]、K.C.Chou 等[13]研究了 LiOH·H2O 和 TiO2合成Li4Ti5O12的非等温动力学,尚未见TiO2和Li2CO3合成Li4Ti5O12动力学的相关研究报道。
笔者主要在Li2CO3-TiO2合成Li4Ti5O12的反应过程和等温动力学研究基础上,对工艺条件做了优化,研究结果可为进一步提高固相反应合成Li4Ti5O12的性能提供基础数据和理论指导。
1 实验
按物质的量比为2∶5称取一定质量的Li2CO3和锐钛矿型TiO2,在行星式球磨机中球磨干燥得到Li2CO3-TiO2混合物,放入箱式电阻炉中,在指定温度下反应一段时间,反应完成后随炉冷却,得到样品。
将Li2CO3、TiO2和Li2CO3-TiO2分别置于瓷坩埚中,用STA 409PC型综合热分析仪记录Li2CO3-TiO2混合物升温过程的热量变化和质量变化,空气流量为30 mL/min,测试温度范围为室温至1000℃,加热速率为20℃/min。
在Li2CO3和TiO2合成Li4Ti5O12的等温动力学研究中, Li2CO3-TiO2混合物分别在 400、450、500、550、600℃下反应一定时间。反应完成后取出样品置于干燥器中自然冷却。用XRD分析试样中各物相的质量分数,计算Li4Ti5O12的产率。
采用D/Max 2500V型X射线衍射仪测定材料的晶体结构和各物相的组成。采用S-3400型扫描电子显微镜观察材料的表面形貌。
将合成好的活性材料Li4Ti5O12、导电剂乙炔黑、黏结剂聚偏四氟乙烯按质量比70∶20∶10置于N-甲基吡咯烷酮中混合均匀,冲片。以Li4Ti5O12电极片为正极、金属锂片为负极,Celgard2400型聚丙烯为隔膜,1 mol/L 的 LiFP6+EC/DEC(体积比为 1∶1)为电解液在SUPER 1220/750型氩气手套箱中组装成电池。采用CT2001A型LAND系列电池测试系统在1.0~2.4 V内测量材料的比容量和循环性能,充放电的电流为80 mA/g。
2 结果与讨论
2.1 TG和XRD分析
图1为Li2CO3-TiO2以20℃/min升温过程的TG-DSC曲线。从图1可知,Li4Ti5O12的合成过程大致可分为以下几个阶段:1)在室温至120℃左右时,连续的微小失重对应天平内气体动力学因素的影响及混合物中残留吸附水的脱除;2)在120~200℃时该阶段体系稳定,几乎没有失重;3)在200~500℃时体系出现了微小的失重,继续升温,开始出现较明显的失重,该阶段为反应开始的阶段;4)在500~700℃时该阶段为主要失重阶段,TG曲线存在一个明显的失重过程,相应质量损失率为15.96%,随着温度的升高,体系的反应速率不断增加;从DSC曲线可见,对应该失重过程,出现了一个明显的吸热峰,吸热峰的位置为591.0℃;5)大于700℃时,体系内基本上没有失重,此后为Li4Ti5O12的形成及晶体完善阶段。
为了确定升温过程中Li2CO3-TiO2的组成和结构变化, 分别测定了 300、400、500、600、700、800 ℃下的反应产物的XRD谱图,结果见图2。由图2可以看出,300℃和400℃时所得产物中只有Li2CO3和TiO2的特征峰,不存在Li4Ti5O12或其他中间产物的特征峰,但在图1的TG曲线上却有微小的质量变化,这表明在400℃前Li2CO3和TiO2已经开始反应,但生成产物的质量较少且为无定形态,故在XRD谱图中没有出现反应产物的特征峰;在400~600℃时,随着反应温度的升高,Li2CO3和TiO2的特征峰强度逐渐减弱,而Li4Ti5O12特征峰的强度逐渐增强,说明Li2CO3和TiO2已经大量反应,并生成了Li4Ti5O12晶体;当大于700℃时,TiO2的特征峰基本消失,只剩下Li4Ti5O12的特征峰,且随着温度的升高,Li4Ti5O12特征峰的强度增加、峰形更加尖锐,说明化学反应在700℃前已经完成,700℃后主要是晶格完善和晶体生长阶段。综合热分析和XRD的结果可知,当反应温度为300~700℃时Li2CO3和TiO2逐渐反应并生成Li4Ti5O12,该反应的理论质量损失率为16.08%,与TG测定的质量损失率(15.96%)基本相近。
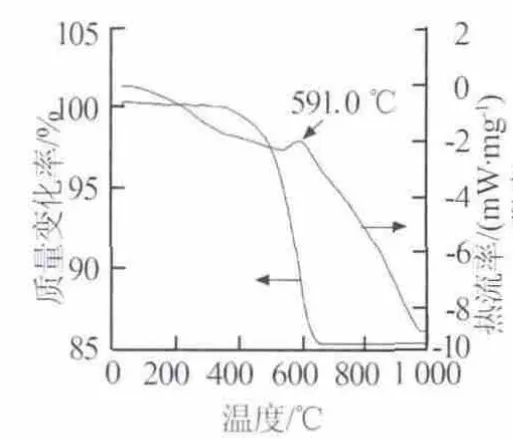
图1 Li2CO3-TiO2的TG-DSC曲线
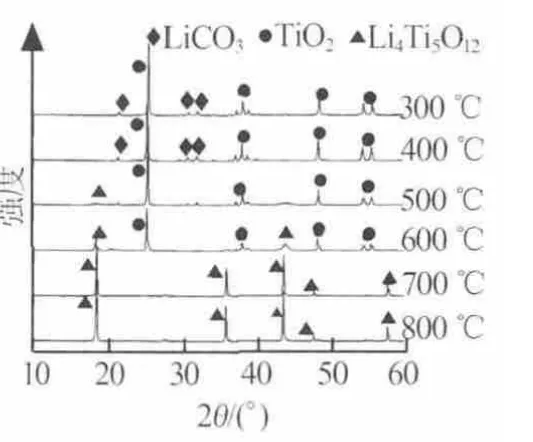
图2 不同合成温度下产物的XRD谱图
2.2 等温动力学分析
图3 为 Li2CO3-TiO2在 400、450、500、550、600 ℃下转化率(α,%)随反应时间的变化曲线。由图3可以看出,随着反应温度的增大,反应速率增加;当反应温度为400、450℃(图3a)时,由于反应的温度较低,最大的转化率只能达到40%和55%左右;而温度为 500~600 ℃(图 3b)时,Li2CO3-TiO2合成 Li4Ti5O12的反应基本上能够在较短的时间内接近100%。
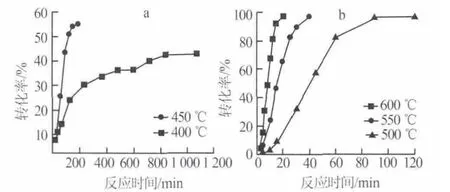
图3 不同反应温度下Li2CO3-TiO2合成Li4Ti5O12的转化率-时间曲线
图3中的相关数据用方程(1)处理,结果见表1:
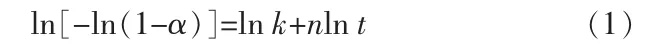
在方程(1)中,直线的斜率对应的n值依赖于反应机理及颗粒形状的参数,因此可以根据n值的大小判定反应的机理函数[14]。对照表1可知,400℃对应的反应模型是三维的Jander方程,其反应过程是扩散控制过程;450℃对应的反应模型是一级动力学方程,其反应过程是相界面反应控制过程;500、550、600℃的指数n值接近2.0,可认为是晶核形成及增长控制,动力学方程为Avrami方程:G(α)=[-ln (1-α)]2。
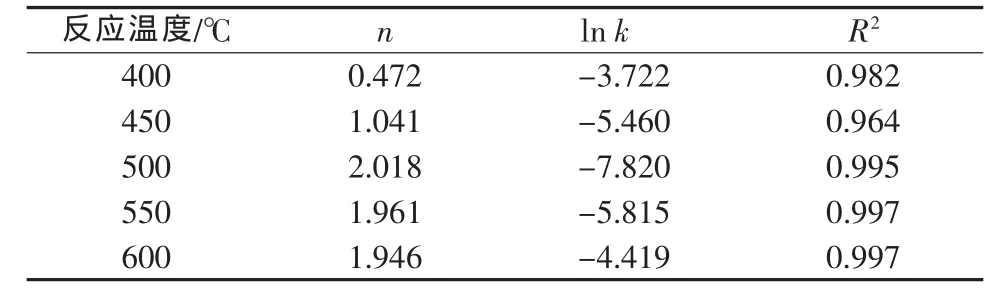
表1 等温动力学分析结果
等温动力学结果表明,当温度为400、450、500~600℃时,Li2CO3-TiO2合成 Li4Ti5O12的反应分属 3种不同的控制过程,因此在利用阿仑尼乌斯(Arrhenius)方程求解反应的活化能时,仅选取具有相同控制过程的500、550、600℃数据。由Arrhenius方程的对数方程ln k=ln k0-E/RT处理表1中500、550、600℃的截距数据,并以lnk对1/T作图,结果见图4。由图4可见,不同温度下反应过程的ln k-1/T成直线关系,相应的方程为ln k=22.011-23015/T,方程的相关系数为R2=0.9954,由此可求出Li2CO3-TiO2合成得到的Li4Ti5O12等温过程的表观活化能E=191.35 kJ/mol。
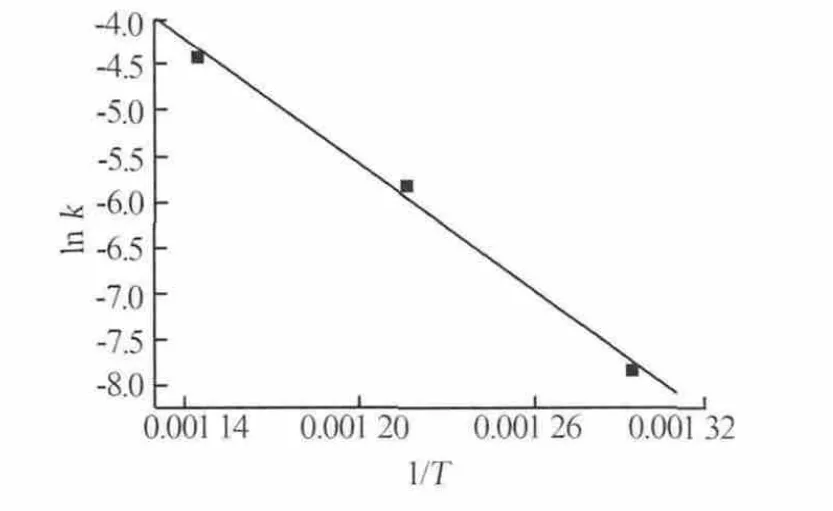
图4 合成Li4Ti5O12过程中ln k-1/T的关系
图5为不同温度下,反应的转化率达到终点时得到的样品微观形貌照片。从图5可以看出,在400℃和450℃时合成的样品颗粒团聚情况明显,只有部分颗粒的形貌为尖晶石型,而温度在500~600℃时,样品颗粒轮廓逐渐不清晰,颗粒间的团聚也逐渐降低。

图5 不同反应温度下Li4Ti5O12样品的表面形貌照片
2.3 工艺优化
由前面的动力学分析可知,Li2CO3和TiO2合成Li4Ti5O12的化学反应在700℃前已经完成,700℃后主要是晶格完善和晶体生长阶段。当温度低于500℃时为扩散控制或相界面化学反应控制,而高于500℃时为晶核的形成与生长控制,且成核速率随着温度的升高而增加。由于高温下成核速率高,有利于得到细小颗粒,提高材料的倍率性能,同时高温还有利于晶体的生长和晶格的完善;因此,为了得到性能良好的Li4Ti5O12,选择反应温度为800℃和850℃,考察了反应时间对Li4Ti5O12的放电比容量和性能的影响,结果见图6。由图6可以看出,在800℃和850℃下合成样品的放电比容量和容量保持率均随着反应时间的增加先升高再下降,其原因可能是随着煅烧时间的延长,晶粒尺寸长大,使充放电过程中Li+嵌入或脱出的路径变长,不利于Li+的传递。与800℃相比,在850℃下合成的Li4Ti5O12循环性能都比较稳定,放电比容量都有所提高,说明850℃更利于反应的进行。其中850℃下反应8 h的产物其初始比容量为171.5 mA·h/g,接近理论容量,25次循环后仍保持在167 mA·h/g左右;反应6 h和10 h时的产物虽然比容量较低,但是其循环性能较好,25次循环以后比容量几乎不变。
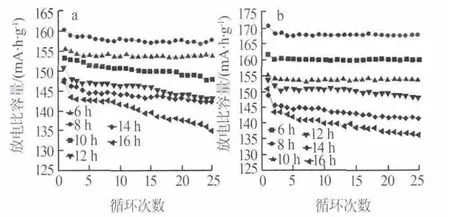
图6 不同反应时间下样品的比容量-循环次数曲线
3 结论
在动力学的基础上,优化了固相反应温度和时间对 Li4Ti5O12的影响:1)400 ℃时 Li2CO3和 TiO2合成Li4Ti5O12为扩散控制过程;450℃的合成过程为相界面反应控制;500~600℃时 Li2CO3和 TiO2合成Li4Ti5O12为晶核形成及增长控制,动力学方程为Avrami方程:G(α)=[-ln (1-α)]2,表观活化能为191.35 kJ/mol。2)在动力学研究基础上,优化了合成工艺,其中850℃反应8 h的产物的比容量最高,且表现出良好的循环性能。随着循环的进行,容量衰减很缓慢,25次循环以后仍保持在167 mA·h/g左右。
[1]ScrosatiB,GarcheJ.Lithiumbatteries:Status,prospectsandfuture[J].J.Power Sources,2010,195(9):2419-2430.
[2]陈立泉.电动车锂离子电池的材料问题[J].中国工程科学,2002,4(11):32-36.
[3]梁科,朱聪,熊杰,等.锂离子电池负极材料Li4Ti5O12的改性研究进展[J].电子元件与材料,2013,32(1):75-78.
[4]杨立,陈继章,唐宇峰,等.锂离子电池负极材料 Li4Ti5O12[J].化学进展,2011,23(2/3):310-317.
[5]王忠勤,李肖雅,伊廷锋,等.Li4Ti5O12负极材料合成研究进展[J].电池工业,2012,17(3):182-185.
[6]刘浩文,刘针邑,唐定国.电极材料Li4Ti5O12制备方法研究进展[J].电源技术,2010,34(7):742-745.
[7]赵鹏,姚彩珍,樊小勇.共沉淀法合成Li4Ti5O12及其性能研究[J].无机盐工业,2010,42(8):34-35.
[8]姚经文,吴锋.锂离子电池负极材料Li4Ti5O12的合成及电化学性能[J].功能材料,2006,37(11):1752-1754.
[9]Guerfi A,Sévigny S,Lagacé M,et al.Nano-particle Li4Ti5O12spinel as electrode for electrochemical generators[J].J.Power Sources,2003,119/120/121:88-94.
[10]许江枫,李建玲,李文生,等.电极活性材料Li4Ti5O12的制备及电化学性能[J].北京科技大学学报, 2007,29(10):1015-1018.
[11]高玲.二次锂离子电池Li4Ti5O12负极材料合成动力学及电化学性能研究[D].北京:北京科技大学,2005.
[12]吴可.混合电化学电容器用Li4Ti5O12材料制备及电化学性能研究[D].北京:北京科技大学,2006.
[13]Chou K C,Qiu W H,Wu K,et al.Kinetics of synthesis of Li4Ti5O12through solid-solid reaction[J].Rare Metals,2006,25(5):399-406.
[14]郑忠,胡纪华.固态反应动力学[M].广州:广东科技出版社,1993,3-5,10-14.
