响应面法优化超声波辅助提取石榴籽中原花青素工艺的研究
2013-08-07孙潇辉丁之恩
李 茜,吕 萍,薛 波,孙潇辉,丁之恩
(安徽农业大学茶与食品科技学院,安徽合肥230036)
石榴(Punica granatum L.)又名海榴、若榴等,为石榴科石榴属落叶灌木或小乔木,具有降血糖、血脂和抗菌、抗肿瘤等功效[1-2]。石榴汁中含丰富的维生素和矿物质,如VA、VB1、VB2、VC、钙、铁、钾、锌等[3-4];石榴籽中主要含有棕榈酸、硬脂酸、亚油酸、油酸、花生酸、山嵛酸、石榴酸、α-桐酸等脂肪酸[5];果皮中富含黄酮类化合物。原花青素(Proanthocyanidins,PC)是从植物中分离得到,在酸性条件下经醇加热处理后能产生花色素的多酚类物质,包括单体和聚合体:单体包含黄烷-4-醇和黄烷-3,4-二醇;聚合体由黄烷-3-醇的单体结构单位聚合而成[6]。原花青素抗氧化活性极强,可清除人体自由基,降低毛细血管通透性,缓解心血管疾病,改善视觉功能,抗辐射,抗过敏,还具有皮肤保健及美容作用[7]。本实验以怀远石榴(薄皮糙品种)为原料,对其原花青素的提取工艺进行探讨,并利用响应面法对提取参数进行优化,为石榴的深度开发提供科学依据。
1 材料与方法
1.1 材料与仪器
安徽怀远涂山石榴(品种:薄皮糙) 安徽省怀远县涂山石榴专业合作社提供;原花青素标准品、甲醇、乙醇、丙酮、乙酸乙酯、乙腈、香草醛、浓硫酸、六偏磷酸钠(SH)、HCl、NaOH 均为分析纯。
ML204/02 精密电子天平 梅特勒-托利多仪器(上海)有限公司;KQ-250DE 型数控超声波清洗器 昆山市超声仪器有限公司;GZX-9146 MBE 数显鼓风干燥箱 上海博迅实业有限公司医疗设备厂;UV-1800 紫外可见分光光度计 上海美诺达仪器有限公司;DL-5-B 飞鸽离心机 上海安亭科学仪器厂;RV10 旋转蒸发仪 广州仪科实验室技术有限公司;DK-S24 型电热恒温水浴锅 上海精宏实验设备有限公司;SHA-B 双功能水浴恒温振荡器 金坛市杰瑞尔电器有限公司;FDU-2100 真空冷冻干燥机 上海爱朗仪器有限公司。
1.2 实验方法
1.2.1 标准曲线的建立[8]配制0.1mg/mL 原花色素标准溶液,分别吸取0.0、1.0、2.0、3.0、4.0、5.0mL 置于6 个10mL 容量瓶中,各加入乙醇溶液定容至10mL,各取1mL 于6 支试管中,分别加入2.5mL 3%香草醛乙醇溶液和2.5mL 30%硫酸乙醇溶液,摇匀后于30℃水浴保温20min,然后在500nm 处测定吸光度,绘制标准曲线。
1.2.2 石榴籽原花青素的提取[9]将洗净的石榴籽置于40℃烘箱内干燥72h,取出粉碎,过40 目筛。精确称取1.0g 石榴籽干粉于50mL 锥形瓶中,按要求加入一定量溶剂提取一段时间,离心,得到原花青素类物质提取液。
1.2.3 石榴籽原花青素得率的测定[10]采用香草醛-硫酸法测定样品中原花青素含量。取样品溶液1mL 按标线制作方法操作,于500nm 处测定吸光度,根据原花青素标准工作曲线计算出样品中原花青素含量,并按下式计算出原花青素得率。
得率(%)= 样品中原花青素含量/样品质量×100
1.2.4 单因素实验 根据参考文献,考察提取溶剂的种类、提取溶剂浓度、pH、料液比、提取时间、提取功率对原花青素提取效果的影响。
1.2.4.1 提取溶剂的选择[11-12]准确称取1.0g 石榴籽干粉,选用pH4.5 的50%不同溶剂(丙酮、甲醇、乙醇、乙酸乙酯、乙腈),在料液比1 ∶30,超声波功率150W 条件下浸提70min,离心,测定提取液吸光度,根据原花青素标准曲线计算出样品中原花青素含量,从而换算出原花青素得率,以得率为考察指标,确定较佳的提取溶剂。重复3 次,取平均值。
1.2.4.2 提取溶剂浓度的确定 准确称取1.0g 石榴籽干粉,其他条件保持不变,考察不同乙醇溶液浓度对原花青素得率的影响,重复3 次,取平均值。
1.2.4.3 pH 的确定 准确称取1.0g 石榴籽干粉,选用50%乙醇溶液进行提取,其他条件保持不变,考察不同pH 对原花青素得率的影响,重复3 次,取平均值。
1.2.4.4 料液比的确定 准确称取1.0g 石榴籽干粉,选用50%乙醇溶液在pH5.0 条件下进行提取,其他条件保持不变,考察不同料液比对原花青素得率的影响,重复3 次,取平均值。
1.2.4.5 提取时间的确定 准确称取1.0g 石榴籽干粉,选用50%乙醇溶液在pH5.0,料液比1∶30 条件下进行提取,其他条件保持不变,考察不同提取时间对原花青素得率的影响,重复3 次,取平均值。
1.2.4.6 提取功率的确定 准确称取1.0g 石榴籽干粉,选用50%乙醇溶液在pH5.0,料液比1∶30 条件下提取70min,考察不同提取功率对原花青素得率的影响,重复3 次,取平均值。
1.2.5 响应面实验设计[13]响应面实验设计因素与水平见表1。

表1 响应面实验设计表Table 1 Factors and the level of response surface analysis
2 结果与分析
2.1 原花青素标准曲线
以原花青素浓度为横坐标,吸光度为纵坐标,得回归方程:y = 3.55x + 0.0011,R2= 0.9995。结果表明,测定在0~0.2mg/mL 范围内线性良好。
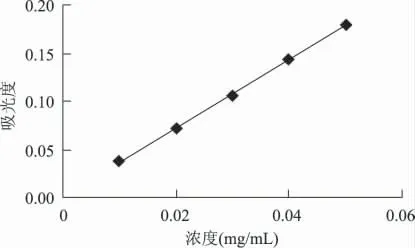
图1 原花青素标准曲线Fig.1 The standard curve of proanthocyanidins
2.2 单因素实验
2.2.1 提取溶剂的选择 原花青素含有羟基,易发生氢键缔合作用,因此要求提取溶剂不仅对其具有良好的溶解性,而且具有氢键断裂作用[6]。由图2 可知,丙酮提取效果最好,但溶剂残留不易除尽,对人体有一定毒害,不适合在食品、药品和化妆品中使用。而乙醇来源丰富,价格低廉,能有效提取原花青素且提取液易于保存、回收,安全性也较高,因此选用乙醇作为提取溶剂。

图2 不同溶剂对原花青素提取效果的影响Fig.2 The impact of proanthocyanidins extracted effect with different solvents
2.2.2 提取溶剂浓度的确定 由图3 可知,原花青素得率随乙醇浓度变化先升后降。可能由于原花青素在植物体内常与蛋白质、多糖以氢键和疏水键的形式形成稳定的复合物,水可以提高原花青素的溶解度,而有机溶剂能促进氢键断裂,使其变成小分子物质,易于游离到胞外,从而萃取到溶剂中[6]。随着乙醇浓度的增加,水溶解带出的原花青素浓度逐渐达到饱和。当水溶解带出的分子与乙醇断开氢键形成的分子数达到平衡时得率最高。继续增大乙醇浓度,一些醇溶性杂质和亲脂性强的成分溶出增加,与原花青素竞争同乙醇-水分子结合,导致提取得率下降[14]。提取液体积分数的增大使原花青素氧化速率加快也是得率下降的原因之一。故而选择浓度为50%的乙醇溶液进行提取。

图3 乙醇浓度对原花青素得率的影响Fig.3 The impact of procyanidins yield with different ethanol concentration
2.2.3 pH 的确定 从图4 可知,加入少量酸可以打开以氢键和疏水键与蛋白质、多糖以及本身相连的原花青素和以共价键与植物组织分子相连的多酚,形成更多的游离多酚和原花青素,酸还可以抑制酚类物质与金属离子发生的沉淀反应,从而提高多酚的得率。但是pH 过小,多酚的溶解性能反而减小,降低得率,可能由于原花青素含有多个羟基,一般呈弱酸性,易溶于碱性溶液中,酸度过低降低其溶解性。pH 过高,可能发生酸碱中和反应破坏原花青素的结构,导致得率下降。故选择pH 为5.0。

图4 pH 对原花青素得率的影响Fig.4 The impact of procyanidins yield with different pH
2.2.4 料液比的确定 根据图5 可以看出,当料液比小于1∶30 后,随溶剂用量增大,得率开始下降。因为料液比达一定程度时,有效成分基本完全析出,此时继续增大料液比,会使更多杂质溶出,而且增加了生产成本[15]。因此选择料液比为1∶30。
2.2.5 提取时间的确定 由图6 可知,在一定时间范围内,原花青素的得率随着提取时间的延长而增加,原因是原花青素没有完全提出。70min 得率达到最大。70min 以后,大部分原花青素被浸提出来,原花青素的氧化处于主导地位,发生自身氧化还原反应,而且原花青素遭到超声波破坏,得率下降[16-17]。故选择提取时间为70min。

图5 料液比对原花青素得率的影响Fig.5 The impact of procyanidins yield with different solid-liquid ratio

图6 提取时间对原花青素得率的影响Fig.6 The impact of procyanidins yield with different extraction time
2.2.6 提取功率的确定 根据图7 可知,在一定功率下,超声波产生的强烈振动、高加速度、强烈的空化效应和搅拌等特殊作用,可以使植物的细胞壁破坏,溶剂渗透到细胞,令原花青素溶于其中,从而提高提取效率。功率过大,细胞中其他物质溶出率也提高,这些物质与原花青素竞争同乙醇-水分子结合,而且,高功率的超声波放出大量的热,破坏原花青素的结构,导致原花青素得率下降[18]。因此选择125W作为提取功率。
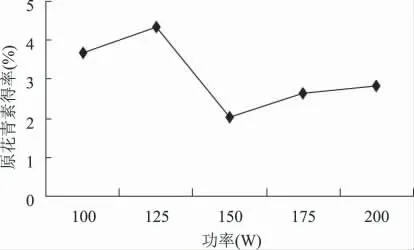
图7 提取功率对原花青素得率的影响Fig.7 The impact of procyanidins yield with different extraction power
2.3 响应面分析法优化实验设计
2.3.1 响应面实验设计及结果 采用Design-Expert V8.0.6 软件对实验数据进行回归分析,可以求出影响各因素一次效应、二次效应及其交互效应的关联方程,对超声波辅助提取石榴籽原花青素的影响因素进行条件优化,并作出响应面图。多元回归拟合分析得到的得率与各因素变量间的二次方程模型为:


表2 响应面分析实验设计及结果Table 2 Experimental design for response surface analysis and corresponding experimental data
根据表3 可知,用上述回归方程描述各因素与响应值间的关系时,因变量与各自变量间的线性关系显著,模型的显著水平小于0.05,回归方程模型极显著,且方程失拟项不显著,表明该方程对实验的拟合情况好。模型的校正决定系数为0.9904,说明该模型能解释99.04%响应值的变化,仅有约0.96%不能用该模型解释。信噪比为43.573,远大于4,说明可信度很高。相关系数为0.9952,说明该模型拟合程度良好,预测值和真实值之间有较好的相关性,实验误差小,因此可用此回归方程对实验结果进行分析预测[19-20]。由F 值可以得到各因素对得率影响从大到小的顺序依次为:料液比(X3)、pH(X2)、乙醇浓度(X4)、功率(X1)。
图8~图12 是从实验得到的回归优化响应面图,从图中可看出各因素在提取过程中的交互作用,由于X1X3交互作用不显著,故不再列出。响应面图的曲面越陡,交互作用越显著,反之越不显著。等高线的形状也可反映交互效应的强弱,椭圆形表示交互作用显著,圆形则与之相反[21]。比较图8~图12 可知,料液比(X3)曲线相对较陡,因此对原花青素得率的影响最显著;而功率(X1)曲线较为平滑,响应值变化随其数值的变化较小,因此对原花青素得率影响较小。pH(X2)和料液比(X3)的交互作用最显著,表现为等高线形状为椭圆形。

图8 功率、pH 及其相互作用对原花青素得率影响的响应面Fig.8 Response surface showing the effects of power and pH on extraction yield of PC

图9 功率、浓度及其相互作用对原花青素得率影响的响应面Fig.9 Response surface showing the effects of power and concentration on extraction yield of PC
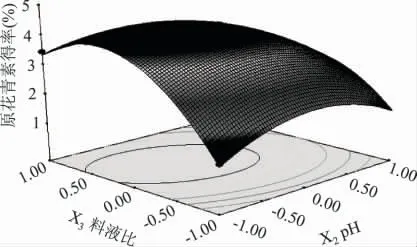
图10 pH、料液比及其相互作用对原花青素得率影响的响应面Fig.10 Response surface showing the effects of pH and solid-liquid ratio on extraction yield of PC
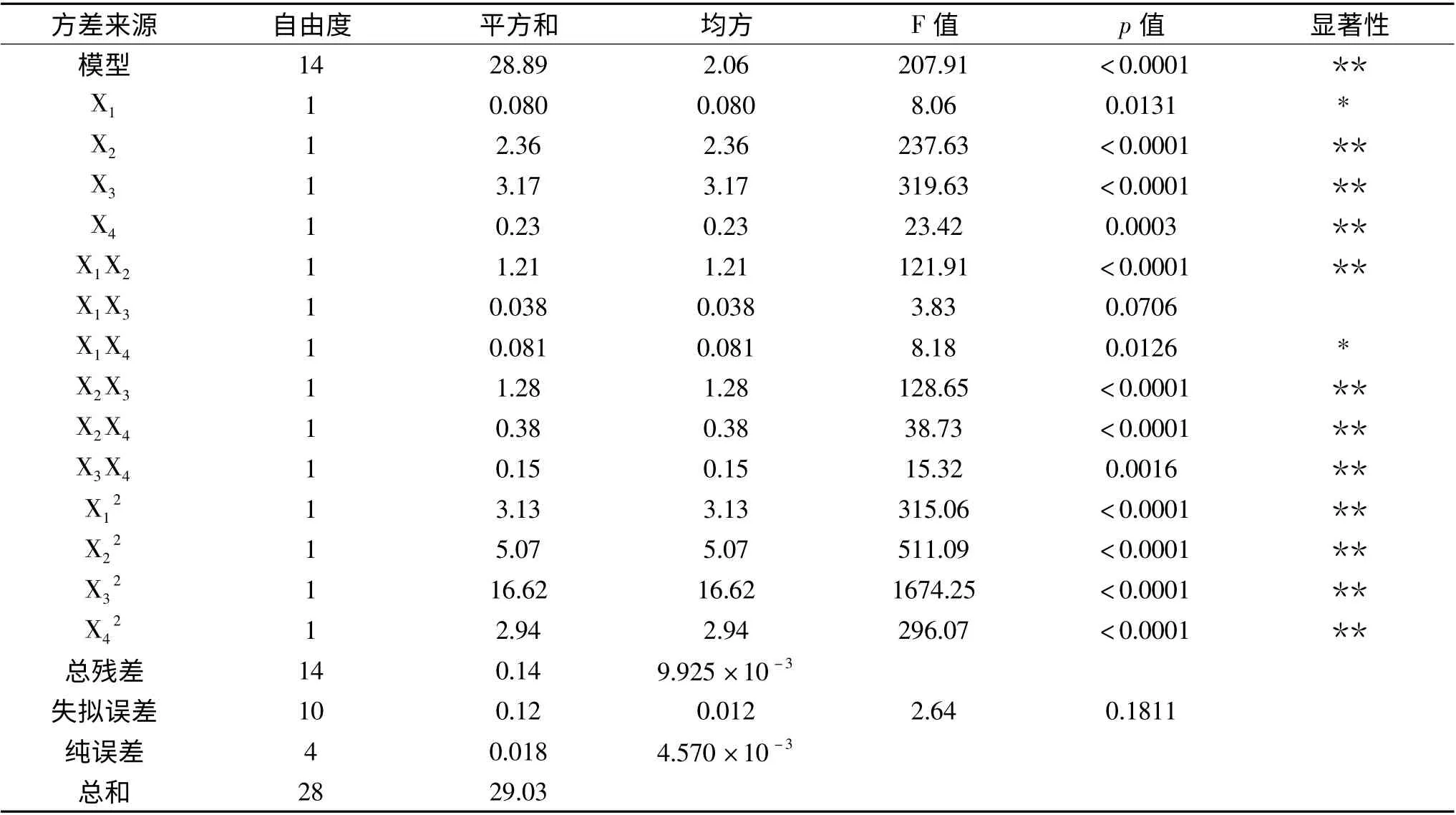
表3 方差分析Table 3 Analysis of variance

图11 pH、浓度及其相互作用对原花青素得率影响的响应面Fig.11 Response surface showing the effects of pH and concentration on extraction yield of PC

图12 料液比、浓度及其相互作用对原花青素得率影响的响应面Fig.12 Response surface showing the effects of solid-liquid ratio and concentration on extraction yield of PC
2.3.2 验证实验 根据模型可预测提取的最优工艺条件为:功率124.06W,pH4.89,料液比1∶33.38,浓度50.88%,在此条件下,原花青素得率理论值可达4.41%。
为检验实验结果是否与真实情况一致,进行近似验证实验。考虑实际操作条件,将最佳工艺条件定为:功率125W,pH5.0,料液比1∶33,浓度51%,进行3 次平行实验,原花青素得率为4.40%,与理论值相比,相对误差约为0.23%,且重复性较好,证明结果可靠。
3 结论
采用超声辅助提取石榴籽中原花青素,通过单因素实验和响应面实验设计对提取工艺条件进行优化,得到较优工艺条件为:功率125W,pH5.0,料液比1∶33,浓度51%,在此条件下,石榴籽原花青素得率为4.40%。
[1]Yamashita Yoko,Okab Masaaki,Natsume Midori,et al.Prevention mechanisms of glucose intolerance and obesity by cacao liquor procyanidin extract in high-fat diet-fed C57BL/6 mice[J].Archives of Biochemistry and Biophysics,2012,527(2):95-104.
[2]Wang Lei,Ho Jeffrey,Glackin Carlotta,et al. Specific pomegranate juice components as potential inhibitors of prostate cancer metastasis[J]. Translational Oncology,2012,5 (5):344-355.
[3]马齐,秦涛,王丽娥,等.石榴的营养成分及应用研究现状[J].食品工业科技,2007,28(2):237-238.
[4]Waheed S,Siddique N,Rahman A,et al.INAA for dietary assessment of essential and other trace elements in 14 fruits harvested and consumed in Pakistan [J] . Journal of Radioanalytical and Nuclear Chemistry,2004,260:523-531.
[5]马齐,秦涛,王丽娥,等.石榴籽油的提取及成分分析[J].粮油食品科技,2008,16(1):29-30.
[6]石碧,狄莹.植物多酚[M].北京:科技出版社,2000.12-35.
[7]Iglesias Jacobo,Pazos Manuel,Lluis Torres Josep,et al.Antioxidant mechanism of grape procyanidins in muscle tissues:Redox interactions with endogenous ascorbic acid and alphatocopherol[J].Food Chemistry,2012,134(4):1767-1774.
[8]孙芸.葡萄籽原花色素聚合度与功效关系的研究[D].无锡:江南大学,2004.
[9]张海晖,李金凤,段玉清,等.板栗壳原花青素提取及其稳定性研究[J].食品科学,2011,32(8):5-9.
[10]郑俊霞,肖付才,李华.香草醛-HPLC 结合法测定葡萄籽超微粉中的原花青素[J].食品科技,2009,34(11):304-308.
[11]王文君,向灿辉,王江,等.超声波法提取紫番薯原花青素的工艺条件研究[J].食品科技,2011,36(2):179-182.
[12]李超,王卫东,郑义,等.原花青素的超声提取工艺研究[J].中国食品添加剂,2010,4:68-71.
[13]陈健,孙爱东,高雪娟,等.响应面分析法优化超声波提取槟榔原花青素工艺[J].食品科学,2011,32(04):82-83.
[14]肖付才,李华,王华.葡萄籽原花青素的提取和检测方法[J].食品研究与开发,2007,28(20):165-169.
[15]杨磊,苏文强,李艳杰,等.正交实验法优选低聚原花青素的提取工艺[J].林产化学与工业,2004,24(2):57-60.
[16]赵兵.循环超声提取技术在中药提取中的应用[C].西安:中药提取技术(国际)研讨会会议论文,2005:26-29.
[17]李超,王卫东,郑义,等.响应曲面法优化原花青素的超声波协同微波提取工艺[J].食品与发酵工业,2009,35(10):167-171.
[18]史振民,张祝莲,杨文选,等.超声法提取芦丁操作条件的最佳选择[J].延安大学学报:自然科学版,2005,18(3):46-49.
[19]李超,王卫东,郑义,等.响应曲面法优化原花青素的超声提取工艺[J].食品工程,2009(11):124-126.
[20]李超,孙月娥,王卫东,等.响应曲面法优化原花青素的高压微波提取工艺研究[J].食品科学,2009,30(18):39-43.
[21]汪志慧,孙智达,谢笔钧.响应曲面法优化双酶法提取莲房原花青素[J].食品科学,2011,32(4):64-68.
