鲢鱼CPIs 的三种电泳鉴定方法的比较研究
2013-08-07李树红任阳阳李艳芳彭海鑫
李树红,任阳阳,+,李艳芳,彭海鑫,曹 坤,李 冉,苏 赵
(1.四川农业大学食品学院,四川雅安625014;2.四川农业大学动物科技学院,四川雅安625014)
我国水域资源辽阔,鱼类种类资源丰富,其中鲢鱼是我国主要淡水养殖品种之一,年产量371.39 万吨,位居第二[1]。鱼类下脚料中含有丰富半胱氨酸蛋白酶抑制因子(cysteine protease inhibitors),简称CPIs[2]。随着对CPIs 的不断深入研究,发现其在细胞凋亡、肿瘤的浸润与转移、临床诊断、抗虫、抗病毒、抗菌以及肉质等方面都起着非常重要的作用[3]。因此,有必要对鲢鱼下脚料中CPIs 进行分离提取,以便充分开发和利用我国淡水鲢鱼资源。目前作者所在研究团队,首次对鲢鱼下脚料中小分子CPIs 进行了分离纯化鉴定[4]。但在研究过程中发现,鲢鱼某些下脚料中CPIs 在初分离阶段,不易检测到抑制活性,为纯化工作带来困难,需要借助其他手段进行鉴定。然而目前常用于鉴定CPIs 的方法,大部分主要基于免疫反应的原理,即单向免疫扩散法(RID)[5]、放射免疫测定法(RIA)[6]、荧光免疫测定法(FIA)[7]等,这些方法都需要制备抗体,过程繁琐,成本昂贵,不适层析纯化过程中鲢鱼CPIs 的快速鉴定,为此,确立一种方便准确的电泳方法鉴定鲢鱼粗提组分中CPIs,不仅利于分离纯化工作的顺利进行,而且对于分析判断其他鱼类各下脚料中的CPIs 活性成分的分布情况,同样具有借鉴意义。本文主要对三种CPIs 的电泳鉴定方法进行了比较分析,以便确定最适于鉴定鲢鱼下脚料粗提样中CPIs 的灵敏度高且分辨效果最佳的电泳鉴定方法,以弥补以明胶为底物的非还原SDS-PAGE 反相酶谱在实际应用中存在的不足。
1 材料与方法
1.1 材料与仪器
鲢鱼下脚料 于四川崇州通威养殖中心采样;怀卵期(IV 期)鲢鱼,宰杀后,立即采卵、肝胰组织,样品液氮速冻后于-80℃超低温冰箱冻藏,使用前4℃解冻。
木瓜蛋白酶(papain)(P4762,10U/mg)、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、SDS、牛血清白蛋白、细胞色素C、DMSO、AMC、Z-Phe-Arg-MCA、偶氮酪蛋白(Azocasein) 美国Sigma 公司;TEMED 美国Bio-Rad;DTT 美国BBI;中分子量(Marker 14.4 ~94ku) 北京天根;中分子量Marker(14.4~97.4ku)美国Promega;蛋白浓度试剂盒 南京建成。
Ultra-stirred cell 8050 超滤杯 美国Millipore;LRH-250 生化培养箱 上海一恒;Mapada V-1200可见分光光度计 上海美谱达;Mini Protein3 垂直电泳槽、JY-ECP3000 电泳仪、Dio-Gel-2000 凝胶成像系统 美国Bio-Rad。
1.2 实验方法
1.2.1 鲢鱼下脚料CPIs 粗提样品的制备 鲢鱼卵CPIs 粗提样:鲢鱼卵经粗提液匀浆、酸处理后,用30ku 超滤膜超滤,取下清,再经3ku 超滤浓缩,制得鲢鱼卵小分子CPIs 浓缩粗提液。
鲢鱼肝胰粗提样:鲢鱼肝胰经匀浆、碱化处理后,立即用冰醋酸回调,此后30%~80%硫酸铵分段盐析。透析后经3ku 超滤浓缩制得鲢鱼肝胰CPIs 浓缩粗提液。
1.2.2 蛋白浓度的测定 参照Bradford[8]法,按照蛋白浓度试剂盒说明测定所用样品的蛋白浓度。
1.2.3 CPIs 抑制活性的测定 荧光合成肽底物法:通过荧光合成肽底物法[9]检测CPIs 粗提样对papain的抑制活性。一个酶活单位定义为:在40℃、pH6.8的反应条件下,能够在1min 内水解底物并释放出1nmol AMC 产物的酶活性量(1nmol AMC/min)。一个抑制活性单位定义为:抑制一个单位的酶活性。
偶氮酪蛋白(Azocasein)法:鲢鱼CPIs 粗提液抑制活性的另一种测定方法Azocasein 法参考本实验室前期方法[9]。通过调节CPIs 的用量,使其抑制木瓜蛋白酶的Azocasein 水解活性的抑制比率在30% ~70%之间。CPIs 的一个抑制活性单位定义为:在37℃的反应条件下,440nm 处降低0.01 个吸光度即为一个单位。
1.2.4 CPIs 的三种电泳鉴定方法 本实验主要采用三种电泳方法对鲢鱼下脚料粗提样中CPIs 进行鉴定。方法A:基本参照Li[10]的反相酶谱电泳法;方法B:Native-PAGE 反相酶谱电泳法;方法C:与papain反应后进行SDS-PAGE 电泳法。具体操作过程和不同之处如下。
1.2.4.1 电泳缓冲液的配制方法 方法A 和方法C的5 × 电泳缓冲液(室温保存):120mmol/L Tris,95mmol/L Gly,0.5% SDS pH8.3。方法B 电泳缓冲液:25mmol/L 的 Tris,192mmol/L 的 甘 氨 酸,pH8.8[11]。方法A 和方法C 的分离胶缓冲液为溶解120mmol/L Tris,0.1% SDS,60mmol/L 硼酸,pH8.9,浓缩胶缓冲液为1.0mol/L Tris-HCl,10%(w/v)SDS,pH6.8;方法B 的分离胶缓冲液为1.5mol/L Tris pH为8.8,浓缩胶缓冲液0.5mol/L Tris pH 为6.8。
1.2.4.2 电泳样品的制备 方法A 和方法B 中要保持样品的活性,因此在样品制备时使用不含还原剂(β-巯基乙醇)的样品缓冲液,其中方法A 的2 ×样品缓冲液为2mL 的0.5mol/L Tris - HC 缓冲液(pH6.8),2mL 甘油,2mL 的20%的SDS,0.5mL 1%溴酚蓝,3.5mL 蒸馏水。方法B 5 × 样品缓冲液为3.1mL 1mol/L Tris-HCl(pH6.8),5mL 甘油,0.5mL 1%溴酚蓝,1.4mL 蒸馏水。方法C 与方法A 除样品缓冲液中含0.1%的β-巯基乙醇外,其他相同。
方法A 和方法B 中样品处理时,样品与样品缓冲液分别于1∶1 和4∶1 混合后,进行电泳。方法C 样品处理时首先要确定反应体系中papain 用量,将2.5μg 的BSA 分别与0.625、1.25、2.5μg 的papain(浓度为1.25mg/mL)混合均匀后,于37℃水浴反应1h和5h。反应完后根据管里剩余反应液体积,按等比例加方法C 样品缓冲液,然后加热煮沸5min,进行电泳。
1.2.4.3 电泳条件 方法A 和方法C 使用17%的分离胶,而方法B 使用8%的分离胶,电泳均采用100V恒压,电泳时间约2h。
1.2.4.4 电泳结束后凝胶的反相酶谱处理方法 方法A:凝胶用30mL 含2.5% Triton X-100 的复性缓冲液于摇床洗3 次,每次15min,将凝胶中的SDS 洗掉。然后用超纯水清洗凝胶2~3 次;复性后的凝胶用15mL 含0.4mg/mL 的papain 的50mmol 的磷酸盐缓冲液(pH7.0)在4℃反应1h;取出凝胶再用15mL,含1% 明胶的50mmol 的磷酸盐缓冲液(pH7.0)在37℃反应8h。方法B:用30mL 含1mmol/L 的DTT的双蒸水于摇床洗3 次,每次15min。然后用15mL含0.4mg/mL 的papain 的50mmol 的磷酸盐缓冲液(pH7.0)在4℃反应1h;用15mL 含1% 明胶的50mmol 的磷酸盐缓冲液(pH7.0)在37℃浸泡8h。方法C:未进行反相酶谱处理。
1.2.4.5 胶的固定染色和脱色 三种方法均用考马斯亮蓝R-250 染色液(考马斯亮蓝0.1%,乙醇40%,冰醋酸10%)染色1h。而后用脱色液(95%乙醇∶冰醋酸∶蒸馏水=4.5∶0.5∶5)脱色至电泳背景色消失,电泳带清晰可见。
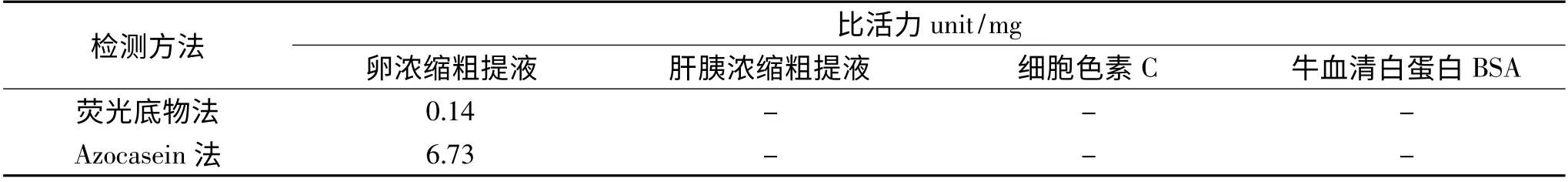
表1 鲢鱼卵、肝胰浓缩粗提液CPIs 抑制活性测定Table 1 The inhibitive activities of CPIs in the concentrated crude extract from Silver Carp eggs and hepatopancreas
1.2.4.6 分子量分析 用Quantity One 电泳图像分析软件(Bio-Rad)分析CPIs 的分子量。
2 结果与讨论
2.1 鲢鱼卵、肝胰浓缩粗提液中CPIs 抑制活性测定
由表1 可知,与鲢鱼卵浓缩粗提液相比,鲢鱼肝胰浓缩粗提液中CPIs 抑制活性,采用荧光底物法及Azocasein 法两种方法均检测不出,可能是肝胰组织中胰蛋白酶和半胱氨酸组织蛋白酶等含量较丰富,干扰抑制活性测定。此外,本实验中作为对照蛋白的细胞色素C、牛血清白蛋白BSA 也无抑制活性。
2.2 Geltain-substrate-SDS-PAGE 反相酶谱法鉴定CPIs
尽管利用荧光底物法和azocasein 法都能够测得鲢鱼浓缩粗提液中CPIs 的抑制活性,但在利用方法A 的反相酶谱电泳鉴定(图1)中,与对照(1 泳道)相比,鲢鱼卵浓缩粗提液(3 泳道),几乎全部被papain水解,无抑制条带出现。这可能是由于鲢鱼CPIs 活性/比活性较低(均比草鱼低约50 倍,资料未发表),而A 法中,聚丙烯酰胺凝胶需在含有1%的明胶中浸泡,胶背景偏深,因此即使粗提样品中存在少量低活性的没有被papain 水解的鲢鱼CPIs,也很难在电泳胶上观察到。同时也很可能是A 法中所用的非离子型去垢剂SDS 导致鲢鱼CPIs 结构不稳定,致使其失活。研究表明鲤鱼小分子Cystatin(CPI 中的一种)表面均匀分布正电荷[12],带负电荷的SDS 很可能导致其构象改变进而丧失抑制活性。

图1 鲢鱼卵浓缩粗提样中CPIs 的明胶-底物-SDS-PAGE 反相酶谱鉴定Fig.1 The Geltain-substrate-SDS-PAGE reverse zymography of silver carp egg coarse extract
此外,尽管对照蛋白细胞色素C 没有papain 抑制活性,但由于电泳上样浓度高(2 泳道),且papain用量或反应时间不足,经反相酶谱处理后(4 泳道),该蛋白仍没有完全水解,还有部分条带清晰可见,这会导致抑制剂鉴定时出现假阳性结果。因此,推测如果待检样品中存在高浓度杂蛋白时,很可能也会出现假阳性。综上分析,一方面说明,利用A 法的反相酶谱法鉴定抑制剂,尤其待测抑制剂活性较低或在电泳上易于失活时,为避免误判,设立对照蛋白十分必要。另一方面也说明,A 法在鉴定结构不稳定、活性低的抑制剂时具有局限性,A 法不适合鉴定鲢鱼下脚料中的CPIs。
2.3 Native-PAGE 反相酶谱电泳法鉴定CPIs
利用Native-PAGE 反相酶谱法(B 法)鉴定鲢鱼卵浓缩粗提液中CPIs(图2),发现,鲢鱼卵浓缩粗提液上样浓度(泳道2)远低于CPIs 的对照蛋白BSA(泳道1),但在经反相酶谱处理后鲢鱼卵浓缩粗提液(泳道4)中条带与其对照(泳道2)相比,几乎没有被papain 水解,目的条带(箭头所示)清晰可见;同时,BSA 被反相酶谱处理过程中的papain 水解殆尽(泳道3),也没有出现假阳性。用不含SDS 的Native-PAGE 反相酶谱法(B 法)鉴定鲢鱼卵小分子CPIs 浓缩粗提物时,CPIs 较好地保持了原有抑制活性,这进一步证明了带负电荷的SDS 小分子CPIs 结构和活性的可能影响作用,也说明很可能鲢鱼卵小分子Cystatin 表面也存在正电荷。同时发现,B 法灵敏度高,清晰准确地鉴定了鲢鱼下脚料中小分子CPIs。但B 法主要是根据蛋白质所带电荷分离蛋白质,虽然可以鉴定CPIs 存在,但不能像A 法那样准确反映分子量大小。不过可以通过电洗脱等方式回收有活性的CPIs 蛋白后,再进行分子量鉴定,步骤相对繁琐。总之,对于电泳上结构或活性不稳定的CPIs,B法是一种比较理想的鉴定方法,因此非常适合鲢鱼卵粗提取样中小分子CPIs 的鉴定。
2.4 与papain 反应后进行SDS-PAGE 电泳鉴定
2.4.1 papain 水解BSA 的反应条件确定 实验设计了采用CPIs 的对照蛋白,即2.5μg 的BSA 与不同量的papain(E-64 滴定法确定其1.25mg/mL 时有效浓度为6.05μmol/L,资料未发表)于37℃进行水解反应,分别于1、5h 取样,检测BSA 的水解情况,以便确定papain 可以完全水解掉BSA 的反应条件,进而将该确定的条件应用于鲢鱼CPIs 粗提取样品。

图2 鲢鱼卵浓缩粗提液中CPIs 的Native-PAGE 反相酶谱鉴定Fig.2 The Native-PAGE Reverse zymographic of the samples from silver carp egg coarse extract
由图3 可见,当反应1h 和5h 时,0.625、1.25、2.5μg 的papain,均可以将2.5μg 的BSA 彻底水解,但是0.625μg 的papain 水解1h(泳道8),仍可见微量的BSA 降解后形成的弥散条带。同时当papain 用量为1.25、2.5μg 时,泳道上出现明显的papain 蛋白条带(如箭头所示),可能会干扰后续实验中对抑制剂条带的判断。因此,确定彻底水解2.5μg BSA 的适宜条件为,papain 用量0.625μg,37℃反应至少5h以上。

图3 papain 水解牛血清白蛋白效果的SDS-PAGEFig.3 The SDS-PAGE of hydrolysis effect of bovine serum albumin by papain
2.4.2 CPIs 浓缩粗提液与papain 反应后的SDSPAGE 鉴定 由图4 分析可知,当鲢鱼卵浓缩粗提样(2.5μg)与0.625μg 的papain 于37℃反应15h 后,其中的非目的蛋白几乎全部水解,唯具有活性的约16ku 和7ku 目的蛋白条带(如箭头所示)保留。样品先与papain 直接反应,而后进行SDS-PAGE 鉴定(C法),这样避免了样品中小分子CPIs 在含有SDS 的电泳上失活的缺点,既保持并体现了粗提液中CPIs的抑制活性,又通过电泳分离,清晰可见抑制条带。因此,C 法是一种很理想的鉴定方法,不仅灵敏度高,鉴定效果好,同时亦可准确反映分子量的大小,可协同B 法充分鉴定鲢鱼CPIs。
2.5 鲢鱼肝胰粗分离样品中CPIs 的鉴定

图4 粗提样与papain 反应后再进行SDS-PAGE 电泳鉴定Fig.4 The SDS-PAGE of CPIs in the silver carp egg coarse extract after hydrolysis by papain
由图5 可见,尽管用荧光底物法和azocasein 法均检测不到肝胰粗分离样品中的CPIs 抑制活性,但是C 法则可以有效判断CPIs 的存在,分子量分布情况(约97、23、16、7ku),如箭头所示,其中约97ku 的高分子量CPI 同样得到了鉴定。因此,本实验利用C法,均较理想地鉴定了不便测活的鲢鱼肝胰浓缩粗提液中CPIs 的存在和分子量分布。

图5 papain 不水解CPIs 电泳Fig.5 The electrophoresis of papain not hydrolysis CPIs
3 结论
我国淡水鲢鱼资源丰富,对其下脚料中含量丰富、具有多种生理活性的CPIs 进行分离提取和鉴定,对于充分开发利用此资源具有重要意义。因此,针对鲢鱼下脚料粗提组分CPIs,确立方便、准确的电泳鉴定方法,在分离纯化工作中尤为重要。
本研究通过对三种CPIs 的电泳鉴定方法进行比较研究,发现对于抑制剂活性较低或在电泳上容易失活的鲢鱼卵小分子CPIs,研究工作中通常采用的以明胶为底物的非还原SDS-PAGE 反相酶谱(A 法)不仅不适宜,而且样品中存在高浓度杂蛋白时,很可能也会出现假阳性,在实际应用中存在局限性和不足;Native-PAGE 反相酶谱法(B 法)虽然灵敏度高,清晰准确,但不能直接反映分子量大小;样品先与papain 直接反应,而后进行SDS-PAGE 鉴定(C 法),灵敏度高,既保持并体现了粗提液中CPIs 的抑制活性,又通过电泳分离,使得抑制条带清晰可见。因此,C 法或者协同B 法,是鉴定鲢鱼下脚料粗提液中CPIs 的理想、有效方法。此外,本研究也说明,在对蛋白性抑制剂进行电泳鉴定时,需要根据抑制剂的活性、电泳稳定性等实际情况,分析判断,选择合理的电泳鉴定方法。
[1]农业部渔业局.中国渔业统计年鉴[M].北京:中国农业出版社,2012.
[2]Tzeng S,Wu H C,Sung W C,et al. Purification and characterization of cysteine proteinase inhibitors from crucian carp Carassius auratus eggs[J].Fish Science,2009,75:1453-1460.
[3]Dubin G.Proteinaceous cysteine protease inhibitors[J].Cellular and Molecular Life Sciences,2005,62:653-669.
[4]宋川.鲢鱼卵CPIs 的纯化鉴定及其抑制鱼糜凝胶软化的研究[D].雅安:四川农业大学,2010.
[5]Lofberg H,Grubb A.Quantitation of gamma-trace in human biological fluids:Indications for production in the central nervous system[J]. Scandinavian Journal of Clinical and Laboratory Investigation,1979,39(7):619-626.
[6]Cattaneo A,Sansot JL,Prevot D,et al.Cysteine proteinsaes and their inhibitors[M].Berlin:Walter de Grugter,In:Turkv,ed,1986:507-516.
[7]Randers E,Erlandsen EJ.Serum cystatin C as an endogenous marker of the renal function-a review[J].Clinical Chemistry And Laboratory Medicine,1999,37(4):389-395.
[8]Bradford M M. A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein dye binding[J].Analytical Biochemistry,1976,72:248-254.
[9]宋川,李艳芳,任阳阳,等.鲢鱼卵高分子质量CPI-I 的纯化与鉴定[J].食品科学,2012,33(13):100-103.
[10]Li D K,Lin H,Kim S M.Purification and characterization of a cysteine protease inhibitor from Chum Salmon(Oncorhynchus keta)Plasma[J].Journal of Agricultural and Food Chemistry,2008,56,106-111.
[11]汪家政,范明.蛋白质技术手册[M].北京:科学出版社.2000,111-123.
[12]Su Y C,Lin J C,Liu H L.Homology model and molecular dynamics simulation of carp ovum cystatin[J]. Biotechnology Progress,2005,21(4):1315-1320.
