冻藏方式对猪肉肌原纤维蛋白氧化及凝胶特性的影响
2013-05-15潘君慧刘泽龙
潘君慧,刘泽龙
(1.浙江省亚热带作物研究所,浙江温州325005;2.中粮营养健康研究院,北京100020)
冻藏肉是目前肉类产品进出口贸易和地区间流通的主要产品形态,也是我国肉制品未来发展的方向之一。在冻藏过程中,肉制品的质构、风味、颜色会发生不可逆转的劣变。近年的研究证据显示,除了脂质的氧化,蛋白冷冻变性外,蛋白氧化也是导致冻藏肉品品质劣化的重要原因[1-2]。在肉及肉制品中,肌原纤维蛋白作为主要蛋白质,对肉蛋白功能尤其是凝胶性起主要作用。肌原纤维蛋白对活性氧的攻击非常敏感,受氧化后其结构会发生显著改变如形成蛋白聚集体等,而这些现象均会使蛋白质的凝胶性发生较大变化[3]。因此,寻找合适的措施控制冻藏过程的氧化,并且保持冻藏肉肉品品质和蛋白功能具有重要研究意义。本文从实际体系研究出发,主要讨论了三种包装处理的冻藏肉中肌原纤维蛋白的凝胶特性,以阐明储藏方式对肌肉蛋白凝胶功能性质的影响。
1 材料与方法
1.1 材料与仪器
实验用肉 实验选取新鲜猪后腿肉(购于当地乐购超市,宰后1d),经过剔除筋膜后通过三遍切片机切片切丁(10mm×10mm×10mm),混匀后取部分肉(或提取肌原纤维蛋白)作为空白进行相关指标的测定,其余部分分装后按三种方式包装:1号处理为普通密封包装、2号处理为混合添加抗坏血酸、α-生育酚和茶多酚(各0.2%,w/w)后进行普通密封包装、3号处理为真空密封包装,样品被放入-18℃冰箱储藏放置24周,并在第2、4、8及24周各取样约20 g进行分析。
超纯水 美国Millipore公司;2,4-二硝基苯肼(DNPH) 美国Sigma公司;其它试剂(分析纯) 国药集团化学试剂有限公司。
UV-2800H型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;BVPJ-500TS真空包装机 嘉兴艾博不锈钢机械工程有限公司;DS-1高速组织捣碎机 上海精科实业有限公司;Avanti J-26 XP高速冷冻离心机 美国Beckman公司;AR1000流变仪英国TA Instrument公司;T18 basic高速均质机 英国IKA公司。
1.2 实验方法
1.2.1 肌原纤维蛋白的提取 冻藏肉在4℃经过6h解冻,用5倍提取缓冲液(0.1mol/L NaCl,2mmol/L MgCl2,1mmol/L EDTA,10mmol/L K2HPO4,pH7.0)匀浆后离心(2000g,10min),重复四次并在第四次离心前用四层纱布过滤并将pH调至6.0,最后得到的蛋白膏保存于冰盒中备用。蛋白浓度用双缩脲法测定。
1.2.2 羰基的测定 参考Levine等人测定羰基含量的方法,读取样品在370nm下的吸光值,蛋白质羰基衍生物的含量(nmol/mg蛋白)使用摩尔吸光系数为22000M-1cm-1计算[4]。
1.2.3 K-ATP酶活性的测定 参考Katoh等人[5]的方法,测定 K-ATPase酶活。酶活力表示为:μmol Pi/mg蛋白/10min。
1.2.4 蛋白凝胶流变学特性的测定 使用流变仪测定肌原纤维蛋白在程序升温和降温过程中凝胶形成所产生的力学变化。设定的主要参数是:采用4cm直径的平板夹具,对混合蛋白进行温度扫描,以2℃/min的速率从20℃升至75℃,每个温度点的平衡时间为30s,最大应变力为0.02,单频频率为0.1Hz,狭缝为1mm。在平板夹具上盖好保护盖并滴加硅油密封后进行测定。
1.2.5 蛋白凝胶的制备 将5g浓度为30mg/mL肌原纤维蛋白溶液置于瓶底玻璃管中(50mm×20mm)离心(800g,1min,4℃)除去气泡,然后置于恒温水浴锅中,从20℃开始以1.2℃/min的速率升温,至75℃时取出迅速置于冰浴中冷却。
1.2.6 蛋白凝胶持水性 凝胶(约5g,记为W1)在4℃静置过夜后,移至50mL的离心管中并记重(W2),离心(10000g,15min,4℃)。倒掉离心出的水,将离心管倒置于铺有吸水纸巾的桌面上,15min后称重(W3)。蛋白凝胶持水性计算如下:

1.2.7 数据统计 本实验所有数据均为2次重复3次平行。数据处理使用Statistix 9.0软件进行方差分析和显著性分析(LSD法),不同显著性数据用不同字母标记。
2 结果与讨论
2.1 冻藏肉储藏过程中蛋白羰基与酶活变化
由图1中可见,普通密封包装样品的蛋白羰基含量均高于其他两种处理方式;在储藏8周内,复合抗氧化剂的添加使得蛋白羰基维持在比较低的水平(p>0.05),随着储藏时间的延长,由于抗氧化剂的消耗,蛋白羰基有所增加。另外,也还可能由于储藏过程中抗坏血酸转变为脱氢抗坏血酸与肌肉中的微量过氧化氢和铁离子形成金属催化氧化体系,加剧了蛋白在储藏后期的氧化[3,6]。而氧气的去除(3号)可以有效抑制储藏期间蛋白羰基的生成(p>0.05)。

图1 冻藏及不同包装处理对肌原纤维蛋白羰基含量的影响Fig.1 Effect of frozen storage on protein carbonyl content of myofibrillar protein in muscle by different packaging treatments
从图2中可以看出,由于肌球蛋白头部酶活性对氧化很敏感,1号和3号样品的肌球蛋白的ATP酶活和文献报道相一致:总体都呈现出下降的趋势,表明肌球蛋白头部构象的变化[7-8]。除氧化影响外,酶活的损失可能更多的与在冷冻和解冻过程中内源蛋白酶类对肌球蛋白头部水解有关[9]。在2号处理中,为抑制氧化而添加的复合抗氧化剂并未起到稳定肌球蛋白构象的作用,反而在储藏前期,直接或者间接影响了肌球蛋白头部活性区域的氨基酸残基,抑制了肌球蛋白的ATP酶活。

图2 不同包装处理冻藏后对肌球蛋白K-ATP酶活性的影响Fig.2 Effect of different packaging treatments on myosin K-ATPase activity during 24-week frozen storage
2.2 冻藏后的肌原纤维蛋白凝胶流变特性
三种处理肉肌原纤维蛋白的流变学特征(弹性模量,G')见图3。空白样品的流变曲线显示,在45~50℃有一次凝胶转变,随后在50~57℃有一个肩峰为第二次凝胶转变。第一次凝胶转变过程中,主要由于肌球蛋白重酶解肌球蛋白变性[10],蛋白间的相互作用增强,蛋白开始聚集,凝胶网络开始形成。G'在47~50℃的下降,主要原因在于肌球蛋白的轻酶解肌球蛋白部分发生变性,并导致了肌球蛋白丝流动性的上升。随着温度继续增加,肌球蛋白凝胶加速形成,肌动蛋白变性增强凝胶强度使得弹性模量持续上升。
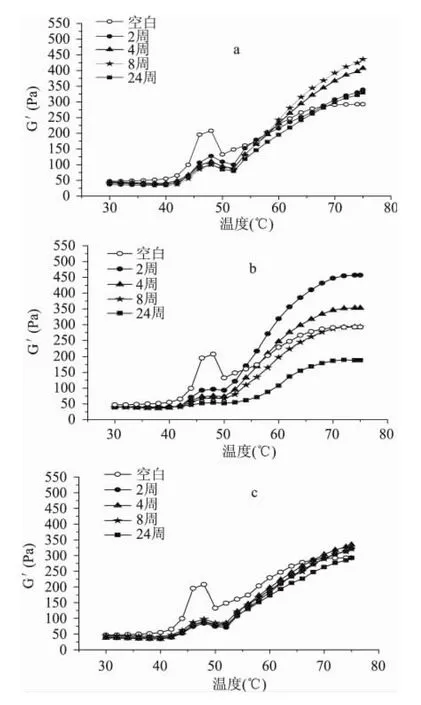
图3 三种处理样品冻藏后肌原纤维蛋白凝胶的弹性模量变化Fig.3 Changes in storage modulus of myofibrillar protein gel made from three treatment samples during frozen storage
从图3可以看出,经过冻藏以后,三种样品第一个凝胶转变温度的蛋白变性峰均有不同程度减弱,证实了在冷冻过程中肌球蛋白头部均发生了部分变性。根据终贮能模量(终G')所示,样品的凝胶能力均呈现先增强后减弱的趋势,以1号和2号样品更为明显。此外,通过图3a与3c的比较,可以发现冻藏时间对3号样品肌原纤维蛋白凝胶的流变特性影响不大,这也与图1中蛋白羰基变幅不大相对应;而图3a中不同时间的储藏对蛋白凝胶的形成有明显影响,由于1号样品中未除去氧气,可以断定氧化是重要的影响因素。另外,肌球蛋白头部的氧化并未影响凝胶最终强度,结合文献报道推断冻藏过程中的肌球蛋白尾部的氧化影响了凝胶的终点弹性模量[10]。
2.3 冻藏后肌原纤维蛋白凝胶持水性
由图4可见,在2~4周后,1号、2号样品凝胶持水力相比空白样品有显著降低。已知蛋白凝胶通过毛细作用和蛋白水合作用束缚水分。虽然以上样品由于蛋白氧化增强了肌原纤维蛋白的凝胶能力,但较高程度的氧化可能会破坏精细网络结构的形成,反而降低了凝胶网络束缚水分的能力[10]。在三种样品中,2号样品的凝胶持水性降低尤为显著,这可能由于2.1中提到的脱氢抗坏血酸参与下的金属催化氧化体系,以及形成了四价铁血红蛋白自由基而加速了蛋白肌原纤维蛋白氧化[3]。真空包装样品(3号)在储藏期内的凝胶持水力变化幅度较小,且到24周还略有升高。这可能由于此时蛋白残基的氧化修饰改变了蛋白表面电荷以及氢键,反而使肌原纤维蛋白的水合能力略有增加[11]。
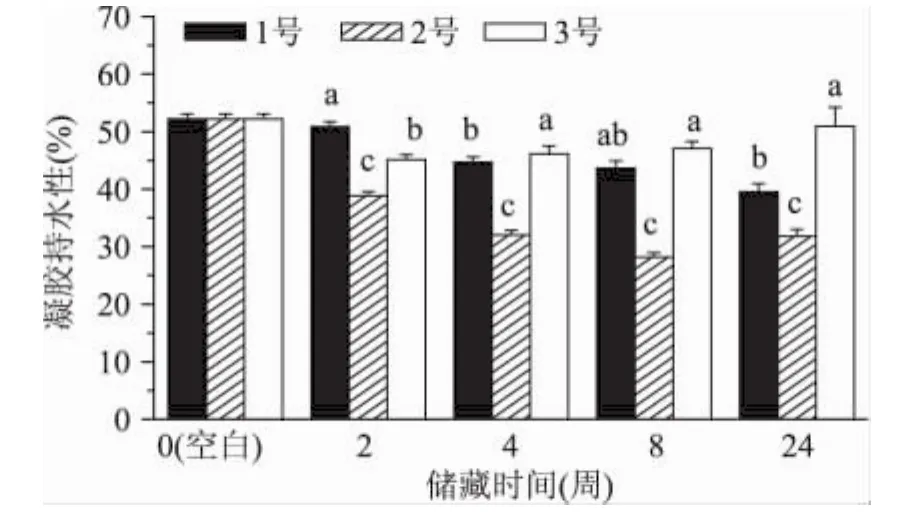
图4 冻藏后不同包装处理肉的肌原纤维蛋白凝胶持水性Fig.4 Water holding capacity of myofibrillar protein gel from different treatment samples during frozen storage
3 结论
采用普通密封包装以及添加复合抗氧化剂的的样品随着冻藏过程中氧化程度由轻到重,肌原纤维蛋白的凝胶能力均呈现出先增强后减弱的趋势,但增强的凝胶能力并未改善凝胶的持水能力。其中,所用复合抗氧化剂在半年储藏期内抑制冷冻肉蛋白氧化以及保持肌原纤维蛋白功能方面尚未达到理想效果。真空包装尽管在防止蛋白氧化,保持肌原纤维凝胶能力及持水性方面有较好效果,但已知该包装技术会增加肉品的汁液损失[12]。因此,还需要进一步研究抗氧化剂的复配,并寻找合适的措施综合控制冷冻肉蛋白氧化及保持蛋白功能。
[1]Leygonie C,Britz T J,Hoffman L C.Impact of freezing and thawing on the quality of meat:Review[J].Meat Science,2012,91:93-98.
[2]Lund M N,Heinonen M,Baron C P,et al.Protein oxidation in muscle foods:A review[J].Molecular Nutrition & Food Research,2011,55:83-95.
[3]Xiong Y L,Park D,Ooizumi T.Variation in the Cross-Linking Pattern of Porcine Myofibrillar Protein Exposed to Three Oxidative Environments[J].Journal of Agricultural and Food Chemistry,2008,57:153-159.
[4]Levine R L,Williams J A,Stadtman E R,et al.Carbonyl assays for determination of oxidatively modified proteins[J].Methods in Enzymology,1994,233:346-357.
[5]Katoh N,Uchiyama H,Tsukamoto S,et al.A biochemical study on fish myofibrillar ATPase[J].Nippon Suisan Gakkaishi,1977 43:857-867.
[6]Utrera M,Estévez M.Oxidation of myofibrillar proteins and impaired functionality:Underlying mechanisms of the carbonylation pathway[J].Journal of Agricultural and Food Chemistry,2012,60:8002-8011.
[7]Ooizumi T,Xiong Y L.Biochemical susceptibility of myosin in chicken myofibrils subjected to hydroxyl radical oxidizing systems[J].Journal of Agricultural and Food Chemistry,2004,52:4303 -4307.
[8]Wagner J R,Añó■ M C.Effect of frozen storage on protein denaturation in bovine muscle[J].International Journal of Food Science & Technology,1986,21:547-558.
[9]Benjakul S,Visessanguan W,Tueksuban J.Changes in physico-chemical properties and gel-forming ability of lizardfish(Saurida tumbil)during post- mortem storage in ice[J].Food Chemistry,2003,80:535-544.
[10]Xiong Y L,Blanchard S P,Ooizumi T,et al.Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein[J].Journal of Food Science,2010,75:C215 -C221.
[11]Cheng Q,Sun D W.Factors affecting the water holding capacity of red meat products:A review of recent research advances[J].Critical Reviews in Food Science and Nutrition,2008,48:137-159.
[12]Payne S R,Durham C J,Scott S M,et al.The effects of non-vacuum packaging systems on drip loss from chilled beef[J].Meat Science,1998,49:277-287.
