硫酸葡聚糖对低离子强度下罗非鱼肌球蛋白热变性聚集的抑制及其机制
2018-03-11周春霞洪鹏志
李 婷 周春霞 冯 瑞 洪鹏志
(1. 广东海洋大学食品科技学院,广东 湛江 524088;2. 广东省水产品加工与安全重点实验室,广东 湛江 524088)
肌球蛋白是鱼类肌肉蛋白的主要成分,该蛋白以2个球状头部和1个棒状尾部为骨架构成了约160 nm的长型不对称结构[1]。肌球蛋白为盐溶性蛋白,在高盐溶液(600 mmol/L KCl)中,肌球蛋白以单体或可溶性寡聚体[2]形式分散在溶液中,体系热稳定性较好,这在食品的保水性和质地方面起着非常重要的作用。而在低盐溶液(<200 mmol/L KCl)中,肌球蛋白不易溶解[2],受热易发生变性聚集并伴有弱凝胶形成的趋势,不利于水产品的精深加工。热稳定性是蛋白质重要的功能特性,通过添加化学助剂来改善蛋白质热稳定性的研究繁多。一些多糖如果胶、卡拉胶能够吸附在球状蛋白质表面形成一层“保护膜”,通过搭建静电屏障来提高蛋白的热稳定性[3];生物类表面活性剂鼠李糖脂[4]和海藻糖脂[5]可以提高蛋白质的热解折叠温度,并且随添加量的增加,蛋白质热解折叠温度进一步提高,但研究对象均以牛血清白蛋白(BSA)为模型。Takai等[6]证明精氨酸可以显著提高猪肉肌球蛋白在生理盐溶液中的溶解度而不影响其二级结构;Gao等[7]向0.1 mol/L NaCl中添加5 mmol/L 组氨酸后,鲤鱼肌球蛋白溶解度明显增加,形态学结果观察到在热处理过程中组氨酸诱导肌球蛋白形成了更细的聚集体和蜂窝状网络;但时娇娇[8]51-52、石彤[9]的研究显示精氨酸、组氨酸对低离子强度下鱼肉肌球蛋白的热聚集无明显抑制效果。
相较于植物蛋白而言,水产蛋白热稳定性较差,而一些改善剂如果胶、卡拉胶等大分子多糖通常需要特定的pH和较高的温度条件才能溶解,在改善鱼肉蛋白热稳定性时受到了限制。硫酸葡聚糖(dextran sulfate,DS)在室温及中性条件即可溶解,更适合应用于食品体系。研究[10-11]证实DS可有效抑制蛋白质的热聚集,但鲜见在鱼肉蛋白中的应用。为此,本研究以肌球蛋白为模型,在低离子强度(1,50,150 mmol/L KCl)热处理(40,50,60,70,80 ℃,1 ℃/min)条件下,探讨DS对肌球蛋白热变性聚集的抑制效果及作用机理,提高对带电多糖—蛋白质相互作用的认识,为肌球蛋白的基础研究提供理论参考。
1 材料与方法
1.1 材料与主要试剂
鲜活罗非鱼:湛江市场(2018年3~6月);
硫酸葡聚糖(dextran sulfate,DS)、8-苯胺基-1-萘磺酸(8-Anilino-1-naphthalenesulfonic acid,ANS):分析纯,美国Sigma公司;
Lowry蛋白浓度测定试剂盒:上海荔达生物科技有限公司。
1.2 仪器与设备
高速冷冻离心机:Avanti J-26sxp型,美国贝克曼公司;
恒温水浴锅:TU-20HT型,英国比比科技有限公司;
圆二色谱仪:Chirascan V100型,英国应用光物理公司;
纳米粒度分析仪:Nano-2s MPT-2型,英国马尔文仪器有限公司。
1.3 试验方法
1.3.1 肌球蛋白的提取 根据洪伟[12]的方法,所用溶液均提前预冷至4 ℃。
1.3.2 样液的制备 用Tris-HCl缓冲液(20 mmol/L Tris-HCl,1,50,150 mmol/L KCl,pH 7.0)对肌球蛋白透析24 h。Lowry法[13]测定蛋白浓度,用对应的Tris-HCl缓冲液稀释至2.0 mg/mL。
将肌球蛋白溶液分为两组:① 未添加组;② 添加组:向不同离子强度(1,50,150 mmol/L KCl)下肌球蛋白溶液中加入0.4 mg/mL的硫酸葡聚糖。
1.3.3 程序升温处理 运行程序控温热处理软件,设置升温速率为1 ℃/min。用温度计测量样液温度为40,50,60,70,80 ℃时[14]取出备用。对照组温度为4 ℃。
1.3.4 浊度的测定 稀释蛋白浓度至0.5 mg/mL,在350 nm 处测吸光度[14]。
1.3.5 溶解度的测定 参照文献[13]。溶解度按式(1)计算:
(1)
式中:
c——溶解度,%;
m1——上清液中可溶性蛋白浓度,mg/mL;
m2——离心前蛋白浓度,mg/mL。
1.3.6 二级结构α-螺旋含量分析 蛋白浓度稀释为0.1 mg/mL,设置扫描范围为190~260 nm。样品池光径为1 mm,对照组测量温度为4 ℃。使用仪器控温程序进行热处理,升温速率为1 ℃/min,在40,50,60,70,80 ℃时测试。根据Ogawa等[15]的方法计算α-螺旋含量。
1.3.7 表面电势的测定 固定蛋白浓度1 mg/mL,设置He-Ne激光为633 nm、散射角为90°[16]对样品进行除尘。使用Smoluchowski方程计算电势值。
1.3.8 透射电镜分析 固定蛋白浓度0.25 mg/mL滴于150目铜网,超纯水多次冲洗后用0.5%~1.0%的醋酸双氧铀负染[17]并放入烘干箱(37 ℃)烘干。
1.4 数据处理
使用Origin 9.0软件对文中各数据作图,用SPSS 19.0比较分析差异显著性(P<0.05)。
2 结果与分析
2.1 硫酸葡聚糖对肌球蛋白浊度的影响
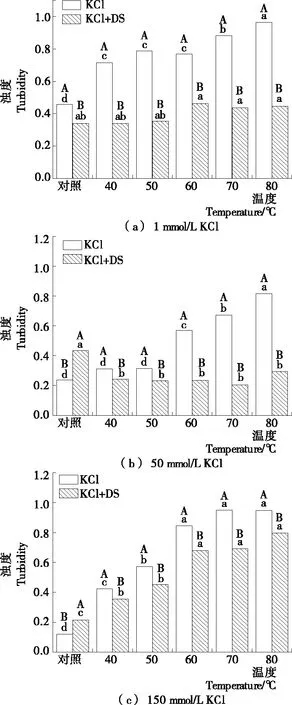
固定肌球蛋白2.0 mg/mL,加入0.4 mg/mL硫酸葡聚糖(DS)后,用对应离子强度的Tris-HCl缓冲液稀释至0.5 mg/mL,肌球蛋白体系浊度的变化如图1所示,在低离子强度(1 mmol/L KCl)下,肌球蛋白呈不溶状态[2],蛋白溶液浑浊,可检测的浊度值高,热处理后肌球蛋白分子进一步聚集,体系浊度明显增大(P<0.05)。加入DS后,DS完全溶解,体系浊度值明显减小(P<0.05),热处理过程中浊度变化不明显,与对照组比较,浊度明显降低(P<0.05),表明DS能明显抑制低离子强度下肌球蛋白的热聚集[图1(a)]。
随着离子强度增加,分子间静电相互作用增加,肌球蛋白纤丝状聚集体逐渐解聚[8]12-13,体系浊度逐渐减小。在生理离子强度(150 mmol/L KCl)下,溶液中盐离子所产生的反离子胶束作用[18]抑制了DS的溶解,肌球蛋白体系浊度明显增大(P<0.05),但与未添加DS的肌球蛋白比较,热处理后体系浊度明显降低(P<0.05)[图1(c)],肌球蛋白体系热聚集情况有所改善。
2.2 硫酸葡聚糖对肌球蛋白溶解度的影响
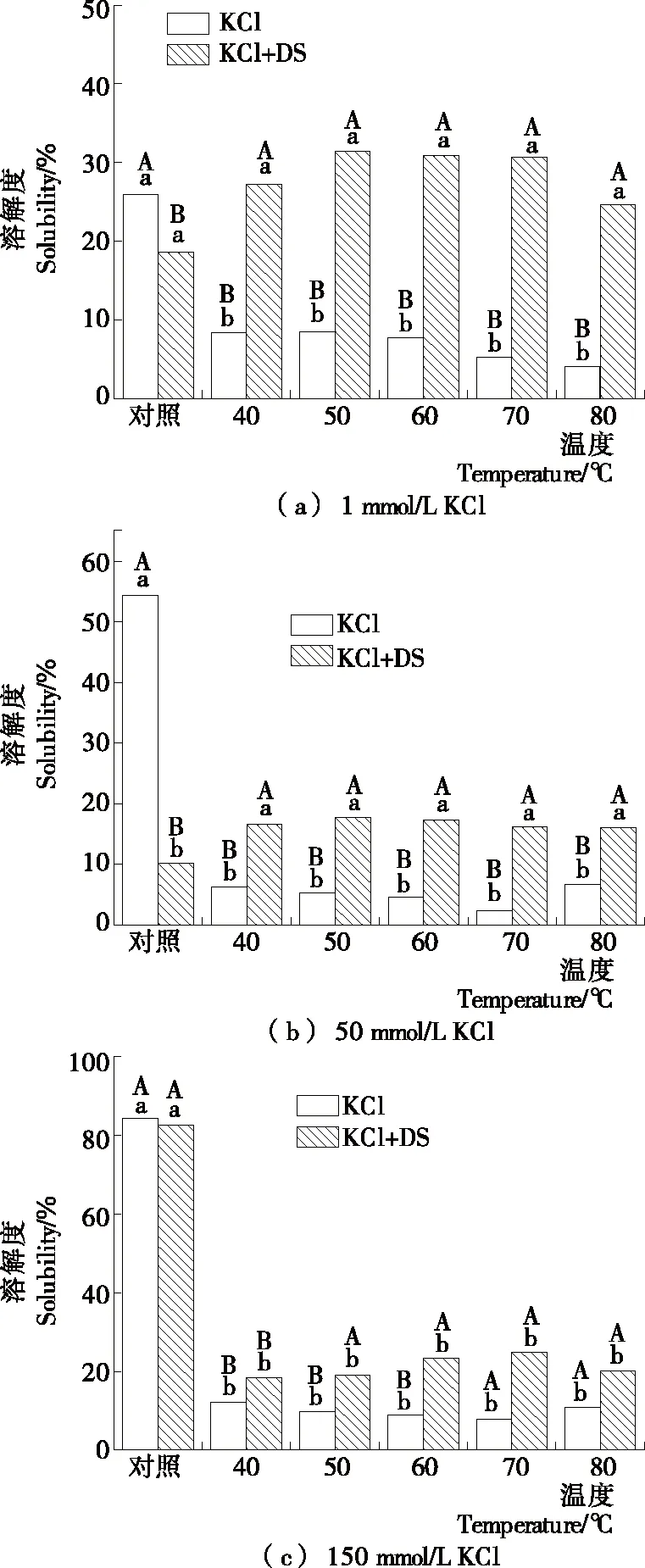
如图2所示,低离子强度(1 mmol/L KCl)下肌球蛋白的溶解度仅为25%,热处理后溶解度明显下降(P>0.05),当温度为40 ℃时,肌球蛋白溶解度下降到约8%;添加DS后,肌球蛋白溶解度降低(P<0.05),表明未经热处理时DS对低离子强度下肌球蛋白无增溶效果,可能是肌球蛋白和DS均属于大分子产生了相分离现象[19],DS此时无法与肌球蛋白完全结合。但在热处理过程中含有DS的肌球蛋白溶解度变化不明显,当温度达到50 ℃时,其溶解度仍高于30%,表明DS能明显抑制低离子强度下肌球蛋白的热聚集。
随着离子强度的升高,肌球蛋白溶解度随之升高,这是因为盐离子可诱导肌球蛋白纤丝解聚,分子以单体或可溶性寡聚体形式存在[20]。因此,在生理离子强度(150 mmol/L KCl)下可达84%。添加DS后,50 mmol/L KCl溶液中肌球
不同大写字母表示同一温度之间差异显著(P<0.05);不同小写字母表示同一样品之间差异显著(P<0.05)
蛋白溶解度降低(P<0.05),生理离子强度(150 mmol/L KCl)下无明显变化(P>0.05)。但与未添加DS的肌球蛋白体系比较,添加DS后进一步热处理过程中肌球蛋白溶解度增加(P<0.05),表明DS能部分抑制肌球蛋白的热聚集。
2.3 硫酸葡聚糖对肌球蛋白电势的影响
为了进一步探讨DS对肌球蛋白热聚集的抑制机理,对3种离子强度下肌球蛋白分子的表面电势进行分析,结果见图3。在试验范围内(pH 7.0),肌球蛋白整体带负电,随着KCl浓度的升高,体系电势逐渐减小,可能是盐离子的增加对肌球蛋白分子表面扩散双电层产生了压缩作用[21],使肌球蛋白溶解度增加。经过热处理后,在1,50 mmol/L KCl条件下,随着热处理温度的进行(40~70 ℃),肌球蛋白体系电势逐渐减小,质点间相互排斥作用减小,分散体系被破坏,分子间吸引力大于排斥力,发生聚集[22]。具体表现为悬浮液浑浊、颗粒粒径增大,溶液中可溶性蛋白含量明显下降。在150 mmol/L KCl下,盐离子改变了带电颗粒周围的离子分布[23],随温度升高表面电势有升高的趋势。添加负电性多糖DS后,试验范围内肌球蛋白体系电势均明显增加(P<0.05),在1 mmol/L KCl条件下最为明显,与对照组相比体系电势增加了约25 mV,表明DS与肌球蛋白分子形成了稳定的分散体[24]。与未添加DS的肌球蛋白体系比较,在1,50 mmol/L KCl条件下,热处理初期肌球蛋白分子受热部分展开,肌球蛋白表面带正电荷的—NH3+通过静电相互作用与DS上带负电的—OSO3-结合形成复合物[25],这种吸引作用比—NH3+与—CO2-的吸引作用要强烈,使得同温度下肌球蛋白电势明显增大(P<0.05),分子间排斥力大于吸引力,蛋白溶解度增加;当温度升高到60~80 ℃时,肌球蛋白表面电势依然较高,溶解度无明显变化,说明DS-肌球蛋白形成的复合物热稳定性较好。而在生理离子强度下,在50~80 ℃ 温度区间内,DS对肌球蛋白电势无明显影响,可能与盐离子的干扰作用抑制了DS的作用效果有关。因此,低离子强度下DS抑制肌球蛋白热聚集的效果可能与分子间强的静电相互作用有关。
不同大写字母表示同一温度之间差异显著(P<0.05);不同小写字母表示同一样品之间差异显著(P<0.05)

不同大写字母表示同一温度之间差异显著(P<0.05);不同小写字母表示同一样品之间差异显著(P<0.05)
2.4 硫酸葡聚糖对肌球蛋白α-螺旋含量的影响
3种离子强度下肌球蛋白分子二级结构的变化见图4、5。KCl浓度为1 mmol/L时,溶解性差,α-螺旋含量仅有45%。随着KCl浓度增大,肌球蛋白表面电荷增加,氨基酸之间的静电相互作用增强,溶解度增大,二级结构趋于稳定,α-螺旋含量逐渐增大。KCl浓度为150 mmol/L时,α-螺旋含量达到61.65%。为了探讨热处理过程中肌球蛋白的构象变化,用CD光谱仪对其进行升温处理,当温度达到肌球蛋白的变性温度(50 ℃左右)时,肌球蛋白α-螺旋含量显著下降(P<0.05),从CD图谱中可以看出3个离子强度(1,50,150 mmol/L KCl)下肌球蛋白的特征峰已经完全消失,说明肌球蛋白已经变性。继续升高温度(60~80 ℃),蛋白分子热运动加剧,疏水基团逐渐暴露,蛋白质之间的非共价键引起无规则聚集[26],溶解度逐渐下降,α-螺旋含量继续降低。

图4 硫酸葡聚糖对肌球蛋白CD谱图的影响Figure 4 Effect of DS on the CD-spectra of myosin
据Ru等[25]报道,多肽链上羰基(—CO)和氨基(—NH)之间的氢键维持了蛋白质的α-螺旋结构。经DS处理后,与未添加组相比,在KCl浓度为1~50 mmol/L的蛋白体系中,α-螺旋含量明显增大(P<0.05),可能是DS的高电荷密度对氢键有所影响[27]。热处理后,即使在80 ℃,肌球蛋白的α-螺旋含量依然有20%。在CD图谱中观察到肌球蛋白208 nm处的肩峰完好,222 nm处的肩峰消失。在KCl浓度为150 mmol/L的蛋白体系中,α-螺旋含量随温度升高呈下降趋势;但是CD图谱显示在50 ℃时肌球蛋白的特征峰依然完整。虽然不同体系中DS对肌球蛋白构象的影响有所差异,但是足以说明在热处理过程中,DS可以保护肌球蛋白的部分二级结构。

不同大写字母表示同一温度之间差异显著(P<0.05);不同小写字母表示同一样品之间差异显著(P<0.05)
2.5 硫酸葡聚糖对肌球蛋白分子形态变化的影响
利用透射电子显微镜观察肌球蛋白分子形态的变化见图6。在低离子强度(1 mmol/L KCl)下,肌球蛋白呈细丝状,分子互相交联缠绕,50 ℃热处理后肌球蛋白丝状体断裂、减少,分子头部聚集变大、尾部相互缠绕形成明显的聚集体;添加DS后,肌球蛋白纤丝部分解聚,体系有分散的趋势,50 ℃热处理后纤丝聚集形成网络结构,部分丝状体聚集,与未添加DS的热处理组比较,肌球蛋白的头部和尾部未发生明显大的聚集体,结合溶解度、电势和分子二级结构的变化分析,DS诱导肌球蛋白蛋白分子静电相互作用的变化导致了热处理过程中网络结构的形成,由此抑制了蛋白质大分子间的热聚集。
在50 mmol/L KCl条件下,体系中盐离子的存在促进肌球蛋白溶解,肌球蛋白丝状体变粗、解聚。随着盐离子的继续增加(150 mmol/L KCl),肌球蛋白解离,以单体或二聚体形式均匀分散;经过50 ℃热处理后肌球蛋白丝状体消失,头部出现明显聚集,尾部变短变粗,形成明显的聚集体;添加DS后,蛋白质粗丝发生解离,整体上看,肌球蛋白体系逐步分散。进一步热处理后,仅生理离子强度下的肌球蛋白形成了带球状颗粒的棒状胶束,可能是溶液中与DS有强结合作用的反离子[18]较多,诱导了胶束的形成,体系有类似弱凝胶的状态。
3 结论
硫酸葡聚糖是水溶性阴离子多糖,在低离子强度下,DS的高电荷密度可以使肌球蛋白体系电势升高,肌球蛋白纤丝部分解聚,体系分散,热处理后蛋白质分子部分伸展,DS的—OSO3-基团与暴露在肌球蛋白表面—NH3+基团产生强烈的静电相互作用,形成了稳定的复合物,保护了肌球蛋白分子的二级结构,分子形成网络结构,部分丝状体聚集;生理离子强度下,由于DS与盐离子形成的反离子的胶束作用使肌球蛋白形成胶束,但是与未添加DS的肌球蛋白体系相比,溶解度依然较高。综上表明DS可有效抑制低离子强度下肌球蛋白分子的热聚集。基于DS与肌球蛋白的作用机理可为抑制肌球蛋白热变性聚集提供一条新的解决思路。但DS与肌球蛋白作用过程中是否会引起多糖及蛋白分子本身结构的变化尚不清楚,有待进一步研究。
