菊芋叶总黄酮提取工艺优化及含量动态变化
2012-12-23郑晓涛隆小华刘兆普
郑晓涛,隆小华,刘 玲 ,陈 良,刘兆普
南京农业大学资源与环境科学学院 江苏省海洋生物学重点实验室,南京210095
菊芋(Helianthus tuberosus L.),俗名洋姜,是菊科向日葵属多年生草本植物。原产北美洲,十七世纪传入欧洲,后传入中国。它分布广,适应性强,极易种植,产量颇高,成本低廉[1]。其块茎可用于发酵产乙醇[2],也可水解生产高果糖浆[3],其叶片提取物具有良好的杀菌活性,可用于开发植物源抑菌剂[4]。
黄酮类化合物具有多种的生物活性和药用价值[5,6],应用价值广泛,市场开发潜力很大。从上世纪六、七十年代开始,国内外就有科研人员开展了对向日葵属植物化学成分的研究,已从该属的H. microcephali、H.angustifolii、H. corona-solis、H. grosseserrats、H. annuus 等 中 分 离 出 丰 富 的 黄 酮 类 化 合物[7-12]。本研究以菊芋叶为原料,采用回流法对菊芋叶总黄酮提取工艺进行优化,并对不同采集时间的菊芋叶总黄酮含量进行测定,旨在确定菊芋叶总黄酮的最佳提取工艺条件和最佳采样时间,为菊芋资源的综合开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
菊芋叶:分别于2010 年5、7、9 和11 月的中旬采集于南京农业大学大丰试验基地,菊芋品种为南芋1 号。单因素及正交试验所有叶片材料为9 月份所采。60 ℃烘干,粉碎后过40 目筛备用;芦丁对照品(中国药品生物制品检定所);其余试剂均为国产分析纯;水为重蒸水。
1.2 仪器与设备
AUY 120 型分析天平(日本岛津科学仪器公司);101A-Z 型电热鼓风干燥箱(上海市实验仪器总厂);FZ102 微型粉碎机(天津泰斯特有限公司);UV-2450 紫外可见分光光度计(日本岛津科学仪器公司);HH-4 数显恒温水浴锅(国华电器有限公司)。
1.3 方法
1.3.1 提取工艺流程
菊芋叶→60 ℃烘干→粉碎→准确称取一定质量→甲醇热回流→过滤→定容至50 mL,即为提取液。
1.3.2 标准曲线的绘制
称取芦丁对照品12.35 mg,用70%甲醇(体积分数)溶解,转入50 mL 量瓶中,用70%甲醇定容,配成0.247 mg/mL 的芦丁对照品溶液。分别吸取对照品溶液0、2.0、4.0、6.0、8.0、10.0 mL 于50 mL容量瓶中,各加水至25 mL;加入5%NaNO2溶液2 mL,摇匀;加入10% Al(NO3)3溶液2 mL,摇匀,放置6 min;加入4% NaOH 溶液10 mL,用70%甲醇定容,摇匀[13]。以第一管为空白,于510 nm 下检测吸光值。以吸光值为纵坐标,浓度为横坐标,绘制标准曲线。用最小二乘法作线性回归,其回归方程为:A= 8.369C + 0.008(r2=0.9972)。
1.3.3 总黄酮含量的测定
吸取2 mL 提取液置于50 mL 容量瓶中,按上述芦丁标准曲线绘制方法配制溶液,并以试剂空白为参比液调零,510 nm 测取其吸光度。通过标准曲线计算提取液中的总黄酮含量,总黄酮含量为:
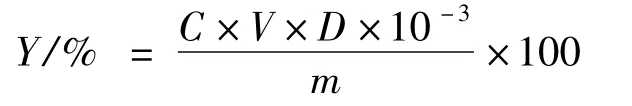
式中:Y 为总黄酮含量;C 为由标准曲线计算得出的待测试液的总黄酮质量浓度(mg/mL);V 为待测试液的体积(mL);D 为待测试液的稀释倍数;m为菊芋叶粉末质量(g)。
1.4 因素水平设定
1.4.1 单因素试验
1.4.1.1 甲醇体积分数对总黄酮含量的影响
称取1.00 g 菊芋叶,以不同的体积分数(10%、30%、50%、70%、90%)的甲醇溶液为溶剂,料液比为1∶30,提取温度为70 ℃,提取时间1 h。
1.4.1.2 提取时间对总黄酮含量的影响
称取1.00 g 菊芋叶,以体积分数为70%的甲醇溶液,料液比为1∶30,温度70 ℃,回流提取0.5、1、2、3、4 h。
1.4.1.3 固液比对总黄酮含量的影响
称取1.00 g 菊芋叶,用体积分数70%的甲醇溶液,温度70 ℃,按不同固液比(1 ∶5、1 ∶10、1 ∶20、1∶30、1∶40),回流提取1 h。
1.4.1.4 提取温度对总黄酮含量的影响
称取1.00 g 菊芋叶,分别用不同的温度(40、50、60、70、80 ℃),以体积分数70%的甲醇为提取剂,回流提取时间为1 h,固液比为1∶30,
1.4.2 正交试验设计
根据单因素试验结果,确定以甲醇体积分数(A)、提取时间(B)、固液比(C)、提取温度(D)四个因素及其对应的3 个较优水平,选用L9(34)正交设计表进行试验(表1),优化菊芋叶总黄酮的提取工艺,每个处理三次重复。
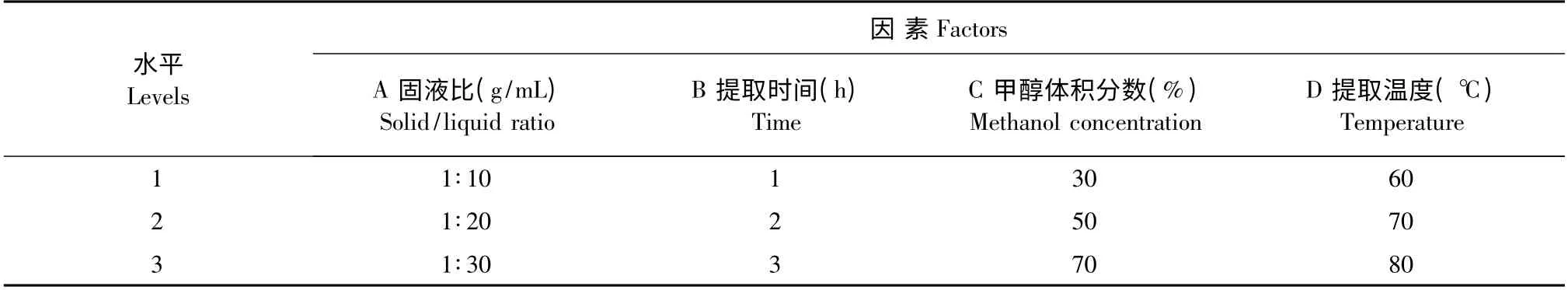
表1 L9(34)因素水平表Table 1 Factors and levels of the test L9(34)
2 结果与分析
2.1 单因素试验结果
2.1.1 甲醇体积分数对总黄酮含量的影响
随着甲醇体积分数的增大,提取的总黄酮含量逐渐增加,甲醇体积分数从10%增加到70%时,测得的总黄酮含量从4.36%提高到5.91%,在70%时达到最大,其后随着甲醇体积分数的增大,测得的总黄酮含量反而降低,造成这种现象可能是由于甲醇体积分数过高时,水溶性黄酮的溶出减少而脂溶性杂质如色素、鞣质等溶出增多,由于杂质与脂溶性黄酮竞争溶剂,从而使黄酮提取量下降[14]。因此甲醇体积分数选70%为宜。
2.1.2 提取时间对总黄酮含量的影响
随着提取时间的增加,提取的总黄酮含量逐渐增加,提取时间从0.5 h 增加至3 h 时,测得的总黄酮含量由5.16%增加至6.63%,而3 h 过后随着时间的延长,菊芋叶总黄酮的含量有所下降,这表明不同提取时间对总黄酮含量的影响很大,时间过短,目标成分不能充分溶出,时间太长,则可能造成部分对热不稳定的黄酮分解损失,使得总黄酮含量下降[15]。因此,提取时间选择3 h 为宜。
2.1.3 固液比对总黄酮含量的影响
随着固液比的增加,提取的总黄酮含量逐渐增加,当固液比从1∶5 增加到1∶20 时,测得的总黄酮含量由3.53%增加至5.89%。当固液比为1 ∶20时,提取就可以达到比较好的效果。再增加提取溶剂的量对总黄酮含量增加效果影响不大,考虑到生产成本,固液比以1∶20 为宜。
2.1.4 提取温度对总黄酮含量的影响
随着提取温度的升高,提取的总黄酮含量也逐渐升高,当温度由40 ℃升高到70 ℃时,测得的总黄酮含量由4.97%增加到6.71%,当温度升高到80℃时,测得总黄酮含量为6.72%。这是因为随着提取温度升高,分子的运动速度增加,渗透和扩散作用增强,使得菊芋叶片中的黄酮类化合物更容易溶出。同时考虑到能耗,选择70 ℃为宜。
2.2 正交试验结果
精确称量干燥的菊芋叶每份1.00g,按表1 的因素水平,用L9(34)正交试验方法优化菊芋叶总黄酮提取工艺结果见表2,并对试验结果进行方差分析(表3)。结果表明:四个因素都对总黄酮含量有极显著影响。其中甲醇体积分数(C)对总黄酮含量影响最大,提取温度(D)、固液比(A)次之,提取时间(B)影响最小。经极差分析和方差分析确定最佳工艺组合为A3B2C3D3,即用70%甲醇以1∶30 的固液比在80 ℃条件下提取2 h。
2.3 正交优化验证性试验
由极差及方差分析得到的最佳提取工艺条件并不在正交试验表安排的试验中,需做验证性实验。用上述确定的最佳提取工艺条件进行3 次平行实验,总黄酮含量为7.03%,RSD 0.3%,比3 号试验的提取率稍高,说明所选取的工艺确为最佳工艺。
2.4 不同采收期菊芋叶总黄酮含量变化
精确称量不同采收期菊芋叶干粉1.00 g,按正交试验确定的最佳工艺条件制备供试样品溶液,按1.3.3 方法测定,每份样品平行测定3 次。结果如图1 所示,5~9 月份菊芋叶总黄酮含量呈上升趋势,9 月份达到最高,11 月份含量下降。
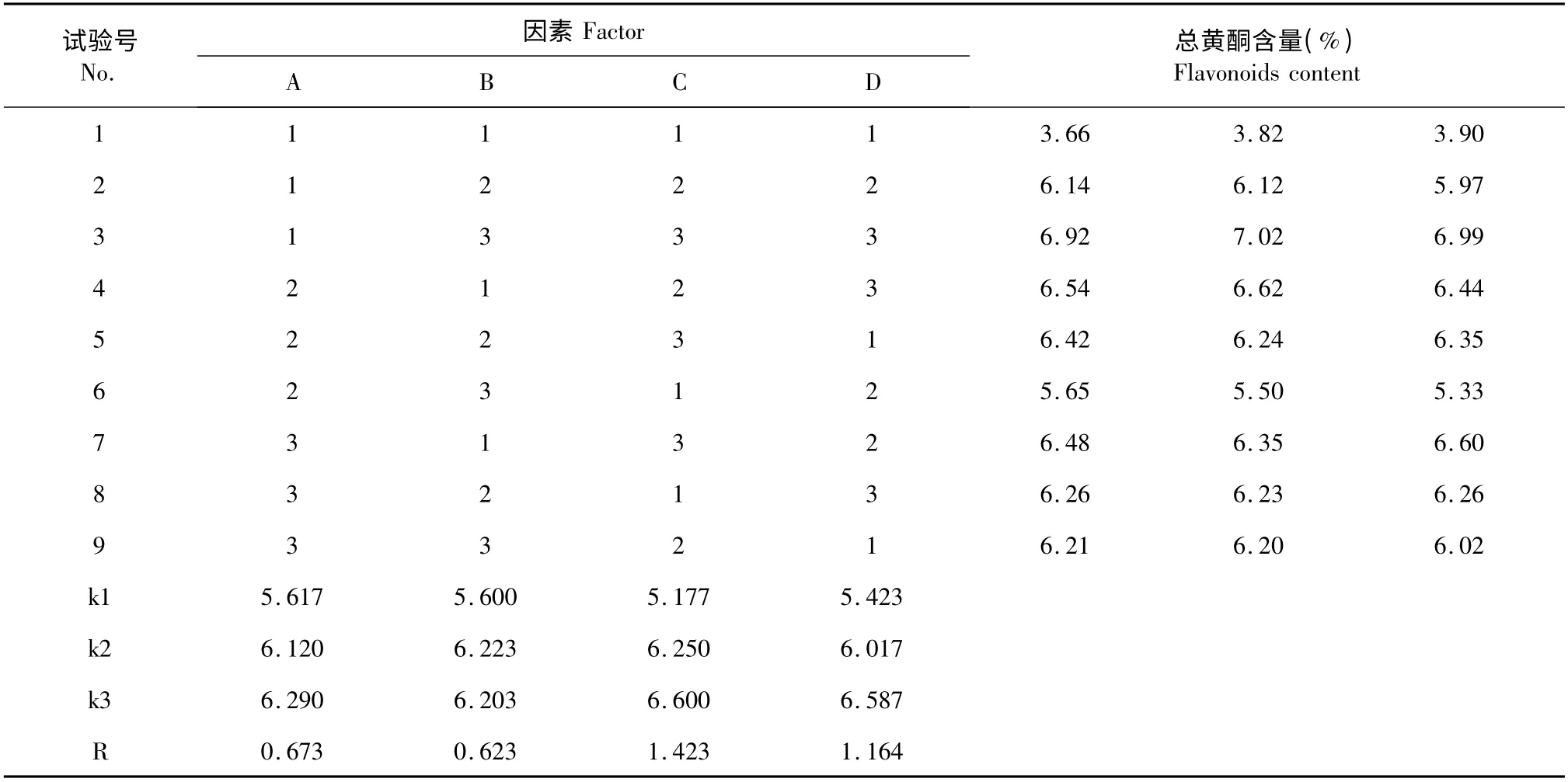
表2 L9(34)正交试验设计及结果Table 2 L9(34)orthogonal array design arrangement and results
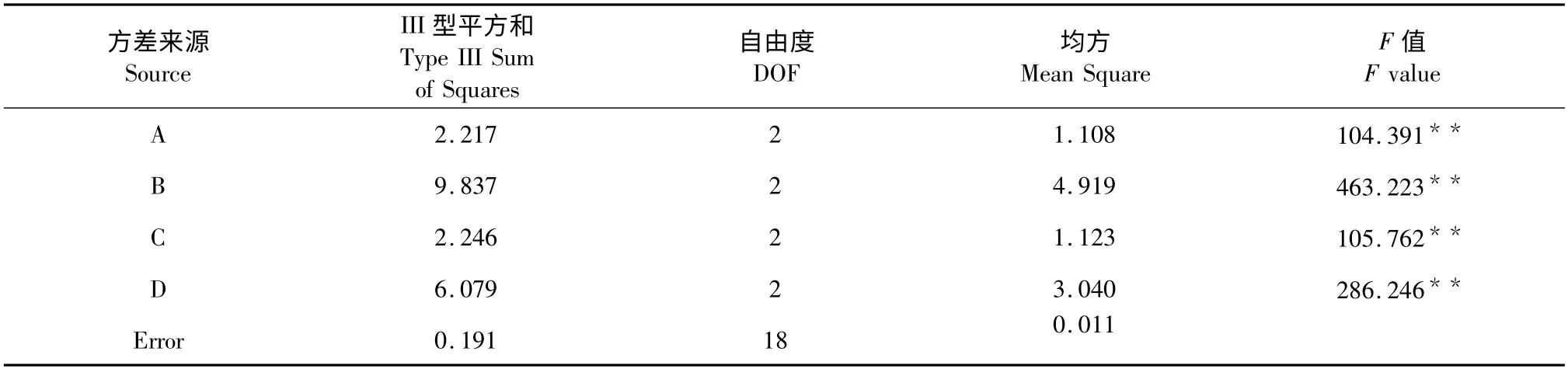
表3 方差分析Table 3 Analysis of variance for the total flavonoids content with different extraction conditions
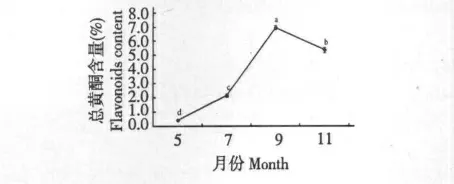
图1 不同采收时期对总黄酮的影响Fig.1 Total flavonoids content in different harvest time
3 结论
采用单因素及L9(34)正交试验设计对菊芋叶总黄酮的提取工艺进行了优化,确定菊芋叶总黄酮提取的最佳工艺条件为:选用甲醇体积分数70%、提取温度80 ℃,固液比1∶30,回流时间2 h 时,总黄酮含量最大。验证试验表明,在此条件下,回流提取菊芋叶总黄酮含量可达7.03%。研究为菊芋叶黄酮的开发利用提供了科学依据。
黄酮含量动态变化研究发现,不同季节采摘的菊芋叶其总黄酮含量呈动态积累的趋势,在9 月份最高,于11 月份下降。通过对菊芋叶总黄酮含量的动态监测,可确定其最佳的采收时间为9 月份。
1 Tian HT(田洪涛),Zhong K(种克),Ma W(马雯),et al.The optimization of reproducible Jerusalem artichoke juice medium for bifidobacteria.J Chin Ins Food Sci Technol (中国食品学报),2007,7(4):38-41.
2 Lv YG(吕跃钢),Ma JJ(马家津),Gu TC(顾天成). The study on ethanol fermentation by immobilized inulinase and yeast cell using inulin as raw material.Food Ferm Ind (食品与发酵工业),2003,29(5):66-68.
3 Bai M(白妹),Sun Y(孙彦),He LZ(何利中). Ion exchange column prepared by hydrolysis of high fructose syrup from Jerusalem artichoke. Food Sci (食品科学),1999,2:31-33.
4 Liu HW(刘海伟),Liu ZP(刘兆普),Liu L(刘玲),et al.Studies on the antifungal activities and chemical components of extracts from Helianthus tuberosus leaves. Nat Prod Res Dev (天然产物研究与开发),2007,19:405-409.
5 Gao JM(高锦明). Phytochemistry (植物化学). Beijing:Science Press,2003:191-193.
6 Wu XY(吴小勇),You G(游耿),Yang GM(杨公明).Study on the extraction condition and antioxidant activity of total flavonoids in Mungbean skin.Food Ferm Ind(食品与发酵工业),2010,36:214-216.
7 Edward E.Schilling.Flavonoids of Helianthus series Angustifolii.Biochem Sys Ecol,1983,11:341-344.
8 Edward E Schilling,Jose L Panero,Timothy A.Storbeck.Flavonoids of Helianthus series Microcephali.Biochem Sys Ecol,1987,15:671-672.
9 Edward E Schilling,Tom J Mabry. Flavonoids of Helianthus series Corona-solis.Biochem Sys Ecol,1981,9:161-163
10 Werner Herz,Narendra Kumar. Sesquiterpene lactones from Helianthus grosseserrats.Phytochemistry,1981,20:99-104.
11 Ohno S,Tomita-Yokotani K,Kosemnura S. A species-selective allelopathic substance from germinating sunflower(Helianthus annuus L.)seeds. Phytochemistry,2001,56:577-581.
12 Macias F A,Molinillo J,Torres A,et al.Bioactive flavonoids from Helianthus annuus cultivars. Phytochemistry,1987,45:683-687.
13 Du FY(杜芳艳),Fu KQ(付凯卿). Study on total flavonoids contents in peanut vines of different plant organs.Food Sci (食品科学),2008,29:137-140.
14 Chen ND(陈乃东),Zhou SB(周守标),Wang CJ(王春景),et al. Study on flavonoids extraction and function of scavenging hydroxy free radical from Lespeda. dunnii. Food Sci (食品科学),2007,28:86-91.
15 Li RL(李瑞丽),Qiao WZ(乔五忠),Wang YH(王艳辉),et al.The extraction of grape seed proanthocyanidin using ulrasonic wave. Food Res Dev(食品研究与开发),2006,27(2):64-66.
