黄山贡菊花、叶中总黄酮及绿原酸动态积累研究
2012-12-23高学玲邹敏亮杨素云
高学玲 ,申 慧,邹敏亮,杨素云
1安徽农业大学茶与食品科技学院,合肥230036;2 湖南省祁阳县食品药品监督管理局,祁阳426100;3健士星生物生物技术研发(上海)有限公司,上海200335
黄山贡菊原名“徽菊”,与杭菊、滁菊、亳菊共同收载于2010 年版中国药典。黄山贡菊为菊科植物菊(Chrysanthemum morifolium Ramat.)的干燥头状花序,具有疏风清热、平肝明目、清热解毒之功效[1]。现代研究表明,贡菊花中含有酚酸类、黄酮类、挥发油等多种有效成分[2-6],具有抗氧化、抗癌、抗病毒等作用[7-9]。目前,关于黄山贡菊花中黄酮类和绿原酸类成分的研究已有文献报道,但对黄酮类和绿原酸类成分在不同花期及采摘期动态积累规律以及在长期间黄山贡菊叶中动态积累规律的相关研究尚未见文献报道。
本文在前期对黄山贡菊花高效液相色谱指纹图谱研究的基础上[10],进一步研究不同花期和采摘期黄山贡菊花中总黄酮和绿原酸动态变化规律及在不同生长期内贡菊叶中总黄酮和绿原酸动态变化,以期为黄山贡菊花的合理采集及贡菊叶有效成分的进一步利用提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
黄山贡菊花、叶均采自黄山天健农业科技有限公司贡菊种植园,采后于60 ℃烘干,粉碎过20 目筛,封口包装。置闭光、阴凉处存放,待用。
芦丁、绿原酸(对照品,均购于中国药品生物制品鉴定所,纯度≥98%);磷酸(色谱纯,美国Tedia公司);乙腈(色谱纯,德国Merck 公司);硝酸铝、亚硝酸钠、氢氧化钠、甲醇、无水乙醇均为分析纯;超纯水自制。
1.1.2 仪器
TU-1901 型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);1200LC 型高效液相色谱仪(美国安捷伦有限公司);KQ-500E 型超声波清洗器(昆山市超声仪器有限公司);DFY-500 摇摆式高速中药粉碎机(浙江温岭市林大机械有限公司);DHG-9123A 电热恒温鼓风干燥箱(上海恒科技有限公司)。
1.2 方法
1.2.1 黄山贡菊花和叶中总黄酮和绿原酸变化研究
1.2.1.1 不同花期贡菊花中总黄酮和绿原酸变化研究
选择3 个不同花期进行采摘,即花蕾(俗称胎菊,管状花开放程度小于10%的菊花)、中花期(管状花开放程度约为50%的菊花)和大花期(管状花开放程度大于70%的菊花),研究不同花期贡菊花中总黄酮和绿原酸的动态积累规律。
1.2.1.2 不同采摘期贡菊花中总黄酮和绿原酸变化研究
分别于2011 年10 月18 日、10 月21 日、10 月25 日、10 月27 日、10 月31 日、11 月3 日、11 月6 日和11 月11 日共8 次在同一菊花种植园采摘菊花样品,以管状花开放程度约为50%的贡菊花为采摘标准,研究不同时期花中总黄酮和绿原酸的动态积累规律。
1.2.1.3 贡菊叶中总黄酮和绿原酸变化研究
分别于2011 年6 月26 日、7 月27 日、8 月25日、9 月25 日、10 月11 日、10 月25 日、11 月2 日和11 月11 日共8 次在同一菊花种植园采摘黄山贡菊叶,研究叶中总黄酮和绿原酸的动态积累规律。
1.2.2 总黄酮含量的测定
1.2.2.1 样品溶液的制备
精密称取贡菊花样品1.0 g,按1∶21 加72%乙醇,62 ℃超声提取38 min,滤纸减压抽滤,再用47%乙醇定容至50 mL,备用。
精密称取贡菊叶样品1.0 g,按1∶24 加47%乙醇,63 ℃超声提取27 min,滤纸减压抽滤,再用47%乙醇定容至50 mL,备用。
1.2.2.2 对照品的制备及标准曲线绘制
精密称取卢丁对照品10.2 mg,置50 mL 容量瓶中,加甲醇使其溶解,定容至刻度,摇匀,即得浓度为0.204 mg/mL 的对照品溶液。
精密吸取对照品溶液1.0、2.0、3.0、4.0、5.0、6.0 mL,分别置于25 mL 容量瓶中,各加水至6 mL,摇匀,加5% 亚硝酸钠溶液1 mL,使混匀,放置6 min,加10%硝酸铝溶液1 mL。摇匀,放置6 min,加4%氢氧化钠溶液10 mL,再加水至刻度,摇匀,放置15 min,分光光度法在510 nm 波长处测定吸光度A值。以吸光度A 值为纵坐标,浓度为横坐标,按浓度与吸光值相关关系求得回归方程为Y = 0.01169×X -0.00794,r2= 0.9997。表明芦丁在0.008~0.048 mg/mL 呈良好的线性关系。
1.2.2.3 样品的测定
精密吸取供试品溶液0.5 mL,置于25 mL 容量瓶中,加水至6 mL,摇匀,再按照1.2.2.2 项下方法进行测定
1.2.3 绿原酸含量的测定
1.2.3.1 样品溶液的制备
精密称取样品粉末1.0 g,按1∶20 加75%乙醇,60 ℃超声提取30 min,滤纸减压抽滤,再用75%乙醇定容至50 mL,过0.45 μm 滤膜备用。
1.2.3.2 对照品溶液的制备
取绿原酸5.0 mg 加水溶解,定容至10 mL,即得母液0.5 mg/mL。再依次配制10、20、40、60、80 mg/L 的对照品溶液。
1.2.3.3 色谱条件
色谱柱:Phenomenex Luna 苯基己基色谱分析柱(250 mm×4.6 mm,5 μm);柱温:30 ℃;流动相:A:0.1%磷酸水溶液,B:乙腈;流速:1 mL/min;检测波长:255 nm;进样量:5 μL 梯度洗脱条件见表1。

表1 流动相梯度洗脱条件Table 1 Conditions of gradient elution

40.00 80 20 50.00 60 40 60.00 50 50 60.01 92 8 70.00 92 8
1.2.3.4 样品的测定
按“1.2.3.1”项下条件制备贡菊花、叶供试品溶液,1.2.3.3 项下色谱条件进行测定。
2 结果与分析
2.1 不同花期贡菊花中总黄酮和绿原酸含量的变化
不同花期黄山贡菊花中总黄酮、绿原酸含量变化如图1 所示。由图1 中可知,不同花期贡菊花总黄酮和绿原酸含量差异明显,其中贡菊花总黄酮和绿原酸含量最高值出现在中花期,分别达到123.12和5.86 mg/g ;大花期次之,花蕾最低。
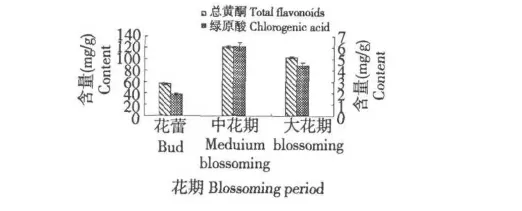
图1 不同花期贡菊花中总黄酮和绿原酸的含量Fig.1 The content of total flavonoids and chlorogenic acid in different blooming period of Flos chrysanthemum
2.2 不同采摘期贡菊花总黄酮和绿原酸含量的变化
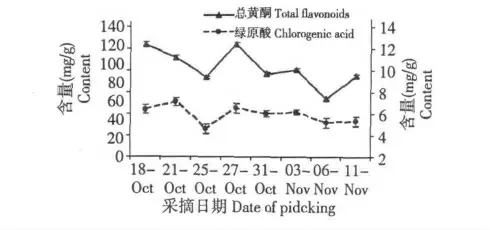
图2 不同采摘时期贡菊花总黄酮和绿原酸含量的变化Fig.2 Changes of total flavonoids and chlorogenic acid contents of Flos chrysanthemum in different picking period
不同采摘期贡菊花总黄酮和绿原酸含量的变化如图2 所示。由图2 可知,不同采摘期贡菊花中总黄酮含量存在较大差异,其中,在采摘中期(10 月27日)的贡菊花中总黄酮含量最高,为125.41 mg/g;采摘后期(11 月6 日)的贡菊花总黄酮含量最低,为73.37 mg/g 。贡菊花中绿原酸含量在采摘期的变化范围为4.92~6.88 mg/g ,在采摘初期(10 月21日)最高,此时绿原酸含量为6.88 mg/g ,其次为采摘中期(10 月27 日)。
2.3 贡菊叶中总黄酮和绿原酸含量的变化
贡菊叶中总黄酮和绿原酸含量的变化如图3 所示。由图3 可知,随着生长期的不断延长,贡菊叶中总黄酮、绿原酸含量均呈逐渐上升趋势,在生长期后期(11 月2 日)总黄酮和绿原酸含量均达到峰值,分别为109.30 和7.87 mg/g ,随后总黄酮和绿原酸含量均呈下降趋势。
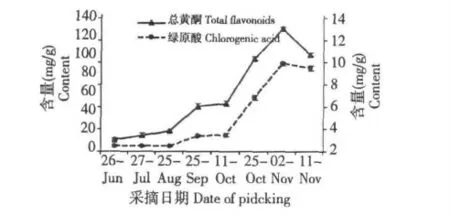
图3 贡菊叶中总黄酮和绿原酸含量的变化Fig.3 Changes of total flavonoids and chlorogenic acid contents in leaves of Chrysanthemum morifolium Ramat.
3 结论与讨论
3.1 传统的菊花一般在完全开放后采收,但近年来,市场上有“胎菊”销售,“胎菊”为幼小菊花花序的加工品,价格为普通菊花的数倍。本文研究发现贡菊花的花蕾中总黄酮和绿原酸含量均较低,而在中花期总黄酮、绿原酸含量均达到最高值,分别为123.12 和5.86 mg/g,其原因可能是由于菊花开放程度的不同其次生代谢物的产生、积累变化很大[11];在不同采摘期中,贡菊花总黄酮、绿原酸含量变化波动较大,采摘前期贡菊花中总黄酮和绿原酸的含量均高于采摘后期。
3.2 在黄山贡菊生长过程中,随着生长期的延长,贡菊叶中总黄酮和绿原酸含量呈逐渐上升趋势,并在后期达到较高的水平,其总黄酮和绿原酸含量最高分别达到109.30 和7.87 mg/g。在此时期采收贡菊叶可作进一步的开发利用。
1 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People's Republic of China (中华人民共和国药典). Beijing:China Medical Scienc Press,2010.VolⅠ,292.
2 Long ZL,James M,Harnly. Identification of the phenolic components of chrysanthemum flower (Chrysanthemum morifolium Ramat).Food Chem,2010,120:319-326.
3 Zhang J(张健),Qian DW(钱大玮),Li YB(李友宾),et al. Chemical Constituents from Chrysanthemum morifolium Ramat.Nat Prod Res Dev(天然产物研究与开发),2006,18:71-73.
4 Liu JQ(刘金旗),et al.Studies on the Chemical Constituents from Chrysanthemum morifolium Ramat. Chin J Chin Mater Med (中国中药杂志),2001,26:547.
5 Shan Z,et al. Simultaneous determination of flavonoids in chrysanthemum by capillary zone electrophoresis with running buffer modifiers.Talanta,2008,76:780-784.
6 Wang YJ(王亚君),et al.Characterization of chemical components of essential oil from flowers of Chrysanthemum morifolium produced in Anhui province. Chin J Chin Mater Med(中国中药杂志),2001,33:2207-2211.
7 Dongxu He,et al.Total flavonoids of Flos Chrysanthemi protect arterial endothelial cells against oxidative stress. J Ethnopharmacology,2012,139:68-73.
8 Xiaoyan Pan,et al.Inhibition effects of human gastric carcinoma SGC-7901 cells on Chrysanthemum flavonoids in vivo.Procedia Engineering,2011,18:139-144.
9 S.Kumar,et al.Elimination of mixed infection of Cucumber mosaic and Tomato aspermy virus from Chrysanthemum morifolium Ramat. cv. Pooja by shoot meristem culture. Scientia Horticulturae,2009,119:108-112.
10 Zha FF(査芳芳),et al.HPLC Fingerprinting of Huangshan Gongju Chrysanthemum (Chrysanthemum morifolium Ramat.).Food Sci (食品科学),2011,20:146-150.
11 Xu WB(徐文斌),Guo QS (郭巧生),Li YN (李彦农),et al.Comparative study on internal quality of various Chrysanthemum morifolium.Chin J Chin Mater Med (中国中药杂志),2005,30:1645-1648.
