从蚯蚓中联合提取抗氧化酶SOD、CAT 的方法研究
2012-12-23荣永海
廖 怡,荣永海,荣 龙
北京航空航天大学生物与医学工程学院,北京100191
蚯蚓又称地龙,属寡毛纲环节动物门,在我国传统中药学中具有解热、镇痉、活络、平喘等众多药理作用,蚯蚓入药在我国已流传千年。近年来研究发现,蚯蚓体内含有丰富的活性成分,对蚯蚓的研究成为生物化学及药物生物技术领域的热点。目前,对于蚯蚓活性成分的研究主要集中在蚯蚓纤溶酶、抗肿瘤蛋白[1]、抗菌肽[2]等的提取纯化与分析。其中,纤溶酶(俗称蚓激酶)由于其特异的溶血栓功效,成为新一代溶栓药物并成功应用到西药中。相关研究表明,蚯蚓体内也含有丰富抗氧化酶类。抗氧化酶是一类具有重要生理功能的酶,它们能及时清除体内剩余的氧自由基,在治疗疾病、延缓衰老等方面具有重要作用。如果从蚯蚓体内有效提取出此类功能酶,并应用到工业生产中,这将拓宽蚯蚓的应用范围,对蚯蚓的综合开发利用具有重要意义。
目前,研究者们已从酵母、芽孢杆菌、重组大肠杆菌、黑曲霉等中分离纯化出CAT,从细菌、真菌、原生动物、藻类、昆虫、鱼类、植物和哺乳动物等生物体内纯化得到SOD。但是这些研究都仅限于SOD或CAT 单个酶的分离纯化,并未见两酶联合提取的报道。本研究使用闪式提取技术及羧甲基纤维素(CM-22)离子交换层析从蚯蚓中联合提取SOD 和CAT,并通过柱层析等手段对蚯蚓SOD、CAT 进行纯化。联合提取方法的建立不仅节约了资源、提高了原料利用率,也拓宽了蚯蚓的应用范围、为蚯蚓多种活性成分的综合开发利用创造了条件,为产业化奠定了基础。
1 材料与方法
1.1 主要材料与试剂
实验用赤子爱胜蚯蚓(Eisenia fetida)由天津蚓福生物科技开发有限公司提供;羧甲基纤维素CM-22(Carboxymethyl Cellulose,CM)购自英国Whatman公司;二乙胺基乙基纤维素(DEAE-Cellulose)购自上海试剂二厂;葡聚糖凝胶G-200(Sephadex G-200)、葡聚糖凝胶G-75(Sephadex G-75)购自美国Pharmacia 公司;SOD 活性检测用邻苯三酚购自国药集团化学试剂有限公司;CAT 活性检测用钼酸铵购自天津市光复科技发展有限公司;蛋白检测用考马斯亮蓝G-250 购自美国Amresco 公司:电泳试剂盒购自北京赛驰生物科技有限公司;SOD 标准品购自美国Sigma-Aldrich 公司;CAT 标准品购自德国Serva公司;其余试剂均从北京鼎国生物技术有限责任公司购买;全部试剂均为分析纯或色谱纯等级;所有溶液均以双蒸水配制而成。
1.2 主要仪器与设备
SP-756P 型分光光度计,上海光谱仪器有限公司;ArantiTMJ-25 型低温高速离心机,美国Beckman Coulter 公司;FC-95A 自动馏分收集器,北京新技术应用研究所;蛋白分离纯化层析柱,上海锦华层析设备厂;JHBE-50S 型闪式提取器,北京金鼐科技发展有限公司;868 型酸度计,美国Orion 公司;双蒸水过滤器,美国PALL 公司。
1.3 方法
1.3.1 蚯蚓的预处理
取270 g 新鲜冷冻蚯蚓(已洗净)平均分为3份,剪碎,每份以1 ∶4(m/V)的比例加入已预冷的2.5 mmol/L pH 7.0 磷酸缓冲液中。分别用闪式提取(转速5500 rpm,提取4 次,每次30 s,每次间歇5 min)、超声波提取(组织捣碎后超声波提取2 次,功率800 W,每次30 min)和组织均浆(2 次,每次1.5 min)进行提取。提取完成后,检测SOD 和CAT 的活性,置于-20 ℃冰箱冷冻12 h,取出融化,11000 ×g 4 ℃离心1 h,收集上清液即为SOD、CAT 粗提液。
1.3.2 SOD、CAT 粗品的分离
CM-22 离子交换柱填料按说明处理,装柱后用0.05 mol/L pH 5.0 醋酸缓冲液平衡。粗提液用pH酸度计调pH 5.0,11000 ×g 4 ℃离心30 min,收集上清液,上清液上CM-22 柱(2.5 cm × 45 cm),流速2 mL/min,收集未吸附上CM-22 柱的酶液即为SOD 粗提液,测定SOD 活性;CM-22 柱吸附酶液用0.05 mol/L pH 6.0 磷酸缓冲液洗脱,流速1 mL/min,收集洗脱液即为CAT 粗提液,测定CAT 活性,用2.5 mmol/L pH 7.6 磷酸缓冲液4 ℃透析12 h。
1.3.3 CAT 的纯化
1.3.3.1 Sephadex G-200
透析后的CAT 粗提液用PEG-4000 浓缩,浓缩液上Sephadex G-200 柱(2.6 cm × 70 cm,填料按说明充分溶胀),2.5 mmol/L pH 7.6 磷酸缓冲液进行平衡和洗脱,流速2.5 mL/h,每管收集5 mL。测定每管CAT 活性和蛋白质含量,收集活性较高的各管酶液,进行下一步纯化。
1.3.3.2 DEAE-Cellulose
DEAE-Cellulose 离子交换柱填料按说明处理,装柱后用2.5 mmol/L pH 7.6 磷酸缓冲液平衡。G-200 收集的CAT 粗提液上DEAE-Cellulose 柱(1.6 cm × 30 cm),0.05 mol/L NaCl 溶液进行洗脱[3],流速1 mL/min,收集洗脱液即为CAT 酶液。
1.3.4 SOD 的纯化
1.3.4.1 丙酮沉淀
将SOD 粗提液按1∶1(V/V)进行丙酮沉淀[4],置于-20 ℃15 min 后离心,11000 × g 4 ℃离心30 min,弃去上清,沉淀用2.5 mmol/L pH 7.6 磷酸缓冲液溶解,测定SOD 活性,2.5 mmol/L pH 7.6 磷酸缓冲液4 ℃透析12 h。
1.3.4.2 DEAE-Cellulose
DEAE-Cellulose 装柱后用2.5 mmol/L pH 7.6磷酸缓冲液平衡。透析后的SOD 酶液上DEAE-Cellulose 柱(1.6 cm × 30 cm),5 mmol/L~200 mmol/L pH 7.6 磷酸缓冲液进行梯度洗脱[4],流速20 mL/h,每管收集5 mL。测定每管SOD 活性和蛋白质含量,收集活性较高的各管酶液,2.5 mmol/L pH 7.6磷酸缓冲液4 ℃透析12 h。
1.3.4.3 Sephadex G-75
透析后的SOD 酶液用PEG-4000 浓缩后上Sephadex G-75 柱(1.6 cm × 80 cm,填料按说明充分溶胀),流速20 mL/h,每管收集5 mL。测定每管SOD 活性和蛋白质含量,收集活性较高的各管酶液,得到蚯蚓SOD 纯品。
1.3.5 蚯蚓SOD、CAT 提取和纯化总工艺
1.3.6 SOD 活性测定
采用邻苯三酚自氧化法测定SOD 活性,参考文献[5],略有改进。以每分钟抑制邻苯三酚自氧化速率50%所需的酶量为1 个酶活单位。
1.3.7 CAT 活性测定
[6]略有改动,以过氧化氢为底物,采用钼酸铵终止法进行测定。以每分钟催化分解1 μmol 过氧化氢所需的酶量为1 个酶活力单位。
1.3.8 蛋白质浓度的测定
蛋白质含量采用考马斯亮蓝法测定[7],以标准牛血清蛋白做标准品绘制蛋白标准曲线。
1.3.9 SOD 纯度鉴定及亚基分子量的测定
采用SDS-聚丙烯酰胺凝胶电泳进行SOD 的纯度鉴定并测定其亚基分子量,分离胶质量分数为12%,浓缩胶质量分数为5%。
1.3.10 CAT 活性染色、纯度鉴定及分子量的测定
参考董泗建等[8]的方法,略有改进,对CAT 进行活性染色。采用native-PAGE 进行CAT 的纯度鉴定,通过SDS-聚丙烯酰胺凝胶电泳测定其亚基分子量,分离胶和浓缩胶质量分数分别为8%、5%。
1.3.11 热稳定性
在含0. 05 mol/L pH 7. 0 磷酸缓冲液中,将SOD、CAT 酶液分别至于25、35、45、55、65、75 ℃水中,水浴30 min,测定酶活性。
1.3.12 pH 值稳定性
将SOD、CAT 酶液分别置于0.05 mol/L 磷酸氢二钠-柠檬酸缓冲液(pH 3-8)、0.05 mol/L 甘氨酸-氢氧化钠缓冲液(pH 9-10)、0.05 mol/L 磷酸氢二钠-氢氧化钠缓冲液(pH 11-12)中,经40 min 后分别测定其酶活性。
1.3.13 最适pH 值
将CAT 酶液置于用0.05 mol/L 磷酸氢二钠-柠檬酸缓冲液(pH 3-8)、0.05 mol/L 甘氨酸-氢氧化钠缓冲液(pH 9-10)、0.05 mol/L 磷酸氢二钠-氢氧化钠缓冲液(pH 11)配置成的0.05 mol/LH2O2中反应,计算反应后酶活性。
2 实验结果
2.1 蚯蚓SOD、CAT 粗品提取及分离
在此前的研究中,我们采用闪式提取法对罗汉果多酚[9]、罗汉果甜甙[10]、柑橘柠檬苦素[11]等生物活性成分进行提取,提取效率均高于传统提取方法。本研究将闪式提取法与超声波提取法、组织匀浆提取法等传统方法进行比较,结果如表1 所示,闪式提取法具有最高的蚯蚓CAT 收率,超声波提取蚯蚓SOD 的收率略高于闪式提取。但是由于完成一次超声波提取的时间为1 h,这远远长于闪式提取法所需的2 min,从活性收率和节能高效方面综合考虑,本研究采用闪式提取法对蚯蚓SOD、CAT 进行提取。

表1 不同提取方法酶收率的比较Table 1 Comparison of extraction methods
闪式提取之后的SOD、CAT 粗提液冷冻过夜,融化,测定粗提取液中SOD、CAT 的活性及比活(表2、表3)。粗提液上CM-22 柱,对SOD、CAT 进行分离,CM-22 柱未吸附溶液为SOD 粗提液,酶活性回收率为88.23%(表3),CM-22 柱吸附后洗脱溶液为CAT 粗提液,酶活性回收率为69.5%(表2),CM-22离子交换层析柱对SOD、CAT 具有良好的分离效果。
2.2 蚯蚓CAT 的纯化
CAT 粗提液经Sephadex G-200 凝胶过滤层析后,结果如图2 所示,收集活性高峰,得到比活6903 U/mg 的蚯蚓CAT。收集后的溶液上平衡好的DEAE-Cellulose 柱,得到比活22606 U/mg 的蚯蚓CAT。纯化后的蚯蚓CAT 活性高于市售黑曲霉CAT(≥4000 U/mg protein,Sigma-Aldrich Co.,USA),牛肝CAT(2000~5000 U/mg protein,Sigma-Aldrich Co.,USA),但是与人红细胞CAT(≥30000 U/mg protein,≥90%电泳纯,Sigma-Aldrich Co.,USA)相比还有一定差距。

图2 蚯蚓CAT 的G-200 洗脱曲线Fig.2 Separation of earthworm CAT on Sephadex G-200 column

表2 蚯蚓CAT 纯化结果Table 2 Purification of earthworm CAT
2.3 蚯蚓CAT 的活性染色、纯度鉴定及分子量的测定
纯化后的CAT 用native-PAGE 鉴定纯度,最终显示2 条主带。用铁染色法对非变性电泳条带进行活性染色,染色结果表明,分子量较大的主带具有CAT 活性,并且与牛肝CAT 其中一条CAT 酶带对应(图3),分子量较小的主带不具有CAT 活性,分析其原因可能是:1.在纯化过程中此分子量的CAT失活;2.此条带蛋白为杂蛋白。此蛋白的特征还有待进一步探究。此外,根据文献报道,过氧化氢酶在生物体内形态多样,如苹果含1 种CAT[3],而嗜温性沙雷氏菌则含3 种不同分子量CAT[12],因此本研究提取出的蚯蚓CAT 可能只是蚯蚓体内其中的一种CAT 活性组分。
通过SDS-PAGE 测得此CAT 亚基分子量约为72 kD,而CAT 由4 个相同亚基组成,据此推测本研究提取出的蚯蚓CAT 分子量约为288 kD,这与Switala[13]等的研究相符(CAT 分子量一般为220~340 kD)。

图3 蚯蚓CAT 的活性染色,非变性电泳和SDS 变性凝胶电泳结果Fig.3 Active staining of purified earthworm CAT,Native-PAGE and SDS-PAGE analysis
2.4 蚯蚓SOD 的纯化
经离子交换层析柱CM-22 分离后的SOD 粗提液按1∶1(V/V)进行丙酮沉淀,如表2 所示,沉淀溶解后测得其比活为645.5 U/mg(表2),将溶液透析12 h。透析后的溶液上DEAE-Cellulose 离子交换层析柱,结果如图4 所示,收集活性峰,得到比活3532 U/mg 的SOD 酶液(表3)。经DEAE-Cellulose 纯化后的SOD 酶液用2.5 mmol/L pH 7.6 磷酸缓冲液在4 ℃条件下透析12 h,浓缩后上Sepahdex G-75 凝胶过滤层析柱,结果如图5 所示,收集活性峰,最终得到比活9352 U/mg 的SOD 纯品,活性回收率为18.44%(表3)。纯化的蚯蚓SOD 比活高于市售牛红细胞SOD 标准品(2500~7000 U/mg,Sigma-Aldrich Co.,USA),并且高于大部分文献报道[4,14-18]。

图4 蚯蚓SOD 的DEAE-Cellulose 洗脱曲线Fig.4 Separation of earthworm SOD on DEAE-Cellulose column

图5 蚯蚓SOD 的G-75 洗脱曲线Fig.5 Separation of earthworm SOD on Sephadex G-75 column

表3 蚯蚓SOD 的纯化结果Table 3 Purification of earthworm SOD
2.5 蚯蚓SOD 纯度鉴定及亚基分子量的测定
纯化后的蚯蚓SOD 经SDS-聚丙烯酰胺凝胶电泳分析后为单一条带,测得其亚基分子量约为17 kD,与SOD 标准品(Bovine erythrocytes,亚基分子量16.3 kD,全酶分子量32.5 kD)相似(图6)。

图6 蚯蚓SOD 的SDS 变性凝集电泳Fig.6 SDS-PAGE analysis of purified earthworm SOD
2.6 蚯蚓SOD 的稳定性
2.6.1 SOD 的热稳定性
结果如图7 所示,蚯蚓SOD 酶活性在45 ℃时最高,在35 ℃~55 ℃之间具有较好的热稳定性,与文献报道相似(表4),75 ℃时酶活力几乎完全丧失。
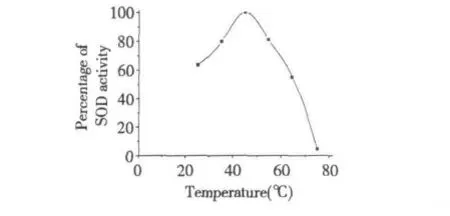
图7 蚯蚓SOD 的热稳定性Fig.7 Thermal stability of earthworm SOD
2.6.2 SOD 的pH 值稳定性
结果如图8 所示,蚯蚓SOD 的pH 值耐受范围较广,在pH 4~11 之间具有良好的稳定性,与南瓜、大蒜相似,优于紫草籽、黑豆来源的SOD 相似(表4)。当pH 值为3 时,SOD 几乎完全失活。因此,我们在蚯蚓SOD 的提取及检测过程中,pH 值始终保持在4~11 之间,以防止酶活性的丢失。

图8 蚯蚓SOD 的pH 值稳定性Fig.8 pH stability of earthworm SOD

表4 蚯蚓SOD 与其他来源SOD 的稳定性比较Table 4 Comparison of SOD ability
2.7 蚯蚓CAT 的稳定性
2.7.1 CAT 的热稳定性
结果如图9 所示,不同于蚯蚓SOD 的是,CAT酶活性在35 ℃时最高,与贻贝、鸭肝来源的CAT 相似(表5),在25 ℃~45 ℃之间具有较好的热稳定性,65 ℃时酶活力几乎完全丧失。结果表明,蚯蚓SOD 比CAT 具有更好的热稳定性。
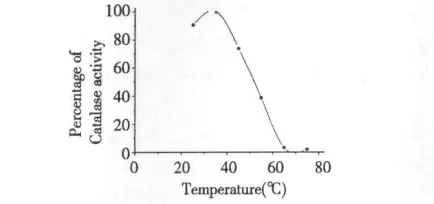
图9 蚯蚓CAT 的热稳定性Fig.9 Thermal stability of earthworm CAT
2.7.2 CAT 的pH 稳定性
结果如图10 所示,蚯蚓CAT 的pH 值耐受范围较广,在pH 4~10 之间具有良好的稳定性,优于韭菜和粘质沙雷氏菌(表5)。我们在蚯蚓CAT 的提取及检测过程中,pH 值保持在4~10 之间,以防止酶活性的大量丢失。蚯蚓SOD 和CAT 较广的pH值耐受范围,预示了其在实际应用中较强的pH 值适应性,具有很高的应用价值。


表5 蚯蚓CAT 与其他来源CAT 稳定性的比较Table 5 Comparison of CAT ability
2.7.3 CAT 的最适pH 值
蚯蚓CAT 的最适反应pH 值为6,与芦荟、苹果来源的CAT 具有一定差异(表5),当pH 值小于4或大于11 时,相对酶活性下降至50%以下。所以,蚯蚓CAT 的最适pH 值为6~7 之间,我们在实验中检测CAT 酶活性时pH 值控制在6~7。
蚯蚓SOD、CAT 性质的测定为实验中有效保持酶的活性、采用最佳提取及检测条件提供了依据。此外,不同来源SOD、CAT 在性质上的差异也显示出蛋白酶由于生物体环境不同而具有的生物多样性。
3 结论
在本研究中,我们首次利用闪式提取技术使得CAT 的提取效率比传统超声波提取和组织匀浆提取分别提高14.4%、44.4%,SOD 的提取效率与组织匀浆法相比提高32.5%。闪式提取技术为蚯蚓的分离提取提供了一种高效的方法。同时也为蚯蚓体内其它活性成分(谷胱甘肽还原酶、谷胱甘肽过氧化物酶、过氧化物酶、葡萄糖氧化酶等)的充分开发利用创造了条件。
利用柱层析等方法对蚯蚓SOD、CAT 进行分离纯化,收率分别达到18.44%和14.98%,得到比活9352 U/mg 的SOD,CAT 比活也达到22606 U/mg,分离纯化效果良好。本研究成功实现了蚯蚓SOD、CAT 的联合提取,不仅拓宽了抗氧化酶的生物来源,还提高了蚯蚓利用率,扩大了其应用范围,使蚯蚓的综合利用具有更好的经济和社会效益。
参考文献
1 Xie JB(谢江碧),Guo ZQ(郭振泉),Weng N(翁宁),et al. Purification,identification and partial characterization of an apoptosis-related serine protease from earthworm. Prog Biochem Biophys(生物化学与生物物理进展),2003,30:453-459.
2 Yan QL,Zhen JS,Chong W,et al.Purification of a novel antibacterial short peptide in earthworm Eisenia foetide. Acta Bioch Bioph Sin,2004,36:297-302.
3 Deng XJ(邓向军),Yu XJ(余筱洁).Purification and properties of catalase from apple(Maluspumilacv.FuJi).Food Sci& Tech(食品科技),2006(11):66-68.
4 He N,Li BQ,Sun DH,et al.Isolation,purification and characterization of superoxide dismutase from garlic.Biochem Eng J,2008,38:33-38.
5 Stefen M,Gudrun M. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay of superoxide dismutase.Biochem J,1974,47:469-474.
6 Peng J(彭建),Wang DY(王丹英),Xu CM(徐春梅),et al. Ammonium molybdate method for detecting the activities of rice catalase. Chin Agri Sci Bulletin(中国农学通报),2009,25:61-64.
7 Marion M. Bradford. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem,1976,72:248-254.
8 Dong SJ(董泗建),Liu CL(刘昌玲). An iron staining method of determination of catalase activity. Prog Biochem Biophys(生物化学与生物物理进展),1996,23:86-88.
9 Liu C(刘灿),Rong YH(荣永海),Rong L(荣龙). Flash extraction of polyphenols from fruits of Siraitia grosvenorii.Food Sci(食品科学),2010,31(22):50-53.
10 Liu Z(刘兆),Rong YH(荣永海),Rong L(荣龙). Flash extraction of mogroside from fruits of Siraitia grosvenorii.Nat Prod Res Dev(天然产物研究与开发),2011,23:561-564.
11 Liu J,Liu C,Rong L,et al.Optimization of extraction conditions of active constituents from Siraitia grosvenorii.Adv Mater Res,2011,291-294:2523-2528.
12 Zeng HW,Cai YJ,Liao XR,et al. Optimization of catalase production and purification and characterization of a novel cold-adapted Cat-2 from mesophilic bacterium Serratia marcescens SYBC-01.Ann Microbiol,2010,60:701-708.
13 Switala J,Loewen PC.Diversity of properties among catalase.Arch Biochem Biophys,2002,401:145-154.
14 Namir H,et al.Purification and some properties of Cu,Zn superoxide dismutase from Radix lethospermi seed,kind of Chinese traditional medicine.J Chromatogr,2005,818:123-131.
15 Xiao RQ,Ming JZ,Jian Q,et al.Two-step purification of Cu,Zn-superoxide dismutase from pumpkin (Cucurbita moschata)pulp.Sep Purif Technol,2011,87:79-83.
16 Jian GL,Jing BW,Meng MY,et al. Purification and characterization of superoxide dismutase from garlic. Food Bioprod Process,2011,89:294-299.
17 Kiyoshi Q,Yuki M,Kenji H,et al.Purification,N-terminal amino acid sequence,and some properties of Cu,Zn-superoxide dismutase from Japanese flounder(Paralichthys olivaceus).Comp Biochem Phys B,2001,128:751-760.
18 Wang SY,Shao B,Liu ST,et al. Purification and characterization of Cu,Zn-superoxide dismutase from black soybean.Food Res Int,2012,47:374-379.
19 Lin SQ(林少琴),Lan RF(兰瑞芳),Yu P(余萍),et al.Purification and some characterization of mussel catalase.Food Sci(食品科学),2000,21(11):22-24.
20 Qiu H(邱慧),Guo XL(郭小路),Yi YB(易燚波),et al.Isolation and purification catalase from anas platyrhynchos liver and analysis of some its properties.J Southwest Univ,Natural Science Edition(西南大学学报),2008,30:163-168.
21 Deng Y(邓玉),Jing HM(敬海明),et al.Isolation,purification and partial characterization of catalase from chinese chives.Food Sci(食品科学),2011,32:217-221.
22 Hua WZ,Yu JC,Xiang RL,et al. Optimization of catalase production and purification and characterization of a novel cold-adapted Cat-2 from mesophilic bacterium Serratia marcescens SYBC-01.Ann Microbiol,2010,60:701-708.
23 Zhu H(朱鸿),Li XY(李想韵),Deng Y(邓玉),et al.Isolation,purification and enzymological characterization of catalase from aloe.Food Sci(食品科学),2010,31:206-210.
