产γ-氨基丁酸乳酸菌菌株的分离鉴定
2012-10-25梁金钟
韩 雪,梁金钟
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076)
产γ-氨基丁酸乳酸菌菌株的分离鉴定
韩 雪,梁金钟*
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076)
利用BCP培养基从酸菜汁中分离出两株菌株,经多次纯化得到纯菌株,编号分别为LpL328、ST328,初筛后发现LpL328具有较好的产γ-氨基丁酸(GABA)的能力,通过形态学观察和生理生化实验初步鉴定该菌株为植物乳杆菌(Lactobacillus plantarum)。将LpL328菌株接入发酵培养基中培养,收集菌体制成丙酮干粉,利用透性细胞与底物谷氨酸钠反应生成γ-氨基丁酸(GABA),通过比色法测定出LpL328转化GABA的产率为2.16g/L。
GABA,γ-氨基丁酸,乳酸菌,分离鉴定,发酵
γ-氨基丁酸又叫氨酪酸、4-氨基丁酸,分子式是(4-Aminobutanoiacid,4-AB,简称GABA),相对分子质量为103.12[1],它是一种非蛋白质氨基酸,在动物[2-3]、植物[4]、微生物[5]中均有分布,是哺乳动物中枢神经系统中重要的抑制性神经递质[6]。GABA具有很多重要的生理功能,已报道的生理功能包括降低血压、控制哮喘、促进睡眠、预防和治疗癫痫[7]、健肝利肾、预防肥胖、促进乙醇代谢(醒酒)、改善更年期综合症等[8-9],其已成为一种新型活性因子,广泛应用于医药与食品领域并成为研究热点[10-11]。谷氨酸脱羧酶(Glutamate,简称GAD或GDC,也是GABA生物合成的限速酶[12]),能够催化谷氨酸(Glutamic acid,Glu)合成GABA。GABA的合成方法有化学法、植物富集提取法和微生物发酵法。乳酸菌作为一类安全的微生物广泛地应用于食品工业中,具有多种耐酸机制,最新的一些研究报道称,天然乳酸菌的耐酸生长机制可能与它们含有的GAD活力有关[13-14],可以利用它们生物合成GABA[15],这启示我们可以采取乳酸菌发酵技术获得GABA。本实验从酸菜中分离出一菌株,研究了其产GABA的能力,能够为今后工业化生产GABA打下初步基础。
1 材料与方法
1.1 材料与仪器
酸菜汁 购自农贸市场;γ-氨基丁酸(分析纯)上海阿拉丁公司;正丁醇(分析纯) 天津市永大化学试剂有限公司;冰乙酸(分析纯) 沈阳市新西试剂厂;硅胶板 青岛海洋化工厂分厂;L-谷氨酸(LGlu) 中国惠世生化试剂有限公司;磷酸吡哆醛(PLP) 北京金鑫天佑生物科技有限公司;其他试剂 均为国产分析纯;BCP培养基(乳酸菌分离培养基),MRS液体培养基,MRS固体培养基,TYG培养基。
电子天平 赛多利斯科学仪器(北京)有限公司;立式压力蒸汽灭菌器 上海中安医疗机械厂;HNY-100B恒温培养振荡器 天津市欧诺仪器表有限公司;LG10-2.4A高速离心机 北京京立离心机有限公司;721可见分光光度计 天津市普瑞斯仪器有限公司;DHG-9203A电热恒温鼓风干燥箱 上海一恒科技有限公司;SBA-40D生物传感分析仪 山东生命科学研究所。
1.2 实验方法
1.2.1 菌种的分离纯化 吸取1mL酸菜汁,加入到装有9mL灭菌生理盐水的试管中,依次稀释至10-1、10-2、10-3、10-4、10-55个稀释度,分别取10-3、10-4两个稀释度的稀释液0.5mL置于BCP培养基中进行涂布,37℃培养48h。选择长势较好的平板,挑取单菌落再次转接至BCP培养基中,如此反复进行4~5次,至菌落性状较为稳定时转接至MRS斜面中进行保存。
1.2.2 菌种产GABA能力的初步鉴定 将筛选出来的菌株转接在MRS液体培养基中,37℃活化培养24h,以1%的接种量转接于TYG发酵培养基中,37℃发酵培养48h。将发酵液离心,8000r/min,离心15min,取上清液进行薄层层析分析。
1.2.3 菌种的形态学及生理生化鉴定 挑取BCP平板中的单菌落进行革兰氏染色,在显微镜下观察菌株形态,之后对菌株进行生理生化实验,包括糖发酵实验、石蕊牛奶实验、过氧化氢酶实验、吲哚实验。
1.2.4 菌种的培养及菌体透性细胞的制备 将斜面中保藏的菌种转接入MRS液体培养基活化24h,连续进行两次活化。之后按1%的接种量接入TYG发酵培养中培养48h。
取发酵液离心,8000r/min,15min,弃去上清液,加入无菌生理盐水制成悬菌液,8000r/min,离心15min,弃去上清液,加入无菌生理盐水搅拌5min,离心15min,弃去上清液,加入预先冷冻好的丙酮(菌体∶丙酮= 1∶10)充分搅拌10min,离心,如此反复2次,最后用风机吹干,菌体中的丙酮必须除去否则影响酶活性,所得丙酮粉(即透性细胞)称重留冰箱备用。
1.2.5 细胞反应液中GABA的测定 Berthlot[16]比色法标准曲线的绘制:取0.4mL 0.0、0.1、0.2、0.3、0.4、0.5、0.6g/L的GABA标准溶液,加入1mol/L的Na2CO3溶液0.1mL,然后加入0.2mol/L的四硼酸钠溶液0.5mL,再加入6%的苯酚溶液1mL,混匀后在5min之内加入10%的次氯酸钠溶液1mL,放置8~10min,沸水浴10min,之后冰浴20min,待溶液出现蓝绿色后加入60%的乙醇溶液2mL,20℃下水浴30min。以GABA的浓度(g/L)为横坐标,OD640nm为纵坐标绘制标准曲线[17]。
2 结果与分析
2.1 菌种的分离纯化
经过分离纯化得到10株菌株,其中有两株菌株使BCP培养基菌落周围变黄色,说明该菌株产生乳酸,在BCP培养基上分别呈现出两种不同的菌落形态:一株菌株呈规则圆形,中央凸起,直径大约为1mm,表面较为光滑,乳白色,菌落形态见图1,挑取时有一定粘性,经镜检为球菌,编号为ST328;另一株菌株呈针尖状大小,较为透明,菌落形态见图2,经镜检为杆菌,编号为LpL328。
图1 ST328菌落形态Fig.1 Colony of strain ST328

图2 LpL328菌落形态Fig.2 Colony of strain LpL328
2.2 菌种产GABA能力的初步鉴定
将分离纯化的两株菌分别在MRS液体培养基中活化24h后,按1%接种量转接到TYG发酵培养基中37℃静置培养48h,得到发酵液进行离心,8000r/min,15min,取上清液进行薄层层析。利用0.25%茚三酮作为显色剂。与标准品GABA的样点比较Rf值,发现发酵液中可能含有GABA,结果如图3所示。由薄层层析结果可以看出,ST328发酵液的点显色较浅,而LpL328发酵液的点显色较为明显,说明此菌株具有相对较好的产GABA的能力,故对LpL328进行进一步研究。
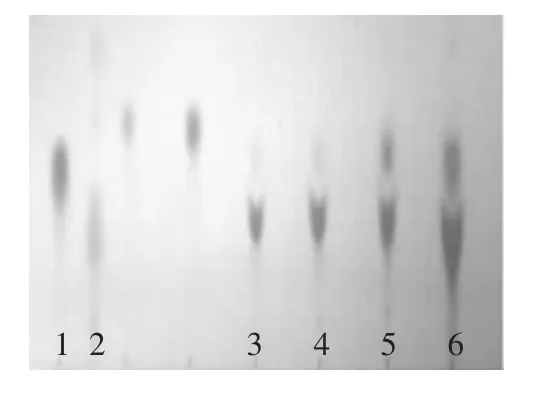
图3 薄层层析结果Fig.3 Result of thin layer chromatography
2.3 菌种的形态学及生理生化鉴定
2.3.1 形态学鉴定 产GABA的菌种经过革兰氏染色确定为革兰氏阳性菌,呈短杆状,结果见图4。

图4 菌株形态特征Fig.4 Microscopic observation of strain LpL328
2.3.2 生理生化鉴定 吲哚实验:在试管中挑取单菌落接入蛋白胨水培养基中,37℃下静置培养48h后,向培养基中加入3~4滴乙醚,摇动数次,静置1min,待乙醚上升后沿试管壁徐徐加入2滴吲哚试剂,若乙醚与培养物之间产生粉红色环状物为阳性反应,结果见表1。
石蕊牛奶实验:在试管中挑取单菌落接入石蕊牛奶中,37℃静置培养48h后观察结果,如石蕊牛奶变粉色并产生凝固现象为阳性反应,结果见表1。
过氧化氢酶实验:将3%~10%的过氧化氢取一滴滴在干净的载玻片上,将一环菌种在过氧化氢中涂抹,若有气泡产生则为阳性,无气泡则为阴性,也可将过氧化氢直接滴在试管中观察,结果见表1。

表1 菌株生理生化试验Table 1 Biochemical properties of strain
从表1的实验结果可以看出,吲哚实验中蛋白胨水培养基中有红色环状物产生,证明呈阳性;石蕊牛奶变色并有凝固现象出现,呈阳性;接触酶实验未产生气泡,呈阴性。
将培养好的试管斜面菌株分别接入20种糖发酵管中,37℃下静置培养48h后观察结果,结果见表2。
从表2的实验结果可以看出,糖发酵实验中的菌株不消耗木糖、核糖、阿拉伯糖及鼠李糖,呈阴性,其他均呈阳性。
根据上述生理生化实验,确定该菌为革兰氏阳性乳杆菌,吲哚实验为阳性,接触酶实验、石蕊牛奶实验结果为阳性,糖发酵实验中菌株不消耗木糖、核糖、阿拉伯糖及鼠李糖。根据伯杰氏细菌学鉴定手册(第九版),综合以上现象,初步确定此菌种为植物乳杆菌。
2.4 细胞反应液中GABA含量的测定
将收集的丙酮干粉(即透性细胞)磨细后,用pH4.2~4.8的乙酸-乙酸钠缓冲液,按2%、4%、6%、8%、10%的浓度分别配制成透性细胞缓冲溶液,在1mmol/L的PLP作用下与5g/L的底物L-Clu进行反应,37℃下200r/min摇床反应20h,并且以同样操作的不加底物的细胞缓冲液作为空白。之后将反应液离心,取上清液进行定性及定量测定。
2.4.1 细胞反应液中GABA的定性测定 将反应后的细胞液离心取上清液,进行薄层层析。展开剂为正丁醇∶冰醋酸∶水=4∶1∶2,显色剂为0.25%的茚三酮。将谷氨酸标准液、GABA标准液、反应上清液、发酵上清液用进样器依次点在薄层板上,晾干后放入层析缸中,约2h后取出晾干喷洒茚三酮,待干燥后放入80℃烘箱中显色15min,结果见图5。
由图5可以看出,发酵液的点显色较浅,说明GABA含量较少;反应液的点显色较深,GABA含量明显高于发酵液,说明细胞反应能够更有效地转化底物L-Clu为GABA,而具体含量需进一步确定。
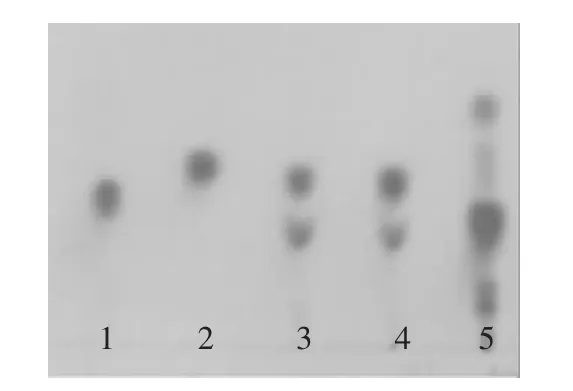
图5 薄层层析结果Fig.5 Result of thin layer chromatography
2.4.2 细胞反应液中GABA的定量测定 GABA的检测方法有很多种,包括酶法、放射受体法、薄层扫描法、毛细管电泳法、高效液相色谱法、氨基酸分析仪检测等。以上方法不适合大量样品的测定,而利用Berthelot反应的比色法经验证是一种适合大量样品测定的较为准确的检测GABA的方法,其原理是利用苯酚、次氯酸钠和游离氨发生显色反应,具有较高的灵敏度,可用于测定不同体系中的微量氨和盐类。
以GABA标准溶液的浓度C为横坐标、OD值为纵坐标绘制标准曲线,如图6所示,经统计分析得出的回归方程为y=1.505x-0.0038,相关系数R2=0.9975。故细胞反应液中GABA浓度在0~0.6g/L的范围内与吸光值的相关性较好。
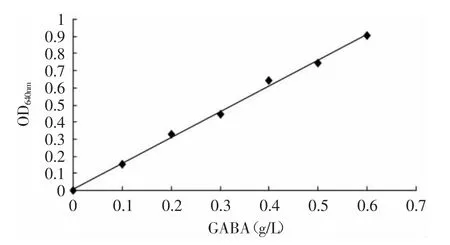
图6 GABA标准曲线Fig.6 Standard curve of GABA in Berthelot reaction
取离心后的上清液0.4mL,按照标准曲线的方法,测定其吸光度,之后带入标准曲线计算其GABA含量,结果见图6。
如图7所示,不同浓度的透性细胞液产GABA的含量不同,最初增加细胞浓度时,GABA浓度几乎成直线上升,而随着透性细胞浓度的继续上升,GABA含量上升的趋势变缓,原因可能为底物分子与酶的结合已趋于饱和。在透性细胞液浓度为6%时,测得GABA的最高含量为2.16g/L。
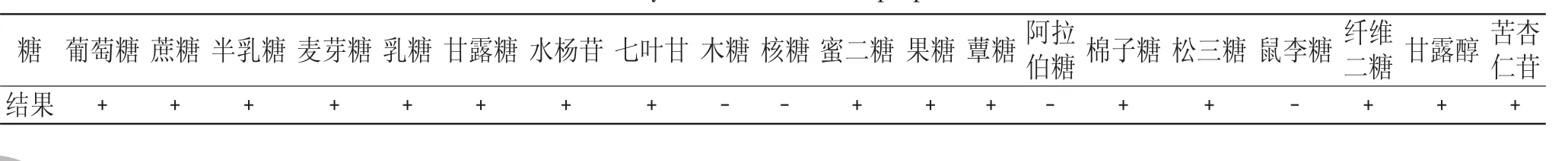
表2 糖发酵试验Table 2 Carbohydrate fermentation properties of strain
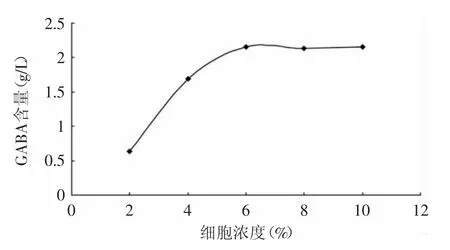
图7 不同透性细胞浓度对GABA含量的影响Fig.7 Effect of different cell concentration on GABA content
2.5 不同培养基对菌体产GABA的影响
MRS培养基具有较为丰富的营养物质,理论上可以促进菌体的生长,故利用MRS培养基培养菌体,考察其对菌体生长及GABA产量的影响。
将活化后的菌液按1%接种量分别接于TYG培养基与含10g/L底物谷氨酸钠的MRS培养基中,37℃静置培养48h后,分别取发酵液进行10倍稀释,测其吸光度值分别为0.289与0.566。
取发酵液离心收集菌体,制作丙酮粉。将制成的TYG和MRS丙酮粉分别按6%的比例加入pH4.2~4.8的乙酸-乙酸钠缓冲溶液,在1mmol/L的PLP作用下与5g/L的底物L-Clu进行反应,37℃下200r/min摇床反应20h。之后将反应液离心,8000r/min,15min,取上清液进行比色测定,将吸光度值带入标准曲线得到GABA浓度分别为2.16g/L与0.122g/L。
由以上数据可以看出,MRS培养基可以促进菌体的大量生长,但是GABA的含量较TYG产GABA的量少很多,原因可能为MRS培养基中某种物质抑制了GAD酶的活性,使其不能将底物转化为GABA,故MRS培养基不适用于LpL328的培养,在以后的实验中还是采用TYG培养基。
2.6 辅酶对GABA含量的影响
VB6是一种含吡哆醇或吡哆醛或吡哆胺的B族维生素,是某些辅酶的组成成分。PLP为磷酸吡哆醛,是GAD的辅酶,能够促进底物转化为GABA;而目前市面中的VB6主要成分为盐酸吡哆辛,也可以作为某些转氨酶的辅酶,本实验采用等量VB6替代PLP,考察其作用,其他反应条件均相同。取各试样上清液进行比色测定,得到吸光度值带入标准曲线得到GABA浓度分别为:含有PLP试样为2.16g/L,不含有PLP试样为0.612g/L,VB6试样为0.725g/L。
磷酸吡哆醛是氨基酸代谢中的转氨酶及脱羧酶的辅酶,能促进谷氨酸脱羧,促进γ-氨基丁酸的生成,在同样的用量及反应条件下,VB6并没有与PLP起到相同的作用,而与不加任何辅酶的样品GABA含量相差不大,故在后续实验中依然采用PLP作为辅酶,但是PLP价格较高,长期使用会增加实验成本,而选择一种成本较低的辅酶替代物也是今后研究的主要内容。
3 结论
本实验从酸菜汁中筛选到两株乳酸菌LpL328、 ST328,通过对菌株发酵液的定性分析确定LpL328具有相对较好的产GABA的能力,对其进行生理生化测定初步确定此菌株为植物乳杆菌(Lactobacillus plantarum),利用此菌株发酵得到的菌体细胞制作不同浓度梯度的透性细胞与底物溶液反应,透性细胞浓度为6%时得到GABA的含量最高,为2.16g/L。另外,LpL328在TYG培养基中有良好的产GABA的能力,但是在MRS培养基中却没有,而PLP作为一种辅酶也是产GABA反应中不可缺少的。
[1]叶砚.高产γ-氨基丁酸红曲菌种培育及深层发酵关键技术研究[D].金华:浙江师范大学,2010.
[2]陈希贤,李东,吕建新,等.高效液相色谱法测定人脑脊液中γ-氨基丁酸和谷氨酸[J].色谱,1997,15(3):237-239.
[3]彭俊华,张峰,齐心亮,等.介绍一种大鼠脑中γ-氨基丁酸受体的检测方法[J].西北国防医学杂志,1999,20(4):266-268.
[4]苏国兴,董必慧,刘友良,等.γ-氨基丁酸在高等植物体内的代谢和功能[J].植物生理学通讯,2003,39(6):670-676.
[5]李海星,江英英,曹郁生.产γ-氨基丁酸乳酸菌的筛选及初步鉴定[J].天然产物研究及开发,2007,19:455-457.
[6]Bazemore AW,ElliottK AC,Florey E.Isolation of factor I[J].Neurochem,1957(1):334-339.
[7]瞿声利.树脂吸附分离耦合固定化短乳杆菌生产GABA的研究[D].杭州:浙江大学,2009.
[8]Satya Narayan V,Nair P M.Metabolism,enzymology and possible roles of 4-aminobutyric acid[J].Biochemistry,1989(8):21-25.
[9]Ki-Bum P,Suk-Heung O H.Production of yogurt with enhanced levels of gamma-aminobutyricacid and valuable nutrients using lactic acid bacteria and germinated soybean extract[J].Bioresource Technology,2007,98:1675-1679.
[10]Ki-Bum P,Suk-Heung O H.Production and characterization of GABA rice yogurt[J].Food Sci Biotechnol,2005,14:518.
[11]Ki-Bum P,Suk-Heung O H.Cloning and expression of a full-length glutamate decarboxylase gene from Lactobacillus plantarum[J].J Food Sci Nutri,2004(9):324-329.
[12]孙百申.红曲霉发酵及某些生理活性物质的研究[D].杭州:浙江工业大学,2004.
[13]Lorca GL,DeValdez GF.Alow-pH-inducible.stationaryphase acid tolerance pesponse in Lactobacillus acidophilus CRL639[J].Current Microbiol,2001,42(1);21-25.
[14]Cotter PD,Gahan GM,Hill C.A glutamate decarboxylase system protects Listerria monocytogenes in gastric fluid[J].Mol Microbiol,2001,40(2):465-475.
[15]Yokuyama S,Hiramatsu I,Hayakawa K.Production of γaminobutyric acidfrom,distillery brevislees by lactobacillus IFO-1 2005[J].J Biosci Bioeng,2002,93(1):95-97.
[16]Kitaoka S,Nakano Y.Colorimetric determination of ωaminoacids[J].The Journal of Biochemistry,1969,66(1):87-94.
[17]杨胜远,陆兆新,吕凤霞,等.谷氨酸脱羧酶活力测定中GABA比色定量方法研究[J].食品科学,2006,27(7):205-206.
Isolation and screening of lactobacillus strains for producing γ-amino butyric acid
HAN Xue,LIANG Jin-zhong*(College of Food Engineering,Harbin University of Commerce,Harbin 150076,China)
Two strains were isolated from pickled Chinese cabbage and then purified.Strains were numbered LpL328,ST328 and the former was proved to have a property to produce γ-amino butyric acid(GABA). LpL328 strain was identified Lactobacillus plantarum by morphological observation and physiological and biochemical tests.The strain was inoculated into fermentation medium,then cells were collected and made into acetone powder.GABA was produced by reaction of acetone powder with substrate sodium glutamate.The content of GABA was 2.16g/L.
GABA;γ-Amino butyric acid;lactic acid bacteria;isolation and identification;fermentation
TS201.3
A
1002-0306(2012)20-0180-04
2012-08-07 *通讯联系人
韩雪(1987-),女,硕士研究生,研究方向:应用微生物与发酵工程。
黑龙江省高校科技创新团队建设计划基金项目(2010td04)。
