三种HPLC色谱条件下测定奥美拉唑含量方法的比较
2012-10-22李美珍房志仲
王 旭,李美珍,卢 欣,房志仲
(天津医科大学药学院药剂学教研室,天津市临床药物关键技术重点实验室,天津300070)
奥美拉唑(omeprazole,OMZ)为苯并咪唑类质子泵抑制剂(PPIs),可抑制胃壁细胞膜内质子泵(H+-K+-ATP酶系)[1]。临床用于胃十二指肠溃疡、反流性食管炎、卓-艾综合征以及急性消化性溃疡出血的治疗[2]。由于奥美拉唑在酸性环境下易降解[3],目前国内上市的奥美拉唑大多是肠溶制剂,采用肠溶包衣保护药物免遭胃酸破坏。《中国药典》2010年版(二部)收载奥美拉唑的含量测定方法为HPLC法,C8柱,流动相为0.01mol/LNa2HPO4(用稀磷酸调pH至 7.6)-乙腈(75∶25)[4]。国家药品监督管理局《新药转正标准》第18册奥美拉唑肠溶胶囊的测定方法[5],C18柱,选择甲醇-水-磷酸-三乙胺(65∶35∶0.12∶0.3)为流动相进行试验。参照药典(C8-乙腈体系)和新药转正标准(C18-甲醇体系),进行方法摸索,得到C8-甲醇体系。本试验比较3种分析方法有无差异。
1 材料与方法
1.1 仪器 高效液相色谱仪(美国Spectra-physics公司),Spectra Focus紫外检测器(美国Spectraphysics公司),Kromasil-C18柱,Kromasil-C8柱,输液泵 SP8810,Anstar色谱工作站,ZDY-…-1IKVA高精密度单相交流稳压器(国营启东电讯厂),电子分析天平(赛多利斯),80-2B离心机(上海安亭科学仪器厂),KQ-100B型超声波清洗器(昆山市超声仪器有限公司),PHS-25型数显pH计(上海精密科学仪器有限公司)。
1.2 试药 奥美拉唑对照品(中国食品药品检定研究院提供,批号:100367-201104);A 厂家(奥美拉唑肠溶胶囊,20mg/粒,批号:1110030);B 厂家(奥美拉唑肠溶片,10mg/片,批号:008110401);C 厂家(奥美拉唑镁肠溶片,20mg/片,批号:NE11093);甲醇(天津市康科德科技有限公司,色谱纯);乙腈(天津市康科德科技有限公司,色谱纯);其它试剂均为市售分析纯;重蒸水自制。
1.3 方法
1.3.1 色谱条件及系统适用性
1.3.1.1 C8-乙腈体系:色谱柱:TIANHE誖C8柱(200 mm×46mm,5 μm);流动相:0.01mol/LNa2HPO4-乙腈(65∶35),用稀磷酸调 pH 至 8.0;流速:0.8mL/min;检测波长:302 nm;柱温:室温;进样量:20μL。
1.3.1.2 C8-甲醇体系:色谱柱:TIANHE誖C8柱(200 mm ×4.6 mm,5 μm); 流 动 相 :0.01 mol/L Na2HPO4-甲醇(45∶55),用稀磷酸调 pH 至 8.0;流速:0.8mL/min;检测波长:302 nm;柱温:室温;进样量:20μL。
1.3.1.3 C18-甲醇体系:色谱柱:TIANHE誖C18柱(200mm×4.6mm,5μm);流动相:甲醇-水-磷酸-三乙胺(60∶40∶0.12∶0.3);流速:0.8mL/min;检测波长:302 nm;柱温:室温;进样量:20μL。
1.3.1.4 系统适用性:分别在3个体系中,对照品及制剂中,奥美拉唑的峰形对称、分离度大于1.5,理论塔板数不小于4 000。
1.3.2 对照品溶液配制 精密称取奥美拉唑对照品20mg,置于100mL量瓶中,加甲醇稀释定容,摇匀,得到奥美拉唑储备液200μg/mL。量取储备液1mL于10mL量瓶中,分别于3个体系下加流动相稀释至刻度,得到对照品溶液20μg/mL。
1.3.3 供试品溶液配制 分别在3种方法体系下,取奥美拉唑肠溶片/胶囊,去胶囊壳,研细称取适量(约相当于奥美拉唑2mg)于50mL量瓶中,用流动相超声10min溶解,稀释至刻度,取适量3 000 r/min离心5min,取上清液5mL置于10mL量瓶中用流动相稀释定容。
1.3.4 标准曲线的绘制 分别在3种方法体系下,分别量取“1.3.2”项下200μg/mL储备液0.10、0.25、0.50、0.75、1.00、1.25、1.50mL 置于 10 mL 量瓶中,用流动相稀释定容摇匀,得到 2、5、10、15、20、25、30μg/mL的奥美拉唑系列溶液,按“1.3.1”项下色谱条件测定,分别精密量取20μL进样,并绘制标准曲线。
1.3.5 精密度试验 分别在3种方法体系下,取同一份对照品溶液,分别按“1.3.2”项下方法配制,按“1.3.1”项下色谱条件测定,连续6次进样,记录峰面积,并计算RSD。
1.3.6 稳定性考察 分别在3种方法体系下,取同一份对照品溶液,分别按“1.3.2”项下方法配制,分别于 0、3、6、9、12、24 h,按“1.3.1”项下色谱条件测定,记录峰面积,并计算RSD。
1.3.7 重现性试验 分别在3种方法体系下,取同一批次(A厂家,批号1110030)样品6份,分别按“1.3.3”项下方法配制,按“1.3.1”项下色谱条件测定,记录峰面积,并计算RSD。
1.3.8 回收率试验 采用加样回收法,取奥美拉唑肠溶胶囊A,除去囊壳研细称取约22.69mg(约相当于奥美拉唑2mg),9份,精密称定,置于50mL量瓶中,分别按照80%、100%、120%的量,加入“1.3.2”项下储备液 0.8、1、1.2mL,按“1.3.3”项下方法配制供试品溶液,按“1.3.1”项下色谱条件测定,计算回收率。
1.3.9 含量测定 分别在3种方法体系下,按“1.3.3”项下方法配制供试品溶液,分别测定3批,按“1.3.1”项下色谱条件测定,计算RSD,对结果进行方差分析[6],比较3种分析方法是否存在显著性差异。
2 结果
2.1 系统适用性 3种不同体系下对照品和制剂的色谱图见图1、2。
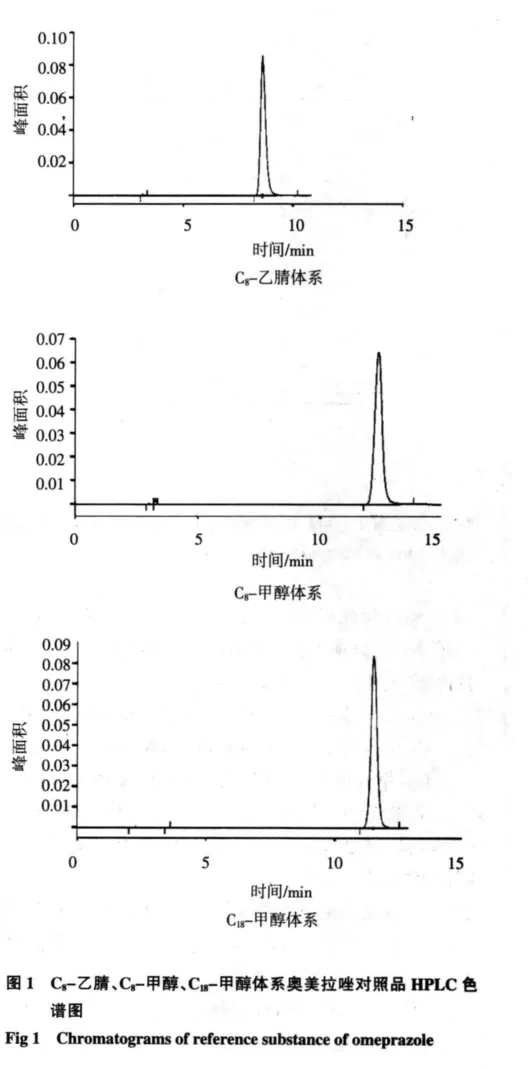
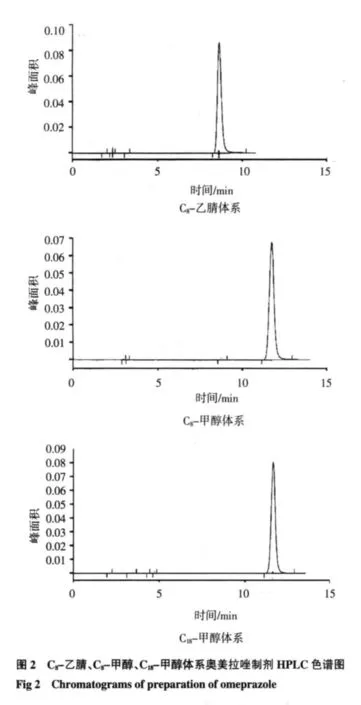
2.2 标准曲线的绘制 按“1.3.4”项下条件测定,以浓度(C)为横坐标,峰面积(A)为纵坐标,进行线性回归,得到回归方程如下:
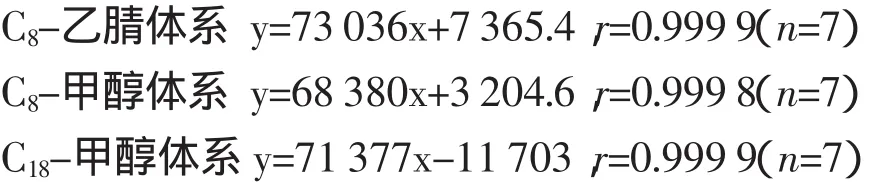
结果表明:分别在3种不同方法体系下,奥美拉唑浓度在2.00~30.00μg/mL范围内与峰面积A成良好的线性关系。
2.3 精密度试验 3种不同方法体系下RSD分别为 0.26%、0.57%、0.54%(C8-乙腈体系、C8-甲醇体系、C18-甲醇体系),均小于2.0%,符合中国药典2010年版二部附录ⅥD的规定,表明这3种不同方法,精密度均良好。
2.4 稳定性考察 3种不同方法体系下分别于0、3、6、9、12、24 h 后进样,RSD 分别为 0.88%、1.19%、1.08%(C8-乙腈体系、C8-甲醇体系、C18-甲醇体系),表明在3种不同体系下,奥美拉唑溶液均24 h内稳定。
2.5 重现性试验 3种不同方法体系下RSD分别为 0.51%、0.82%、0.64%(C8-乙腈体系、C8-甲醇体系、C18-甲醇体系),均小于2.0%,表明这3种方法重现性均良好。
2.6 回收率试验
2.6.1 C8-乙腈体系 平均回收率为100.36%(RSD=0.88%,n=9),平均回收率的相对标准偏差小于2.0%,符合方法学要求,结果见表1。
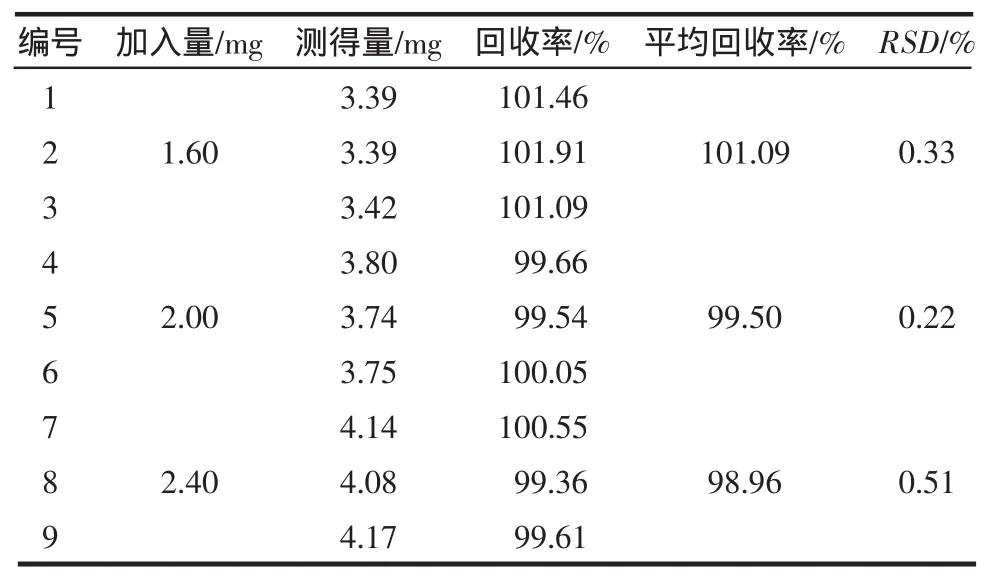
表1 回收率试验结果(C8-乙腈体系)Tab1 Resultsof recovery test(C8-acetonitrile system)
2.6.2 C8-甲醇体系 平均回收率为100.91%(RSD=0.61%,n=9),平均回收率的相对标准偏差小于2.0%,符合方法学要求,结果见表2。
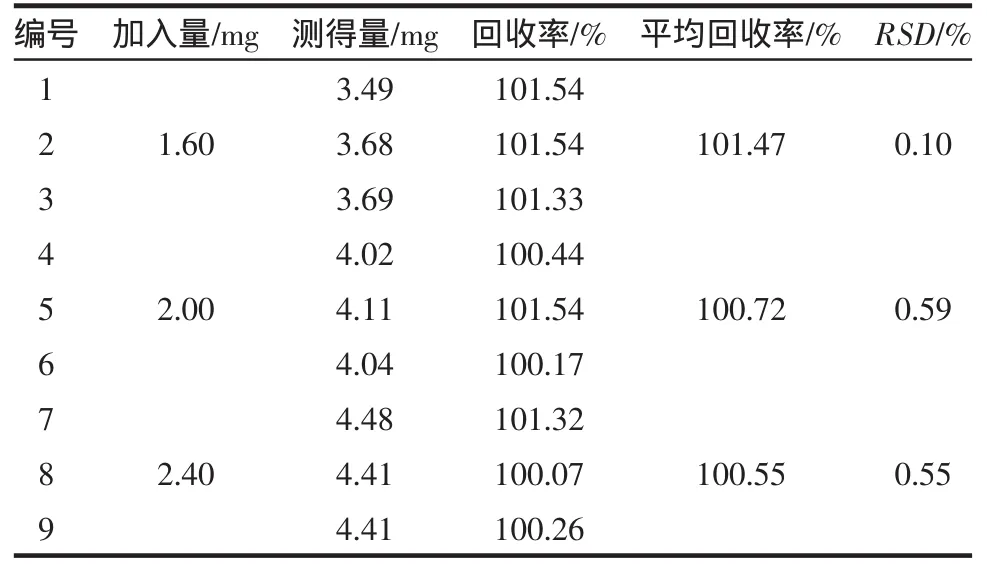
表2 回收率试验结果(C8-甲醇体系)Tab2 Resultsof recovery test(C8-methanolsystem)
2.6.3 C18-甲醇体系 平均回收率为100.51%(RSD=1.09%,n=9),平均回收率的相对标准偏差小于2.0%,符合方法学要求,结果见表3。
2.7 含量测定
2.7.1 分别在3种方法体系下,对3个厂家的奥美拉唑肠溶片/胶囊进行含量测定,结果见表4~6。
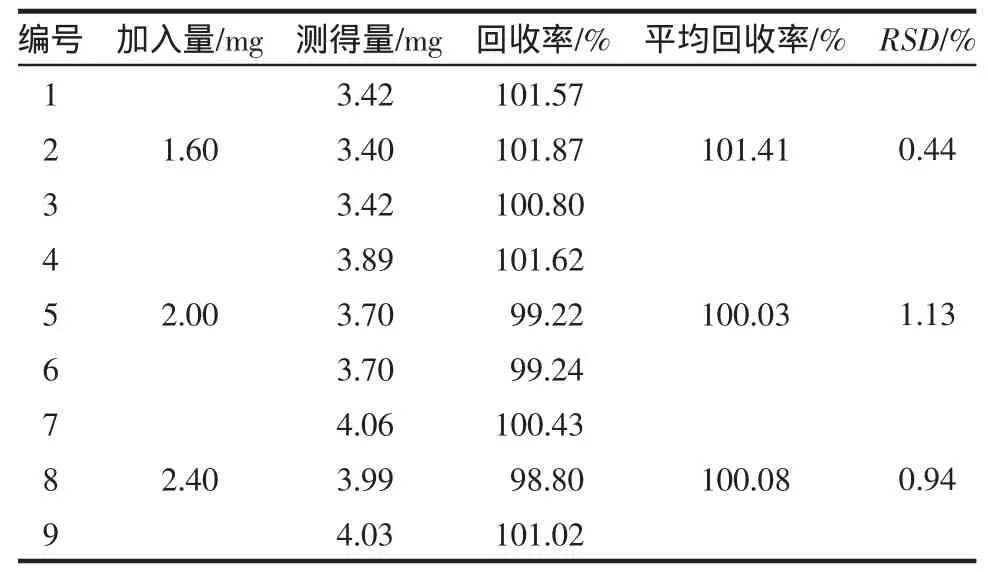
表3 回收率试验结果(C18-甲醇体系)Tab 3 Results of recovery test(C18-methanolsystem)
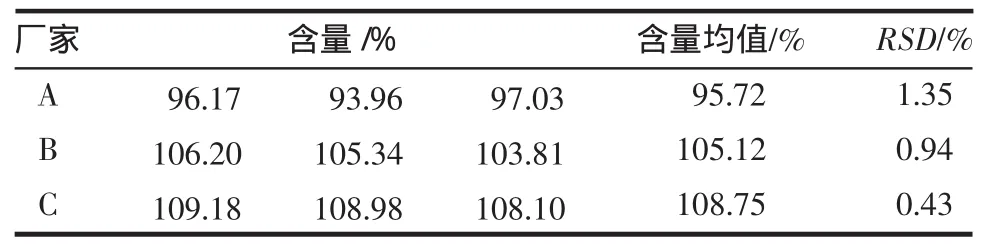
表4 C8-乙腈体系3厂家产品中奥美拉唑含量测定结果(n=3)Tab4 Results of content determination of omeprazole from 3 manufacturersby C8-acetonitrilesystem(n=3)
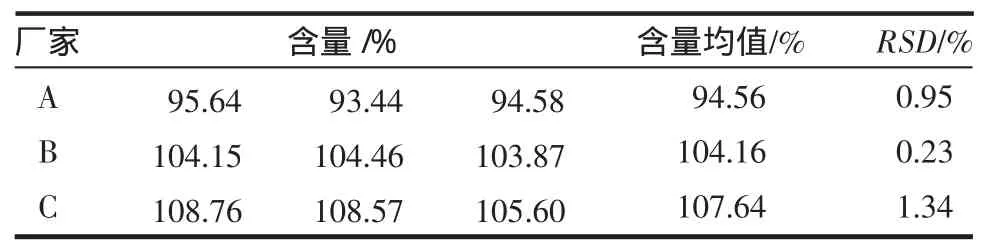
表5 C8-甲醇体系3厂家产品中奥美拉唑含量测定结果(n=3)Tab5 Resultsof content determ ination of omeprazole from 3 m anufacturersby C8-m ethanolsystem(n=3)
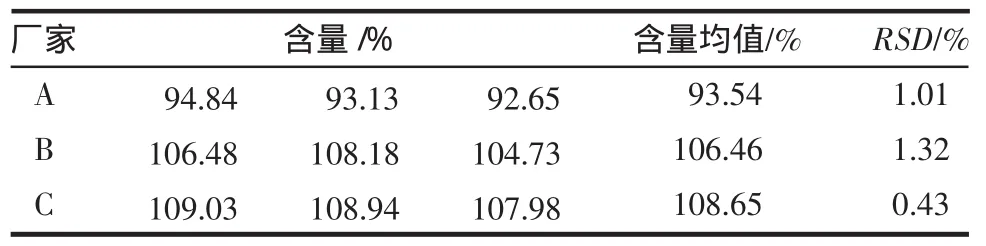
表6 C18-甲醇体系3厂家产品中奥美拉唑含量测定结果(n=3)Tab6 Resultsof content determination of omeprazole from 3 manufacturersby C18-methanolsystem(n=3)
2.7.2 含量测定结果比较 见表7。
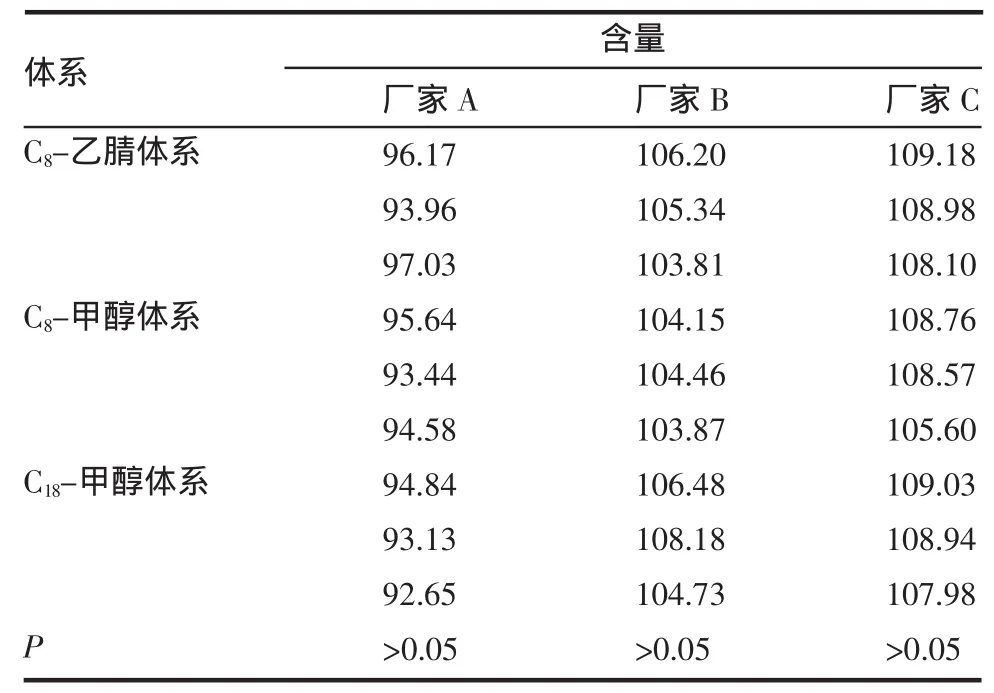
表7 不同体系下奥美拉唑含量测定结果比较Tab7 Comparison of determ ination of om eprazole of 3 different system s
方差分析结果显示,P>0.05,A、B、C 3 个厂家的奥美拉唑在3种不同体系下含量测定结果无显著性差异。
3 讨论
3.1 奥美拉唑在不同pH环境下的稳定性 有文献报道奥美拉唑在碱性环境下稳定,pH<8,稳定性下降[7-8]。分别配置一系列pH环境的奥美拉唑溶液考察其稳定性[9]。在C8-甲醇体系下,以流动相溶剂,1%磷酸调节pH的流动相为稀释剂,得到pH为8.5、8.0、7.5、7.0、6.5、6.0、5.5、5.0、4.5 的一系列奥美拉唑溶液。结果显示,在室温下,pH4.5,pH5极不稳定,在0 h进样出现杂质峰,即奥美拉唑被破坏;pH5.5 在 2 h 时出现杂质峰;pH6、pH6.5,pH7,pH7.5在8 h内稳定;pH8.0 2 d内稳定;pH8.5 3 d内稳定。
3.2 奥美拉唑在不同母液中的稳定性 选择甲醇、乙腈和流动相作为溶剂配制母液。在C8-甲醇体系下,精密量取母液1mL至10mL量瓶中,用流动相稀释定容。每24 h,重新量取不同溶剂母液,用流动相稀释,进样。试验结果显示,甲醇母液和pH8.0的流动相母液在24 h内稳定;乙腈母液3 d内稳定。
3.3 3个测定体系的比较 《中国药典》2010年版(二部)和国家药品监督管理局《新药转正标准》第18册奥美拉唑肠溶胶囊对奥美拉唑含量测定方法分别为C8-乙腈体系、C18-甲醇体系。在具体试验过程中,综合考虑试剂毒性、试验成本等问题,C8-乙腈体系中用甲醇替代乙腈进行流动相摸索,确定C8-甲醇体系,即 0.01mol/L甲醇(45:55),用稀磷酸调pH至8.0。试验结果显示,在3种色谱条件中,奥美拉唑的保留时间均在10min左右,奥美拉唑含量测定在C8-乙腈体系与C8-甲醇体系中无显著性差异,乙腈与甲醇相比较,毒性更大且成本更高,故未进行C18-乙腈体系试验研究。在进行制剂含量测定试验时,同一厂家同一批号的奥美拉唑制剂在C8-乙腈、C8-甲醇、C18-甲醇3体系中的测定结果是一致的,无显著性差异,即3个方法无显著性差异。而A厂家的含量测定结果明显低于B、C两厂家,可能由于不同厂家使用药物原料药来源不同,生产过程中使用的辅料、配方、生产工艺等因素存在差异。
3.4 样品预处理 奥美拉唑肠溶片分别进行除去肠溶衣后研细称样以及不除去肠溶衣直接研细称样,进样后色谱图无显著性差异,肠溶衣不干扰奥美拉唑测定,因此处理过程不除去肠溶衣直接研细称量。
3.5 其他 3种不同含量测定方法无显著性差异,但C8柱与C18柱相比,使用寿命短,成本高。流动相体系中,与甲醇相比,乙腈的毒性大、成本高。因此从试验操作人员的自身安全与试验成本等方面综合考虑,优先考虑使用C18-甲醇体系。
[1]郭丰,张宝娣,谢丹青.奥美拉唑药物相互作用分析[J].中国现代药物应用,2011,5(7):79
[2]国家药典委员会.中华人民共和国药典临床用药须知化学药和生物制品卷[S].北京:人民卫生出版社,2005:277-278
[3]张俊松,戚燕,王晓利,等.注射用奥美拉唑溶液配伍稳定性研究[J].中国药师,2007,10(4):352
[4]国家药典委员会.中华人民共和国药典(二部)[S].2010版,北京:化学工业出版社,2010:1038-1041
[5]国家药品监督管理局.新药转正标准—奥美拉唑肠溶胶囊[S].18册.北京:中国医药科技出版社,2005:256-256
[6]高忠江,施树良,李钰.SPSS方差分析在生物统计的应用[J].现代生物医学进展,2008,8(11):2116
[7]陈清,卢秀华,薛占英,等.pH值及温度对注射用奥美拉唑钠溶液质量的影响[J].中国药业,2007,16(9):23
[8]黄荣富,孙俊峰,余平.奥美拉唑钠在不同pH值条件下的稳定性考察[J].中国现代临床医学,2008,7(5):72
[9]许东航,徐翔.国产静注奥美拉唑的稳定性研究[J].药物分析杂志,2006,26(2):271
