不同糖代谢状态患者非酒精性脂肪肝患病率和相关危险因素
2012-10-22聂秀玲孙丽荣
张 晶,聂秀玲,孙丽荣
(天津医科大学代谢病医院糖尿病痛风科,卫生部激素与发育重点实验室,天津300070)
非酒精性脂肪肝(NAFLD)发病呈全球流行性趋势[1]。NAFLD与糖尿病(DM)关系密切,普通成人NAFLD患病率为20%~33%[2],肥胖人群为57%~74%[1],在糖尿病人群中达70%~80%[3];无DM史的NAFLD经口服葡萄糖耐量试验(OGTT)检查后有44%的患者为糖耐量受损(IGT)或DM[4]。胰岛素抵抗(IR)可能是NAFLD与糖代谢异常的共同通路,两者相互影响。本研究采用B超检测脂肪肝,探讨不同糖代谢状态患者脂肪肝的患病情况以及NAFLD的主要危险因素。
1 对象与方法
1.1 研究对象 选取2011年3月至2012年2月215例居住天津地区23~84岁体检者,根据OGTT检查结果分为3组:(1)糖调节异常(IGR)组47例,年龄(50.31±12.29)岁。(2)新诊断2型糖尿病(NT2DM)组 74例,年龄(51.09±10.27)岁。(3)正常糖耐量(NGT)组 94例,年龄(44.36±14.07)岁。所有受试者既往无糖尿病史。无严重肾脏疾病史及肾功能异常(Cr≥115μmol/L)。无恶性肿瘤史。无严重精神疾患史。调查前1个月内及调查中未使用可能影响糖代谢的药物如糖皮质激素、甲状腺素、噻嗪类药物等。否认慢性病毒性肝炎史。否认自身免疫性肝病、药物性肝病和其他遗传性疾病所致的肝病。无大量饮酒史(酒精摄入量:男性<20 g/d,女性<10 g/d)。均未进行任何降糖治疗,近1个月调脂、降压药物种类及剂量未改变
1.2 诊断标准 糖尿病,IGR的诊断参照2003年美国糖尿病协会(ADA)的糖尿病、IGR诊断标准;NAFLD的诊断依据中华医学会肝脏病学分会脂肪肝和酒精性肝病学组《非酒精性脂肪性肝病诊疗指南》[2]。
1.3 方法
1.3.1 一般资料收集 年龄、性别、身高、体质量、腰围、臀围,计算体质量指数(BMI)=体质量(kg)/身高(m2)。
1.3.2 生化指标检测 空腹隔夜禁食12 h,取肘静脉血测定血糖及胰岛素;计算HOMA-IR=空腹血糖(FPG)×空腹胰岛素(FINS)/22.5。检测肝酶(ALT、AST、ALP、γ-GGT)及血脂(TC、TG、HDL-c、LDL-c)。
1.3.3 脂肪肝检测方法 应用美国GELOGIQ7超声检测仪检测。
1.4 统计学分析 采用SPSS 18.0进行统计分析,计量资料用x±s表示,组间比较采用LSD方差分析。计数资料计算构成比及率的比较采用χ2检验。多因素分析采用Logistic回归。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料 3组的性别、HDL-c、ALT、AST、ALP、BUN、SCr差异无统计学意义(P>0.05);NT2DM组及IGR组的舒张压、γ-GGT明显高于正常对照组。年龄、收缩压、BMI、腰围、TC、TG、LDL-c、FPG、2hPG(P<0.01)随血糖升高逐渐升高(NT2DM 组>IGR组>NGT组)。IGR组的SUA明显高于NT2DM组和正常对照组(P<0.05),见表1。
表1 不同糖代谢患者一般临床特征Tab1 Thegeneralclinicalcharacteristicsof individualswith variousstatusesof glucosem etabolise

表1 不同糖代谢患者一般临床特征Tab1 Thegeneralclinicalcharacteristicsof individualswith variousstatusesof glucosem etabolise
与 NGT组比较,a P<0.05,b P<0.01;与 IGR组比较,c P<0.05,d P<0.01
组别NGT IGR NT2DM P年龄/岁44.36±14.07 50.31±12.29b 51.09±10.27b 0.001男/女48/46 22/27 44/30 0.285 n 92 49 74-BMI/(kg/m2)23.47±3.62 25.61±4.51b 26.89±3.60bc 0.000腰围/cm 83.06±10.44 89.30±11.13b 92.57±8.75bc 0.000舒张压/mmHg 74.10±9.91 80.94±12.28b 81.30±9.24b 0.000收缩压/mmHg 114.46±13.95 128.16±18.70b 129.15±18.08bc 0.000组别NGT IGR NT2DM P γ-GGT/(IU/L)28.17±26.17 42.61±59.30a 40.36±27.47a 0.036 SCr/(μmol/L)63.98±15.18 64.53±13.55 59.71±14.29 0.101 BUN/(mmol/L)5.45±3.03 5.34±1.13 6.30±8.41 0.507 FPG/(mmol/L)4.93±0.48 5.81±0.57bd 8.63±2.72bd 0.000 SUA/(μmol/L)318.67±104.41 341.87±88.41 301.34±96.32c 0.083 2hPG/(mmol/L)6.16±1.05 8.71±1.22bd 16.08±4.17bd 0.000 HOMA-IR 1.65±0.98 2.58±1.13 4.48±2.20ad 0.008组别NGT IGR NT2DM P甘油三酯/(mmol/L)1.27±0.88 1.66±0.89 2.58±3.04bd 0.000 HDL-c/(mmol/L)1.46±0.45 1.45±0.41 1.40±0.30 0.625胆固醇/(mmol/L)4.67±0.92 4.96±0.94 5.31±1.34bc 0.001 ALT/(IU/L)20.86±17.63 25.41±19.56 23.37±13.02 0.284 LDL-c/(mmol/L)2.78±0.75 2.95±0.80 3.28±0.92bc 0.001 AST/(IU/L)19.32±6.12 21.58±8.26 21.22±12.04 0.257 ALP/(IU/L)69.41±28.21 74.38±33.07 76.16±28.52 0.316
2.2 不同糖代谢患者NAFLD检出率比较 NAFLD的检出率随糖代谢紊乱加重而逐渐增加(P<0.001)。NGT、IGR及 NT2DM组 NAFLD检出率分别为16.3%、38.8%、64.9%。其中男性检出率分别为20.83%、54.55%、68.18%,女性检出率分别为10.87%、25.93%、60.00%,见表2。
2.3 Logistic回归分析 以是否患有脂肪肝为因变量,其他临床资料为自变量,采用二元Logistic回归,结果显示,BMI、TG、HOMA-IR 是其主要危险因素(B 值分别为 0.176、0.599、0.244,P<0.05)。
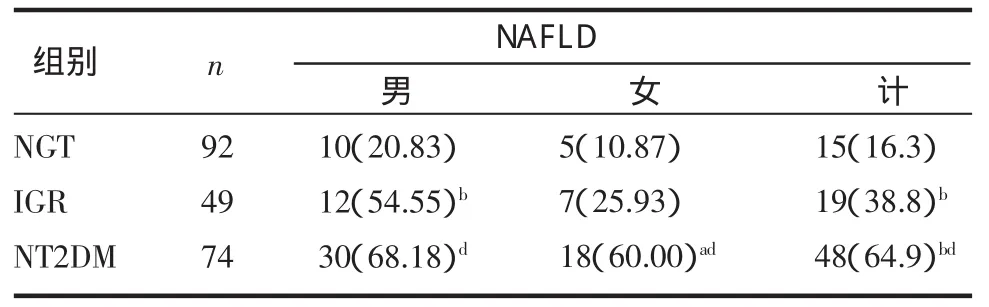
表2 3组不同糖代谢水平患者NAFLD的检出率[n(%)]Tab2 Detection rateof nonalcoholic fatty liver disease in individualswith variousstatusesof glucosem etabolise[n(%)]
3 讨论
NAFLD是指除外过量饮酒和其他明确的损肝因素所致的肝细胞内脂肪沉积,包括从单纯的肝脂肪变性到非酒精性脂肪性肝炎(NASH)及其相关的肝硬化和肝细胞癌。NAFLD作为代谢综合征(MS)的组分之一,是MS在肝脏的主要表现形式[5],胰岛素抵抗则是其共同的发病机制。
NAFLD与糖代谢紊乱密切相关。在本研究中,NGT、IGR及NT2DM组的NAFLD检出率分别为16.3%、38.8%和64.9%,随血糖水平的增高,NAFLD的患病率显著升高(P<0.001);与以往研究中正常人群、IGR及糖尿病中的NAFLD患病率10%~24%[6]、33%~60%[6-7]和49%~75%[8-9]基本相符;而低于最近的报道[10]:NGT、IGR与NT2DM组中NAFLD的检出率分别为29.8%、87.1%及93.5%。考虑与样本含量以及选取的人群有关。胰岛素抵抗是糖代谢紊乱的主要发病机制,而肝脏是胰岛素抵抗的重要器官。本研究应用HOMA-IR评价胰岛素抵抗程度。随糖代谢紊乱的加重,HOMA-IR明显升高(P<0.01),提示胰岛素抵抗程度明显加重;同时,Logistic回归显示,HOMA-IR是NAFLD的主要危险因素。来自韩国、印度、日本及中国的研究表明,NAFLD的患者人群存在较高的HOMA-IR水平。进一步提示HOMA-IR是NAFLD的重要危险因子。
本研究显示,与NGT组相比,IGR组的TG、TC及LDL-c水平呈升高趋势,而HDL-c水平呈下降趋势,但无统计学意义;而与NGT及IGR组相比,NT2DM组的TG、TC及LDL-c水平则明显升高(P<0.01)。提示在糖尿病前期,虽血脂水平仍在正常范围,但较正常组明显升高,提示已发生了脂代谢紊乱。从IGR进展到糖尿病,脂代谢紊乱进一步加重。游离脂肪酸(FFA)可降低骨骼肌对葡萄糖的摄取能力及糖原的合成,促进了血糖的升高;同时“脂毒性”造成了胰岛B细胞的损伤及周围组织对胰岛素敏感性的下降,加重了胰岛素抵抗。Logistic回归显示,TG是NAFLD的重要危险因素。肝脏是FFA代谢的重要场所,FFA水平的升高造成了肝脏TG分泌的增加及脂肪组织脂解作用的增强,促进了NAFLD的发生发展。
NAFLD与中心性肥胖关系密切。BMI与腰围是评价肥胖及人体脂肪量的重要指标。本研究中,与NGT组相比,IGT与NT2DM组的BMI、腰围显著增加(P<0.00),且IGT与NT2DM间也存在明显的统计学差异(P<0.05)。Logistic回归显示,BMI是NAFLD的独立危险因素。肥胖可导致并加重胰岛素抵抗,导致周围组织对糖的摄取及利用能力降低,肝脏FFA水平升高,而内脏脂肪脂解作用增强,也增加了肝脏TG水平,促进了肝脏脂肪沉积。研究显示,胰岛素抵抗的严重程度与脂肪沉积部位有关,以躯干内脏性脂肪肥胖最为重要。以往体脂研究显示,与高加索人相比,亚洲人在较低的BMI时,肥胖的发生率是较高的。同样新加坡的研究显示,与高加索人相比,相同的体脂发生率,BMI要小3 kg/m2[11-12]。来自香港的中国人及亚洲印度人研究显示,在BMI为23 kg/m2时,代谢性危险因素的OR是升高的。
肝酶的升高与NAFLD密切相关,其中升高的γ-GGT是糖耐量恶化至IGT或糖尿病的独立危险因素,或许反映了肝脏脂肪变性和氧化应激[14]。本研究显示IGT与NT2DM组γ-GGT水平明显高于NGT 组(P<0.05),ALT、AST、ALP 呈升高趋势,但无统计学意义。据报道,NAFLD进展中,常伴有肝酶的改变,但仍有高达78%的患者肝酶是正常的[9,13]。因此,肝酶对NAFLD是不敏感的。ALT升高并不能预示NAFLD的发生。在成人研究中,NAFLD中仅有23.3%伴有ALT升高,而ALT升高的男性中仅有14.5%B超可见肝脏亮度增加[15]。在NAFLD患者,NASH及严重肝脏纤维化时,ALT水平一般在正常范围;而ALT水平在正常高限的一半以下时,42%可能有NASH,16%有严重的肝纤维化[16]。许多伴有严重纤维化和肝硬化的NAFLD患者,ALT水平是降低的,因为疾病到了终末阶段[17]。γ-GGT是肝脏损伤的敏感指标[18],脂肪在肝脏的过度沉积与升高的γ-GGT和IR密切相关。IR与γ-GGT关系密切,其机制或许是内脏肥胖导致的肝脏脂肪变性或肝脏 IR[19]及氧化应激[20]。最近报道[21]提出,γ-GGT 是NAFLD标记物,γ-GGT每增长10U,NAFLD的发生率就增长2%,高水平的γ-GGT使NAFLD发生的危险性增加了4倍。
总之,本研究结果显示,糖代谢紊乱与NAFLD密切相关,肥胖尤其是中心性肥胖、高甘油三酯血症、胰岛素抵抗在NAFLD的发生、发展中起到重要作用,而胰岛素抵抗则是糖代谢异常患者发生NAFLD的中心环节。
[1]Angulo P.Medical progress:nonalcoholic fatty liver disease[J].N Engl JMed,2002,346(16):1221
[2]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南[J].中华肝脏病杂志,2010,2(4):43
[3]Targher G,Marra F,MarchesiniG.Increased risk of cardiovascular disease in nonalcoholic fatty hver disease:causal effect or epiphenomenon[J].Diabetologia,2008,51(11):1947
[4]Sargin M,Uygur-Baymmicli O,Sargin H,et a1.Association of nonalcoholic fatty liver diseasewith insulin resistance:isOGTT in-dicated in nonalcoholic fatty liver disease[J].JClin Gastroenterol,2003,37(5):399
[5]Ratziu V,Bellentani S,Cortez-Pinto H,etal.A position statement on NAFLD/NASH based on the EASL 2009 special conference[J].J Hepatol,2010,53(2):372
[6]Mohan V,Farooq S,Deepa M,etal.Prevanceofnon-alcoholic fatty liver disease in urban south Indians in relation to dfferentgradesof glucose intolerance andmetabolic syndrome[J].Diabetes Res Clin Pract,2009,84(1):84
[7]王素玲,张力,刘燕玲,等.糖耐量异常合并非酒精性脂肪肝相关因素分析[J].河北医药,2008,30(6):61
[8]Fargher G,TessariR,Bertolini L,etal.Prevalence of nonalcoholic fatty liver disease and itsassociationwith cardiovascular diseaseamong type2 diabetic patients[J].DiabetesCare,2007,30(5):1212
[9]Browning JD,Szczepaniak L S,Dobbins R,etal.Prevalence of hepatic steatosis in an urban population in theUnited States:impact ofethnicity[J].Hepatology,2004,40(6):1387
[10]卞华,颜红梅,夏明峰,等.不同糖代谢人群肝酶与肝脏脂肪含量的关系[J].中华医学杂志,2010,90(48):3385
[11]Galassi A,Reynolds K,He J.Metabolic syndrome and risk of cardiovasculardisease:ameta-analysis[J].Am JMed,2006,119(10):812
[12]Zimmet P,Magliano D,Matsuzawa Y,etal.The metabolic syn drome:a global public health problem and a new definition[J].J Atheroscler Thromb,2005,12(6):295
[13]Haring R,WallaschofskiH,Nauck M,etal.Ultrasonographic hepatic steatosis increases prediction of mortality risk from elevated serum gamma-glutamyl transpeptidase levels[J].Hepatology,2009,50(5):1403
[14]Nannipieri M,Gonzales C,Baldi S,etal.Liver enzymes,the metabolic syndrome,and incident diabetes:the Mexico City diabetesstudy[J].DiabetesCare,2005,28(7):1757
[15]Salazar M R,Carbajal H A,Curciarello JO,etal.Alanin-aminotransferase:an earlymarker for insulin resistance[J].Medicina(B Aires),2007,67(2):125
[16]Wong VM,WongG L,Tsang SW,etal.Metabolic and histological features of non-alcoholic fatty liver disease patients with different serum alanine aminotransferase levels[J].Aliment Pharmacol Ther,2009,29(4):387
[17]Wong VW,Hui A Y,Tsang SW,etal.Metabolic and adipokine profile of Chinese patientswith nonalcoholic fatty liver disease[J].Clin GastroenterolHepatol,2006,4(9):1154
[18]Lee D H,Blomhoff R,Jacobs D R Jr.Is serum gamma glutamyltransferaseamarkerofoxidative stress[J].Free Radic Res,2004,38(6):535
[19]AlbertiKG,ZimmetP,Shaw J.IDFEpidemiology Task Force Consensus Group.Themetabolic syndrome--a new worldwide definition[J].Lancet,2005,366(9491):1059
[20]TargherG,BertoliniL,Scala L,etal.Decreased plasmaadiponectin concentrations are closely associated with nonalcoholic hepatic steatosis in obese individuals[J].Clin Endocrinol(Oxf),2004,61(6):700
[21]Banderas D Z,Eacobedo J,Gonzalez E,etal.γ-Glutamyl transferase:amarker of nonalcoholic fatty liver disease in patientswith themetabolic syndrome[J].Eur JGastroenterol Hepatol,2012,24(7):805
