蛋白激酶CK2抑制剂TBB对甲状腺鳞癌细胞株SW579CK2β和Akt表达的影响
2012-10-10王翠瑶肖建英
刘 超,刘 洋,赵 颂,王翠瑶,肖建英
(辽宁医学院生物化学与分子生物学教研室,辽宁 锦州 121001)
蛋白激酶2(CK2)是一种生存性激酶,全酶以异构四聚体形式存在,由2个催化亚基(ɑ或ɑ′)和2个调节亚基(β)构成,作为底物和与其相互作用蛋白的接头蛋白发挥重要作用。CK2持续激活并普遍存在于肿瘤组织中,因此被认为是药物治疗的潜在靶点[1]。有许多证据支持CK2的抗凋亡作用[2],其作用机制是多方面的,因为CK2有众多底物。此外,CK2的许多靶蛋白参与细胞的生存和死亡,CK2和一些其他的生存途径密切相关,尤其是与PI3K/PDK1/Akt途径密不可分[3]。Akt,又叫蛋白激酶B(protein kinase B,PKB),是调节细胞死亡、增生、生长和代谢的重要蛋白激酶,是PI3K的重要下游分子,其活性依赖于PDK1 和mTORC2分别对Thr308 和Ser473的磷酸化,只有这2个关键性亚基联合磷酸化才能使Akt完全激活[4-5]。高选择性膜通透性CK2抑制剂四溴苯三唑(4,5,6,7-tetrabromobenzotriazole,TBB)的应用为认识CK2激酶的特殊细胞功能提供了一个很好的工具。但TBB抗肿瘤的具体机制尚不清楚,尤其TBB对甲状腺癌的作用机制知之甚少。本研究旨在探讨TBB对甲状腺鳞癌SW579细胞株增殖及CK2β与Akt表达的影响,进而探讨TBB的抗癌机制,为TBB的临床开发应用提供实验依据。
1 材料与方法
1.1 主要试剂与仪器TBB、L15培养液( Sigma公司);RNA PCR Kit (AMV)Ver.3.0试剂盒 (Takara 公司);CK2β(兔抗人多克隆抗体)、β-actin抗体(兔抗人多克隆抗体)(Santacruz公司)、Akt(兔抗人多克隆抗体)、Phospho-Akt (Ser473) 抗体、Phospho-Akt (Thr308) 抗体(Cell Signaling Technology),Western细胞裂解液、BCA蛋白浓度测定试剂盒(碧云天生物技术公司);HRP标记的山羊抗兔IgG (北京中杉金桥生物技术有限公司);ECL化学发光试剂盒(Piece Biotechnology公司);预染蛋白Marker(MBI公司);CK2活性测定试剂盒(Upstate公司);[γ-32P]购自北京福瑞生物工程公司; BB16UV CO2培养箱(Heraeus);Sunrise自动酶标检测仪(Tecan公司);PCR扩增仪(Eppendorf公司);凝胶自动成像仪GDS8000、电泳仪、电泳槽(Bio-Rad公司)。
1.2 细胞培养及实验分组甲状腺鳞癌细胞株SW579购自上海生命科学院细胞和生物化学研究所。培养基为L15,含10%的胎牛血清、100 U·mL-1青霉素、100 mg·L-1的链霉素,在饱和湿度、37℃、无CO2孵箱中培养,当细胞汇合至培养瓶底面积80% 左右时进行传代培养。当细胞处于对数生长期时,以1×105mL-1浓度接种于25 cm2的培养瓶中或96孔培养板中。24 h后待细胞贴壁后给药,TBB 组终浓度为25 μmol·L-1,Wortmannin组终浓度为100 nmol·L-1,设空白对照组及DMSO组,DMSO组加入5 μL DMSO [DMSO浓度小于0.1% (V /V),此浓度对细胞生长无影响]。
1.3 MTT比色法测定细胞增殖抑制率取对数生长期的细胞SW579,胰酶消化,吹打为单细胞悬液,以每孔1×105mL-1细胞接种于96孔培养板中,每孔200 μL,培养细胞24 h后加入25 μmol·L-1TBB和100 nmol·L-1Wortmannin,每组6个复孔,DMSO组加入等体积DMSO,并设空白对照。作用24 h后,每孔加入MTT溶液(5 g·L-1) 20 μL,37℃继续孵育4 h,终止培养,弃去上清,每孔加入150 μL DMSO,振荡10 min,选择570 nm波长,酶联免疫检测仪测定各孔吸光度(A)值,并计算各组细胞增殖抑制率。细胞增殖抑制率(%)=(A对照组-A实验组)/A对照组×100%。
1.4 RT-PCR方法检测CK2β和Akt的mRNA表达水平采用Trizol一步法提取细胞总RNA,1%琼脂糖凝胶电泳检测RNA的完整性,于核酸蛋白测定仪测定RNA含量,当A260/A280比值达1.9~2.0时可用于逆转录反应。用TaKaRa RNA PCR(AMV)Ver3.0试剂盒,按操作步骤进行。反转录条件42℃、30 min;99℃、5 min;5℃、5 min。PCR引物序列:CK2β,5′-AGCCGAGATGCTTTATGGA-3′,5′- GTGTCTTGATGACTTGGG-TG-3′,229 bp;Akt,5′-GGACAACCGCCATCCAGACT-3′,5′- GCCAGGGACACCTCCATCT-C-3′,121 bp;β-actin,5′-TGACGGGGTCACCCACACTGTGCCCATCTA-3′,5′-CTAGAAGC-ATTTGCGGTGGACGATGGAGGG-3′,661 bp。循环条件:94℃预变性5 min;94℃、30 s;CK2β基因52.6℃、Akt基因59.3℃、30 s;72℃、50 s;30个循环;72℃终延伸10 min。取PCR产物10 μL 进行琼脂糖凝胶电泳并拍照,应用EDAS290凝胶成像分析系统进行灰度测量,基因mRNA表达水平以每一样品与其内参β-actin灰度比值表示。
1.5 Western blotting方法检测CK2β、Akt、Akt-pS473和Akt -pT308的蛋白表达收集对照组及处理组细胞,用预冷的PBS洗涤2次,1 000 r·min-1离心5 min,弃上清。每瓶细胞加裂解液80 μL,冰上放置30 min,超声破碎20 s/次,3~4次。12 000 r·min-1离心20 min取上清,BCA蛋白浓度测定试剂盒测定蛋白含量。取50 μg总蛋白上样,10%SDS-PAGE电泳分离,然后将蛋白转至硝酸纤维素膜上,用含5%BSA的TBS(pH 7.4)将滤膜于室温摇动2 h进行封闭,封闭后的滤膜再分别与CK2β和Akt抗体(稀释比为1∶500)、Akt-pS473、Akt-pT308(稀释比为1∶ 200)、β-actin(稀释比为1∶1 000) 4℃温育过夜。经TTBS洗涤后,HRP偶联的IgG作为二抗(稀释比为1∶5 000) 室温温育2 h,洗膜后,使用ECL发光法显色。内参采用β-actin。计算机软件Image J处理,进行密度分析,计算灰度值。
1.6 蛋白激酶CK2活性的测定收集加入上述处理的SW579细胞,用加蛋白酶体抑制剂cocktail的PBS冲洗,超声裂解,12 000 r·min-1离心5 min,收集上清测蛋白浓度。每个反应取等量的蛋白然后按照Casein Kinase 2 Assay Kit说明书测定CK2的活性。加入10 μL的收集液(20 mmol·L-13-吗啉基丙磺酸,pH 7.2;25 mmol·L-1甘油磷酸盐;5 mmol·L-1乙二醇四乙酸酯;1 mmol·L-1正矾酸钠,1 mmol·L-1二硫苏糖醇),加入 10 μL特异性多肽合成底物(RRRDDDSDDD) (终浓度200 μmol·L-1)。10 μL PKA抑制剂500 μmol·L-1ATP及100 mCi·L-1[γ-32P] ATP后开始反应。每1个反应做3个平行管。样品在30℃水浴反应30 min,然后加入20 μL 40%三氯乙酸终止反应。将样品滴在Whatman P81 强阳离子交换滤纸上,将滤纸放入0.75% 磷酸溶液中反复冲洗3 次以降低反应背景。再将滤纸放入液闪瓶中,并加入10 mL蒸馏水,然后用 LS3801Beckman 液闪计数分析仪测定cpm值。
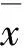
2 结 果
2.1 各组细胞增殖抑制率的变化TBB组细胞增殖抑制率(28.08%±9.743%)与Wortmannin组(24.54%±7.824%)比较差异无统计学意义(P>0.05);但药物处理组与对照组(0%)比较差异有统计学意义(P<0.01),DMSO组(4.101%±2.408%)与对照组比较差异无统计学意义(P>0.05)。
2.2 CK2β和Akt mRNA 表达水平PCR产物琼脂糖凝胶电泳灰度测量分析表明:对照组CK2β和Akt表达量较高。与对照组比较,TBB组CK2β的mRNA 表达水平显著降低(P<0.01),Akt的mRNA 表达水平无明显变化;Wortmannin组Akt的mRNA 表达水平显著降低,CK2β的mRNA 表达水平无明显变化。见表1和图1。

表1 CK2β和Akt的mRNA表达水平

图1 SW579细胞中 CK2β(A)和Akt(B)的mRNA表达水平电泳图
2.3 蛋白激酶CK2的活性与对照组[(5 118.0±126.6) cpm]和DMSO组[(5 024.0±271.7) cpm]比较,TBB组CK2活性[(2 453.0±87.2) cpm]明显降低(P<0.01),而Wortmannin组内源性CK2活性[(5 060.0±164.4) cpm]无明显变化(P>0.05)。
2.4 CK2β、Akt、Akt -pS473和Akt-pT308的蛋白表达水平与对照组比较,Wortmannin组内源性CK2β的表达无明显变化,TBB组CK2β的表达明显降低。同时Akt Thr308和Ser473磷酸化状态受到抑制,总Akt的水平未受处理因素的影响。见表2和图2。

表2 SW579细胞中CK2β、Akt、Akt -pS473和Akt-pT308蛋白的表达水平

图2 SW579细胞中CK2β、Akt、Akt-pS473和Akt-pT308蛋白表达的Western blotting检测结果
3 讨 论
甲状腺癌是内分泌系统最常见的恶性肿瘤,在人群中的发病率为4%~7%。虽然近几十年来传统的治疗方式如手术、 放疗和化疗等有了很大的改进,但由此带来的严重副作用使以上治疗方式受到极大限制[6],因此寻找一种潜在、稳定、 选择性的抗甲状腺癌药物成为当前研究甲状腺癌治疗的热点。探讨CK2多功能性的研究受到限制,是由于其持续活性且抑制细胞内其他激酶的活性等特点,应用比较多的是激酶失活型的突变体和RNAi技术。这些技术由于细胞内CK2蛋白有较长半衰期,细胞内定位和内源性CK2的高表达而受到阻滞[7]。Wang等[7]和 Seeber等[8]报道:RNAi 和反义核酸有时是无效的,需要持续地处理细胞以达到有效敲除CK2的目的。这些局限性使药理学方法成为最有潜力的工具去研究CK2细胞水平功能,并解释开发特殊的细胞通透性CK2抑制剂的必要性[8]。TBB为一种膜通透的高选择性CK2抑制剂,已证明其在鉴定CK2作为细胞内靶点和揭示CK2在肿瘤细胞凋亡过程中发挥重要作用[1,9]。目前TBB在甲状腺癌中的作用尚不清楚。
本实验结果表明:Wortmannin对内源性CK2的活性完全不起作用,TBB显著地抑制CK2的活性和蛋白表达进而诱导细胞凋亡,而CK2的mRNA水平也下降,说明TBB对CK2在转录和翻译及翻译后修饰水平都可能存在调节作用。25 μmol·L-1TBB对Akt的mRNA和蛋白水平无影响,但下调CK2的表达,Akt 的Thr308磷酸化状态明显降低,尽管其不是CK2的直接作用靶点[10],这与本实验中TBB作用于SW579后引起Akt Thr308磷酸化状态的抑制结果相一致。然而Ser473的磷酸化状态是否受到影响与细胞内CK2的活性状态有关系,不同的实验室报道[11-12]不尽相同,同时也与不同的细胞株和遗传背景有关。本实验结果说明Akt活性的下降是由底物水平磷酸化降低引起的。CK2有助于保持Ser473和Thr308的磷酸化水平,是Akt活性调节的重要机制。Di Maira等[10]报道:CK2可直接磷酸化Akt 129位Ser残基,促使Akt进一步激活。CK2是否通过磷酸化Akt 129位Ser残基后进一步磷酸化Ser473和Thr308,进而维持Akt的活性状态,以及TBB对甲状腺鳞癌SW579细胞株的抑制作用是否通过调控 PI3K/AKT信号通路来实现,还有待进一步研究。
[参考文献]
[1]Duncan JS,Litchfield DW.Too much of a good thing: the role of protein kinase CK2 in tumorigenesis and prospects for therapeutic inhibition of CK2 [J].Biochim Biophys Acta,2008,1784(1):33-47.
[2]Ahmad KA,Wang G,Unger G,et al.Protein kinase CK2-a key suppressor of apoptosis [J].Adv Enzyme Regul,2008,48(3):179-187.
[3]Guerra B.Protein kinase CK2 subunits are positive regulators of AKT kinase [J].Int J Oncol,2006,28(3):685-693.
[4]Manning BD,Cantley LC.AKT/PKB signaling: navigating downstream [J].Cell,2007,129(7):1261-1274.
[5]Carnero A.The PKB/AKT pathway in cancer [J].Curr Pharm Des,2010,16(1):34-44.
[6]Mitsiades CS,Poulaki V,Fanourakis G,et al.Fas signaling in thyroid carcinomas is diverted from apoptosis to proliferation [J].Clin Cancer Res,2006,12(12):3705-3712.
[7]Wang G,Unger G,Ahmad KA,et al.Downregulation of CK2 induces apoptosis in cancer cells-a potential approach to cancer therapy [J].Mol Cell Biochem,2005,274(12):77-84.
[8]Seeber S,Issinger OG,Holm T,et al.Validation of protein kinase CK2 as oncological target [J].Apoptosis,2005,10(4):875-885.
[9]Sarno S,Ruzzene M,Frascella P,et al.Development and exploitation of CK2 inhibitors [J].Mol Cell Biochem,2005,274(1-2):69-76.
[10]Di Maira G,Salvi M,Arrigoni G,et al.Protein kinase CK2 phosphorylates and upregulates Akt/PKB [J].Cell Death Differ,2005,12(6):668-677.
[11]Chao CC,Ma YL,Lee EH.Protein kinase CK2 impairs spatial memory formation through differential cross talk with PI-3 kinase signaling: activation of Akt and inactivation of SGK1 [J].J Neurosci,2007,27(23):6243-6248.
[12]Di Maira G,Brustolon F,Pinna LA,et al.Dephosphorylation and inactivation of Akt/PKB is counteracted by protein kinase CK2 in HEK 293T cells [J].Cell Mol Life Sci,2009,66(20):3363-3373.
