几种常见肠道致病菌多重PCR检测的效果评价
2012-10-10刘金华史艳宇马路遥魏春艳邵丽筠王海龙
刘金华,史艳宇,马路遥,魏春艳,邵丽筠,王海龙
(1.吉林出入境检验检疫局,吉林 长春 130062;2.吉林省产品质量监督检验院,吉林 长春 130022;3.吉林大学药学院生物医学工程教研室,吉林 长春 130021;4.内蒙古自治区锡林郭勒盟东乌珠穆沁旗公安局,内蒙古 乌里雅斯太 026300;5.吉林大学再生医学科学研究所,吉林 长春 130021)
近年来全球有关食品安全的恶性事件频发,食源性致病菌成为威胁食品安全的主要元凶。其中金黄色葡萄球菌、单核细胞增生李斯特菌、志贺氏菌、肠出血性大肠杆菌O157∶H7、空肠弯曲杆菌、副溶血弧菌、沙门氏菌(伤寒沙门菌、肠炎沙门菌)、产气荚膜梭菌及变形杆菌等引起的食源性疾病居于世界前列[1]。传统的致病菌检测均采用生理生化、血清型水平的方法,试验周期长,耗时费力,且灵敏度受限,因此有必要建立一种快速、简便、灵敏度高的检测手段[2-3]。多重PCR检测方法因其能够一次对多种致病菌同时检测,而成为研究热点[4-6]。本研究拟建立一种多重PCR检测方法能够同时检测出单核细胞增生李斯特菌、大肠杆菌O157、副溶血性弧菌及普通变形杆菌4种肠道致病菌,旨在为临床疾病诊断、食品安全检测、流行病学调控等工作提供良好的有效检测方法。
1 材料与方法
1.1 菌种及其来源
副溶血性弧菌(Vibiroparahaemolyticus,ATCC17802)、普通变形杆菌(Proteusbacillusvulgaris,ATCC33420)、蜡样芽孢杆菌(Bacilluscereus,ATCC11778)购于北京兰博瑞公司。单核细胞增生李斯特菌(Listeriamonocytogenes,ATCC19111)、伤寒沙门氏菌(Salmonellatyphi,ATCC13311)、金黄色葡萄球菌(Staphylococcusaureus)(分离株)、肠炎沙门氏菌(Salmonellaenteritidis,ATCC13076)、志贺氏菌(Shigella)(分离株)、空肠弯曲菌(Campylobacterjejuni,ATCC33291)及大肠杆菌O157(EscherichiacoliO157) 保存于吉林出入境检验检疫局微生物检测实验室。
1.2 主要试剂与仪器
DNA 提取试剂盒(Easy PureTMGenomic DNA Extraction Kit、PCR 试剂(TransStart Taq DNA Polymerase 及100 bp DNA Ladder Marker)均为北京全式金生物有限公司产品;营养琼脂(nutrient agar,NA)培养基、胰酪胨大豆琼脂培养基(tryptose soya agar,TSA) 血平板、溶菌肉汤(luria-bertani,LB) 液体培养基和革兰阴性增菌液均为北京陆桥技术有限责任公司成品配制。
恒温培养箱(德国Binder公司)、恒温水浴箱(美国SHELLAB公司),离心机3K30型(德国Sigma公司)、梯度PCR 仪ProS型(德国Eppendorf公司)、PowerPac Universal 164-5070 电泳仪(美国伯乐公司)、EC紫外成像系统(美国Alpha公司)。
1.3 实验方法
1.3.1 菌株培养 大肠杆菌O157、变形杆菌用营养琼脂培养基37℃过夜培养,然后挑取2~4个菌落接种到LB 液体培养基,在培养箱经过37℃培养24 h。单核细胞增生李斯特菌用TSA 血平板37℃过夜培养,取2~4个菌落接种到LB液体培养基,37℃培养24 h。副溶血性弧菌用氯化钠蔗糖平板37℃培养24 h,然后挑取2~4个菌落接种到氯化钠结晶紫增菌液,37℃增菌8~16 h。
1.3.2 DNA 的提取 细菌DNA 的提取按照Easy PureTMGenomic DNA Extraction Kit使用说明中的操作规程进行提取。
1.3.3 引物的设计和合成 根据GenBank中上述4种细菌的基因序列,通过序列比对,筛选出4种微生物的特异基因作为靶序列,并根据靶序列设计相应的引物。引物的设计使用Primer express 2.0软件进行。使用 BLAST 程序,通过 GenBank,对各引物及扩增产物同源性进行比对,以保证引物与靶基因结合的高度特异性。引物由上海捷瑞生物有限公司合成。序列见表1。
1.3.4 单重PCR扩增 先对上述4种细菌进行单独扩增,反应体系:模板DNA 1 μL(20 ng·L-1),上、下游引物各1 μL(10 μmol·L-1),10×TransStart Taq Buffer 2.5 μL,2.5 mmol·L-1dNTPs 4 μL,TransStart Taq DNA Polymerase 0.5 μL,ddH2O 补足 总体积至25 μL。PCR 扩增条件:95℃预变性3 min;95℃变性 30 s,62℃退火 30 s,72℃延伸 30 s,34个循环;72℃ 延伸10 min。
1.3.5 多重PCR扩增体系的建立及退火温度的优化 多重PCR的反应体系为50 μL 反应体系,其中10×buffer 5 μL,Taq酶1.0 μL、dNTP 7.0 μL、Mg2+0.3 μL、上下游引物分别为1.0 μL时,模板:各加3 μL,ddH2O补足到50 μL。多重 PCR 扩增条件:95℃预变性3 min;95℃变性30 s,退火30 s,72℃延伸30 s,35 个循环;72℃延伸10 min。其中退火温度分别为58℃、59℃、60℃、61℃、62℃、63℃、64℃、65℃,根据电泳条带的亮度确定出最佳退火温度。

表1 多重PCR引物
1.3.6 多重PCR反应的特异性和灵敏性检测 多重PCR特异性检测:分别提取志贺菌、金黄色葡萄球菌、单核细胞增生李斯特菌、沙门氏菌、副溶血性弧菌、空肠弯曲菌、产气荚膜梭菌、普通变形杆菌、蜡样芽孢杆菌及大肠杆菌O157的基因组DNA,加入同一反应体系,同时加入本研究中的4种细菌对应的特异性引物进行多重 PCR 扩增,以检测多重 PCR 的特异性。多重PCR灵敏性检测:4种菌经过37℃培养24 h后,取菌悬液依次10倍进行梯度稀释,然后按照1.3.2 的方法提取DNA,按照优化后的多重PCR体系进行反应;同时,取稀释后的各浓度菌悬液各1 mL,涂在LA平面培养板上进行培养,进行菌落计数。多重PCR反应能够检出的最小DNA量所对应的菌浓度即为该体系的灵敏度。
1.3.7 模拟果汁中细菌的检测 购买市售的多种不同品牌果汁,取经普通生化培养鉴定大肠杆菌O157、副溶血性弧菌、普通变形杆菌及单核细胞增生李斯特菌均为阴性的果汁作为添加的样品。取各稀释的菌悬液随机混合,加入到阴性果汁中混匀作为模拟样本。过夜培养,取模拟样本各1 mL离心后取沉淀物,按1.3.2试剂盒提取核酸,进行多重PCR检测。
2 结 果
2.1 单重PCR反应的结果
对于变形杆菌ureR基因的引物进行PCR,扩增出大小约为522 bp 的特异性片段;用编码单核细胞增生李斯特菌hlyA基因的引物进行 PCR,扩增出大小约为 155 bp 的特异性片段;用编码大肠杆菌O157的hlyA基因的引物进行 PCR,扩增出大小约为 366 bp 的特异性片段;用编码副溶血弧菌氨基酸脱氢酶基因引物进行 PCR,扩增出大小约为199 bp的特异性片段。
2.2 多重PCR反应退火温度的优化
用梯度PCR仪依次设定退火温度为58℃、59℃、60℃、61℃、62℃、63℃、64℃、65℃,PCR产物的电泳结果显示:64℃对应的条带最亮也最清晰,说明64℃为最佳退火温度。见图1。
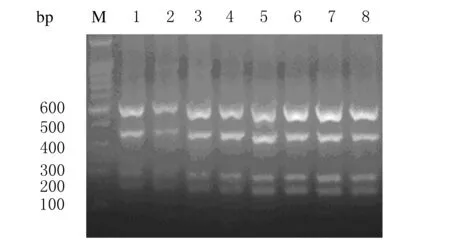
图1 多重PCR梯度退火温度电泳图
2.3 多重PCR特异性的检测结果
同时在一个反应体系中加入10种菌,然后加入本次研究的单核细胞增生李斯特菌、大肠杆菌O157、变形杆菌和副溶血弧菌相应的特异性引物。结果表明:只有该4种菌扩增出特异性条带,其他菌PCR结果均为阴性。
2.4 多重PCR灵敏度的检测结果
对菌液进行梯度稀释,然后进行多重PCR。结果显示:第2条泳带即稀释成107倍时能够清晰辨别出4条细菌的特异性条带,所对应的4种细菌的菌落计数数量级为103CFU·mL-1,即本研究中的4重PCR反应体系的灵敏度。见图2。
2.5 应用该多重PCR体系检测人工染菌果汁
对模拟果汁样品的多重PCR检测结果表明:该多重PCR体系可以成功扩增出相应的目的基因片段,从而识别出随机接种的任意3种菌。见图3。

图2 多重PCR灵敏度的检测结果
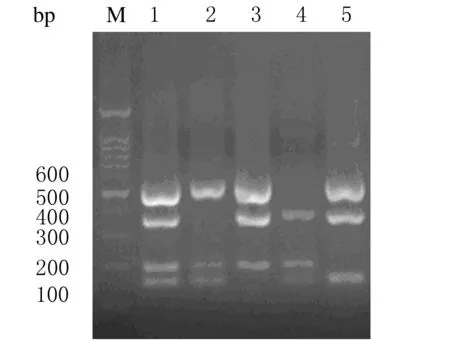
图3 多重PCR检测果汁中的细菌
3 讨 论
多重PCR反应是在同一个反应体系中加入几种目的基因的引物,通过一次反应实现对多种目的基因的同时扩增[7]。由于在一个体系中不同的基因组之间、不同引物之间均会存在相互影响,所以必须对多重PCR体系进行重新优化,主要包括反应中各组分的浓度[8-10]及退火温度[8-11]。本实验通过正交设计的方法快速、准确地确定了最合适的各组分浓度,并对退火温度进行了摸索。本实验借助梯度PCR仪,一次性快速确定了最佳的退火温度。此外PCR反应产物的特异性取决于引物和模板的匹配程度,本研究中一次性加入多种不同菌的引物,分别扩增出相应菌的基因片段,实现了一次PCR同时检测不同病原菌的目的。本实验对灵敏度的检测结果与徐晓可等[12]人的多重PCR灵敏度的检测结果相近,高于李盛丰等[13]多重PCR灵敏度检测结果。可能是由于使用试剂的扩增效果有差异;所选的菌种不同,彼此之间的抑制作用强弱亦不同;体系中各组分的比例、反应循环数均对多重PCR的扩增效果有影响。多重PCR与传统的通过细菌培养鉴定菌的方法相比,具有快速、高效、准确、特异性强的优点;与普通PCR相比具有高通量的优点,多重PCR可节省人力、物力,有助于提高病原菌的检验效率。
[参考文献]
[1]汪学荣,彭祥伟.PCR技术检测肉中食源性病原菌的研究进展[J].肉类工业,2010,29(7):52-55.
[2]凌 霞,张敬平.食源性致病菌多重PCR快速检测方法建立与应用[J].微生物学杂志,2010,30(4):39-43.
[3]Mekonnen K,Divind E,Ruth-Anne S,et al.A multiplex polymerase chain reaction assay for genus group and species-specific detection of mycobacteria [J].Diagn Microbiol Infect Dis,2004,49(2):99-104.
[4]Ye RW,Wang T,Bedzyk L,et al.Applications of DNA microarrays in microbial systems[J].J Microbiol Methods,2001,47(3):257-272.
[5]Call DR,Borucki MK,Loge F.Detection of bacterial pathogens in environmental samples using DNA microarrays[J].J Microbiol Methods,2003,53(2):235-243.
[6]Kostrzynska M,Bachand A.Application of DNA microarray technology for detection,identification,and characterization of food-borne pathogens [J].Canadian J Microbiol,2006,52(1):1-8.
[7]Panicker G,Call DR,Krug MJ,et al.Detection of pathogenic Vibrio spp.in shell fish by using multiplex PCR and DNA microarrays [J].Appl Environ Microbiol,2004,70(12):7436-7444.
[8]王大勇,方振东,谢朝新,等.食源性致病菌快速检测技术研究进展[J].微生物学杂志,2009,29(5):67-71.
[9]郝玉芹,孙皆宜,李 艾,等.正交优化多重 PCR 反应体系检测 3种食源性致病菌的研究[J].安徽农业科学,2010,38(2):602-605.
[10]代 娟,李玉峰,杨 潇.肠道致病菌多重 PCR 快速检测体系研究[J].中国公共卫生,2007,23( 2):219 -200.
[11]王德文,王铁兵.梯度PCR在基因扩增中的应用[J].中国误诊学杂志,2008,8(11):2527-2529.
[12]徐晓可,吴清平.肉类中大肠杆菌 O157∶H7多重PCR检测方法的建立[J].微生物学通报,2008,35(4):619-622.
[13]李盛丰,赵 姣.单增李斯特菌不同PCR快速检测方法比较[J].中国公共卫生,2008,24(8):1021-1023.
