靶向Ku70基因siRNA对人肺腺癌细胞顺铂耐药性的逆转作用
2012-10-10李亚荣苏振中
黎 萍,张 捷,李亚荣,王 珂,苏振中
(1.吉林大学第二医院呼吸内科,吉林 长春 130041;2.吉林大学第二医院血液肿瘤科,吉林 长春 130041)
肺癌中80%~85%为非小细胞肺癌(non-small cell lung cancer,NSCLC),化疗是NSCLC临床治疗的主要方法之一,以铂类为基础的联合化疗是NSCLC的标准化疗方案,而肺癌内在性或获得性耐药严重影响顺铂的临床化疗效果[1]。肺癌顺铂耐药机制复杂,与P-糖蛋白、多药耐药相关蛋白、谷胱甘肽S-转移酶Ⅱ等多药耐药因子表达呈正相关[2];与血清p53抗体及谷胱甘肽S-转移酶阳性表达呈负相关[3]。近年研究[4-5]表明:DNA修复相关分子以及凋亡信号途径的异常是肺癌顺铂耐药的重要机制之一。Ku70是DNA结合蛋白,是DNA磷酸蛋白激酶的重要成分,参与DNA转录调节,可独立参与细胞DNA修复并具有抗凋亡作用[6]。研究[7]表明:Ku70的表达水平与头颈部肿瘤放、化疗后复发率呈正相关,此外Ku70与甲状腺癌[8]、宫颈癌[9]放疗敏感性有关。本研究比较Ku70在人肺腺癌细胞系亲代(A549)与人肺腺癌耐顺铂细胞系(A549/DDP)的表达水平,观察siRNA靶向沉默Ku70后A549/DDP细胞在顺铂作用下的增殖、凋亡情况,特别是耐药性的变化,以期为肺癌顺铂耐药提供潜在的分子标志物,为临床逆转肺癌顺铂耐药、提高化疗疗效寻找有效的分子靶点奠定基础。
1 材料与方法
1.1 细胞与主要试剂人肺腺癌细胞系亲代(A549)及其耐顺铂细胞系(A549/DDP)均购自第三军医大学新桥医院呼吸病研究所。dNTP、MMV逆转录酶购自Promega公司;Ex-Taq、DL-2000 DNA marker为Takara公司产品;MTT、顺铂购自美国Sigma公司;Lipofectin 2000及 Trizol为美国Invitrogen公司产品;胰酶、IMDM培养基为美国Hyclone公司产品;人Ku70抗体、辣根过氧化物酶(HRP)标记的羊抗兔多克隆抗体购自Santa-cruz公司;Annexin V-FITC细胞凋亡检测试剂盒及Caspase-3 分光光度法检测试剂盒购自南京凯基公司。PAGE级引物由宝生物(大连)工程有限公司合成;siRNA序列由Ambion公司合成。Ku70siRNA序列为正义链5′-GAGUGAAGAUGAGUUGACATT-3′,反义链5′-UGUCAACUCAUCUUCACUCTG-3′;无意义的对照序列(Scramble)为:正义链5′-GGATTAAGTTCGGATAGT-3′,反义链5′-GCCTCTTAT-TCTCGACATCTA-3′。
1.2 细胞培养及分组A549及A549/DDP均在含10%新生牛血清的RPMI-1640培养液中于37℃、5% CO2的孵箱内培养,以0.25%胰酶消化传代。A549/DDP依次以半量(0.5 mg·L-1)、全量(1 mg·L-1)顺铂培养液培养各1周。实验分为空白组(A549/DDP细胞)、阴性对照组[转染非特异性siRNA(si-Scramble)组]和实验组[转染靶向Ku70基因的siRNA(si-Ku70)]。
1.3 A549/DDP细胞转染siRNA细胞按5×105/孔的密度接种于6孔板中,待细胞融合至70%~90%时进行转染。转染前,将待转染细胞的培养液更换为无血清的培养液。按照脂质体Lipofectamine 2000转染试剂盒操作说明书进行转染。转染4~6 h后,将细胞培养液换为含10%胎牛血清的培养液。加药组在转染后48 h加6 mg·L-1顺铂。各组均在转染后72 h收集细胞。
1.4 RT-PCR检测Ku70 mRNA的表达采用Trizol法提取细胞总RNA,逆转录按照RT-PCR试剂盒说明书进行,PCR反应体系中加入引物分别为:Ku70基因引物(产物为371 bp),上游序列为5′-CTGTGCCAACCTCTTTAGTGATG-3′,下游序列为5′-TGGTTCATTTGTTTCCCGATA-3′;GAPDH基因引物(产物为500 bp),上游序列为5′-GATTGTTGCCATCAACGACC-3′,下游序列为5′-GTGCAGGATGCATTGCTGAC-3′。PCR反应条件:95℃预变性90 s;94℃、30 s,54℃、30 s,72℃、30 s,30个循环;72℃延伸10 min。PCR反应产物经1%琼脂糖凝胶电泳,以GAPDH为内参,计算各目的基因的相对密度值。实验重复3次,计算光密度(A)值的均值与标准差;以目的基因的相对A值间接表示基因的mRNA表达水平。
1.5 Western Blotting法检测Ku70蛋白的表达分别提取各组细胞的总蛋白,蛋白定量后,取30 μg蛋白进行SDS-PAGE凝胶电泳,转膜,封闭,加入抗人Ku70多克隆抗体杂交,再加入HRP-偶联二抗,按ECL试剂盒说明书发光、曝光。以GAPDH为内参照,计算目的蛋白的相对A值。实验重复3次,计算A值的均值与标准差。以目的蛋白的相对A值间接表示蛋白含量。
1.6 MTT法检测细胞生存率取对数生长期A549/DDP细胞,以2×104/孔接种于96孔板。各组细胞加入50.000 0、25.000 0、12.500 0、6.250 0、3.125 0、1.562 5及0 mg·L-1浓度梯度的顺铂,每个浓度设4个复孔;培养24 h后行MTT法检测,用酶标仪测570nm波长的A值,计算细胞生存率。细胞生存率(%)=实验组A值/阴性对照组A值×100%。采用线性回归计算顺铂对各组细胞的半数抑制浓度(IC50)。
1.7 分光光度法检测各组细胞的Caspase-3活性采用Caspase-3活性分光光度法检测试剂盒,取50 μL 含100 μg 蛋白的细胞裂解上清,按照试剂盒说明书进行操作,加入5 μL Caspase-3底物并于37℃ 避光孵育4 h后,用酶标仪测定405 nm处的A值。通过计算实验组的A值/阴性对照A值的倍数来确定Caspase-3活化程度。
1.8 流式细胞术检测细胞的凋亡率取1×106个细胞,加入500 μL的Binding Buffer悬浮细胞;加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide,混匀;室温、避光反应15 min;在1 h内行流式细胞仪检测分析各组细胞的凋亡率。仪器参数为:激发波长(Ex)=488 mn,发射波长(Em)=530 nm。
2 结 果
2.1 Ku70在A549/DDP细胞系与亲代A549细胞系中的表达差异与亲代A549细胞系Ku70 mRNA表达水平(0.752±0.028)比较,A549/DDP细胞系Ku70 mRNA表达水平(0.987±0.019)明显增高(P<0.01)。见图1A。与亲代A549细胞系Ku70蛋白表达水平(1.042±0.058)比较,A549/DDP细胞系Ku70蛋白表达水平(1.287±0.031)明显增高(P<0.01)。见图1B。

图1 Ku70在A549及A549/DDP细胞的mRNA(A)及蛋白(B)表达水平
2.2 转染siRNA后各组细胞Ku70的表达水平实验组(si-Ku70)Ku70 mRNA表达水平(0.985±0.018)明显高于空白对照组(0.885±0.076)及阴性对照组(0.385±0.058)(P<0.01)。见图2A。以GAPDH做内参,实验组Ku70蛋白表达水平(0.389±0.011)低于空白对照组(1.256±0.078)与阴性对照组(1.291±0.047)(P<0.01)。见图2B。
2.3 转染后各组细胞的生存率及IC50在不同浓度顺铂作用24 h后,实验组细胞的生存率明显低于阴性对照组与空白对照组。见图3。根据此结果,计算各组IC50值。实验组IC50为(8.73±0.62) mg·L-1,较空白对照组[(37.21±4.17) mg·L-1]和阴性对照组[(37.07±3.81) mg·L-1]显著降低(P<0.01)。
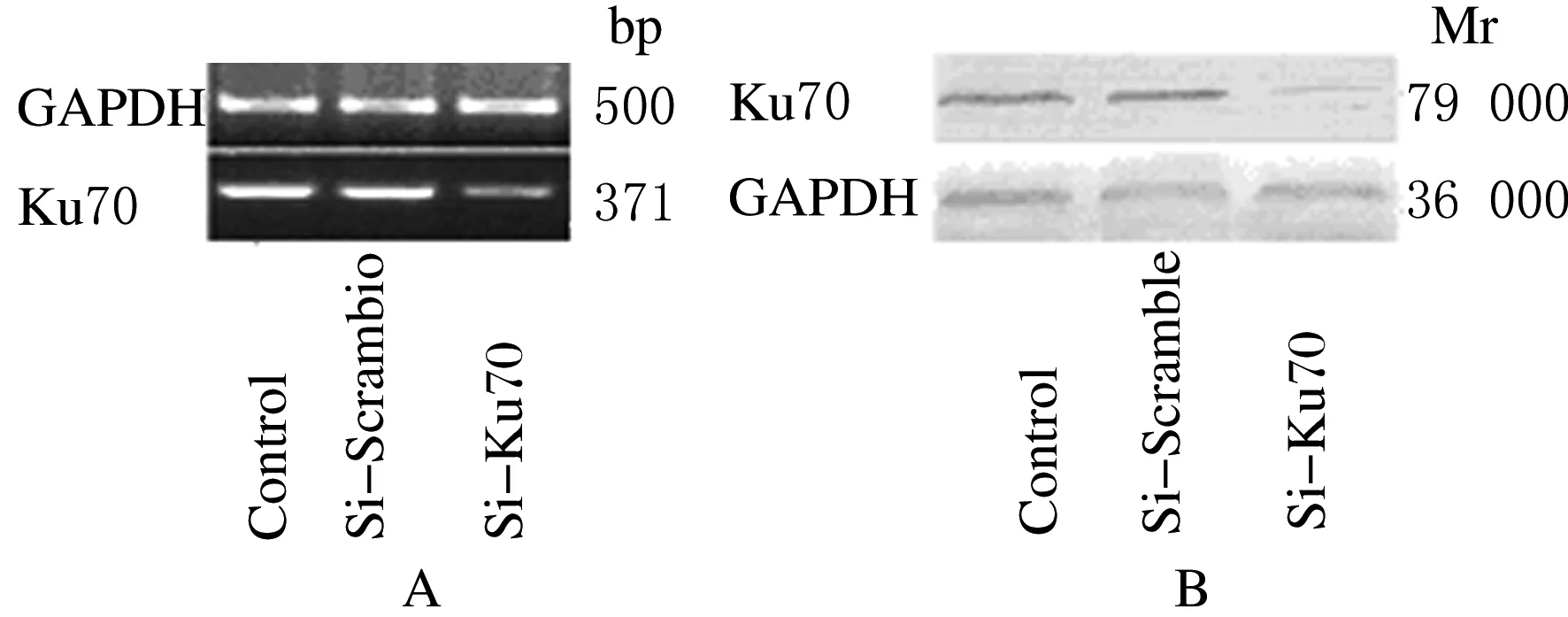
图2 转染siRNA后A549/DDP细胞中Ku70 mRNA(A)及蛋白(B)表达水平
2.4 细胞凋亡的变化6 mg·L-1顺铂作用24 h后,流式细胞术检测结果表明:实验组细胞凋亡率(23.16%±4.29%)高于阴性对照组(11.35%±2.68%)和空白对照组(9.56%±4.29%),差异有统计学意义(P<0.05)。见图4。Caspase-3活性检测表明:实验组细胞Caspase-3活性高于阴性对照组和空白对照组,差异有统计学意义(P<0.05)。见表1。

图3 MTT法检测顺铂作用后各组细胞生存率的变化

图4 流式细胞术检测6 mg·L-1顺铂作用后各组细胞的凋亡率

表1 分光光度法检测6 mg·L-1顺铂作用后各组细胞Caspase-3活性
3 讨 论
肺癌顺铂耐药机制复杂,目前的研究[2-5]已经证实:DNA损伤修复、增殖与凋亡信号途径相关的细胞内蛋白功能改变与肺癌顺铂耐药密切相关。Ku蛋白是DNA重组修复系统中最重要的组成部分,在DNA双链断裂(double strand DNA breaks,DSBs)的同源重组和非同源末端结合修复途径中发挥重要作用[10]。Ku70是Ku蛋白的组成成分之一,具有多种生物活性,参与DNA转录调节,可独立参与细胞抗凋亡,尤其是在DSBs的非同源末端结合修复途径中发挥重要作用[6]。本研究表明:人肺腺癌细胞耐药细胞系A549/DDP Ku70 mRNA和蛋白表达水平显著高于其亲代非耐药细胞系,提示Ku70的表达与肺癌耐药直接相关;靶向导入Ku70 siRNA封闭A549/DDP细胞的Ku70基因,根据本实验MTT结果及文献[11]方法,本研究采用6 mg·L-1顺铂作用于各组细胞,实验组细胞生存率与阴性对照组及空白对照组比较明显下降;实验组顺铂IC50明显下降,提示靶向封闭Ku70可以逆转耐药的人肺腺癌细胞对顺铂的耐药性;Ku70 siRNA与顺铂有协同作用,有助于在靶向联合治疗中减少顺铂用量,有助于减少剂量相关副作用。本研究中凋亡检测结果表明:在6 mg·L-1顺铂作用下,实验组细胞凋亡率明显增加、细胞凋亡级联反应下游的凋亡执行蛋白水解酶Caspase-3的活化程度明显增加,提示靶向封闭Ku70能增加耐药细胞对顺铂诱导的凋亡的敏感性,从而逆转肺腺癌顺铂耐药。本文作者[12]曾对未封闭Ku70的A549/DDP细胞和靶向导入Ku70 siRNA封闭Ku70后的A549/DDP细胞进行凋亡相关基因组的PCR Array检测,结果表明:沉默Ku70后A549/DDP细胞促凋亡基因BAX、P53、P73的mRNA表达水平明显上调,而抗凋亡基因TRAF、BFAR表达水平下调,提示靶向沉默Ku70逆转肺癌细胞耐药与促凋亡基因组的表达上调直接相关。有研究[13]表明:Ku70蛋白能与促凋亡蛋白BAX结合并抑制BAX介导的凋亡;且该过程独立于其二聚体的Ku86。Gama等[14]研究表明:凋亡细胞的Ku蛋白表达水平下降;而对顺铂处理的宫颈癌细胞系Hela细胞的研究[15]表明:靶向Ku70 siRNA下调Ku70表达,可抑制Hela细胞增殖,促进凋亡,与本研究结果类似。Ku70可能通过加速DNA修复、抗凋亡增加人腺癌耐药细胞对顺铂的敏感性,其具体分子机制有待进一步研究。
综上所述,Ku70在人肺腺癌耐顺铂细胞系中呈高表达状态,靶向封闭Ku70可逆转其肺腺癌耐药,并推测Ku70可能通过调控凋亡基因的表达引起凋亡耐受,断裂DNA修复加速,参与肺癌细胞耐药的形成。本研究结果提示:Ku70可能成为临床监测肿瘤耐药性变化的标志物之一及逆转肺癌耐药的一个新的分子靶点。
[参考文献]
[1]Azzoli CG,Baker S,Temin S,et al.American Society of Clinical Oncology Clinical Practice Guideline Update on Chemotherapy for Stage Ⅳ Non-Small-Cell Lung Cancer [J].J Clin Oncol,2009,27(36):6251-6266.
[2]史 鹏,刘 晶,赵凤芹,等.非小细胞肺癌多药耐药因子的表达相关性及临床意义[J].吉林大学学报:医学版,2007,33(1):151-154.
[3]刘智鑫,刘国津.人非小细胞肺癌细胞药物敏感性检测及其与耐药因子p53抗体和GSTZ表达的关系[J].吉林大学学报:医学版,2005,31(5):798-795.
[4]Liu HY,Liang YG,Li Y,et al.Gene silencing of BAG-1 modulates apoptotic genes and sensitizes lung cancer cell lines to cisplatin-induced apoptosis[J].Cancer Biol Ther,2010,9(10):832-840.
[5]刘 萍,王豪勋.非小细胞肺癌组织中RRM1的表达与含吉西他滨方案耐药的关系[J].郑州大学学报:医学版,2011,46(6):876-878.
[6]Rathaus M,Lerrer B,Cohen HY.DeubiKuitylation:A novel DUB enzymatic activity for the DNA repair protein,Ku70[J].Cell Cycle,2009,8(12):1843-1852.
[7]Pavon MA,Parreno M,Leon X,et al.Ku70 predicts response and primary tumor recurrence after therapy in locally advanced head and neck cancer[J].Int Cancer,2008,123(5):1068-1079.
[8]王奇金,邹大进.Ku70反义寡核苷酸增强甲状腺癌细胞的辐射敏感性[J].中华内分泌代谢杂志,2009,25(5):544-545.
[9]张 妍,尹 元.RNA干扰Ku70基因对宫颈癌Hela细胞放射敏感性影响的实验研究[J].中国实验诊断学,2010,14(12):1916-1920.
[10]Fell VL,Schild-Poulter C.Ku regulates signaling to DNA damage response pathways through the Ku70 von willebrand A domain[J].Mol Cell Biol,2012,32(1): 76-87.
[11]Jaya S,Analisa D,Lauren F,et al.Targeted reduction of KLF6-SV1 restores chemotherapy sensitivity in resistant lung adenocarcinoma[J].Lung Cancer,2009,66(3):292-297.
[12]李亚荣,张 捷,王 珂,等.沉默Ku70后人耐药肺癌细胞凋亡基因组表达变化及临床意义[J].中国免疫学杂志,2010,26(4):312-316.
[13]Sawada M,Sun W,Hayes P,et al.Ku70 suppresses the apoptotic translocation of Bax to mitochondria[J].Nature Cell Biol,2007,9(4) : 480-480.
[14]Gama V,Yoshida T,Gomez JA,et al.Involvement of the ubiquitin pathway in descreasing Ku70 levels in response to drug-induced apoptosis[J].Exp Cell Res,2006,312(4):488-499.
[15]Tian X,Chen G,Xing H,et al.The relationship between the down-regulation of DNA-PKcs or Ku70 and the chemosensitization in human cervical carcinoma cell line HeLa[J].Oncol Rep,2007,18(4):927-932.
