酶解蚕豆蛋白制备多肽酒及其抗氧化性研究
2012-09-17杨希娟刘玉皎耿贵工
杨希娟 党 斌 刘玉皎 耿贵工
(青海省农林科学院1,西宁 810016)
(青藏高原农产品加工重点实验室2,西宁 810016)
蚕豆,别名胡豆、南豆、罗汉豆,是一种蛋白质含量丰富的豆科植物。蚕豆产量在全世界食用豆类中位居第6,在中国其播种面积和产量是除大豆和花生之外种植面积和产量最多的食用豆类作物[1]。蚕豆中的蛋白质质量分数达25% ~35%,蚕豆蛋白的氨基酸组成接近人体和动物所需要的理想比例,其中赖氨酸质量分数比谷类高出3倍,所以蚕豆被誉为植物蛋白质的新来源[2-4]。目前蚕豆在我国主要用作蔬菜和饲料,我国食品加工业主要利用蚕豆生产粉丝,而作为重要营养成分的蛋白质未被合理利用。
蛋白质在酶解过程中可获得许多功能性多肽,这些多肽具有抗高血压、降胆固醇、抗氧化、改善元素吸收、矿物质运输、促进生长等功能,在食品工业中应用广泛[5]。其中将多肽进行发酵加工制作多肽饮料及多肽酒是多肽重要的应用途径。目前已有关于乳清多肽酒[6]和豆乳酒[7]的研制开发。目前利用蚕豆蛋白为原料制备蚕豆多肽酒还未见报道。本试验利用蛋白酶酶解蚕豆蛋白制备多肽酒,并对其抗氧化性进行研究,以期为蚕豆蛋白的综合利用提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
蚕豆原料:青海省农林科学院;葡萄酒用高活性干酵母:安琪酵母股份有限公司;碱性蛋白酶:北京奥博星生物技术有限责任公司,活性≥200 000 U/g,生化试剂;二苯代苦味酰基自由基(DPPH·):Sigma公司;偏重亚硫酸钾(二氧化硫含量为50%)、铁氰化钾、硫酸亚铁、三羟甲基氨基甲烷(Tris)、三氯乙酸、邻苯三酚、水杨酸、磷酸二氢钠、磷酸氢二钠、无水乙醇、盐酸等均为国产分析纯;蔗糖为市售食品级。
S-263凯氏定氮仪:瑞典FOSS公司;SP-1500型实验型喷雾干燥机:上海顺仪实验有限公司;TGL-20M高速台式冷冻离心机:湘仪离心机仪器有限公司;雷磁PHS-25型pH计:上海雷磁仪器厂;HHS-6S电子恒温不锈钢水浴锅:上海光地仪器设备有限公司;AL204电子天平:梅特勒-托利多仪器(上海)有限公司;FW-80高速万能粉碎机:北京德威特仪器有限公司;DHP-9272电热恒温培养箱:苏州江东精密仪器有限公司;UV-1801紫外-可见分光光度计:北京北分瑞丽分析仪器(集团)公司。
1.2 试验设计与方法
1.2.1 蚕豆蛋白的制备工艺流程[8]
蚕豆→脱皮→粉碎(过80目筛)→调至pH碱性→加热搅拌1 h→4 000 r/min离心20 min→过滤→滤液调pH酸性并搅拌→4 000 r/min离心20 min→沉淀层水洗至中性→喷雾干燥
1.2.2 蚕豆多肽酒制备[9]
1.2.2.1 工艺流程
蚕豆蛋白→酶解→灭酶→离心→酶解液→调配→接种活化酵母→发酵→终止发酵→离心或抽滤→配制→过滤→装瓶→灭菌→冷却后封口保存
1.2.2.2 操作要点
酶解:将蚕豆蛋白加水配成32 g/L的溶液,然后调节至pH 9.0,加入10 000 U/g碱性蛋白酶,45℃进行酶解2 h,在酶解过程中,要保持酶解液温度恒定,并用0.1 mol/L的氢氧化钠维持pH不变。
灭酶、离心:酶解完成后加热煮沸5 min灭酶,然后3 000 r/min离心15 min,得到酶解上清液。
调配:酶解液先加入100 mg/L SO2,再加入占酶解液体积22%的蔗糖,搅拌溶解,于37℃的水浴中预热。
活化酵母:将安琪葡萄酒用活性干酵母加入蚕豆多肽液中,在35~40℃的培养箱里培养0.5 h,按一定的接种量接种酵母。
发酵:将活化后的酵母接种到发酵液中发酵,在一定的发酵温度发酵一定时间,至可溶性固形物不再下降停止发酵,发酵结束后酒精度达到10左右。
灭菌:在70℃条件下灭菌15 min,冷却至室温后封口保存。
1.2.3 蚕豆蛋白酶解优化试验
以影响蚕豆蛋白水解度的底物浓度、温度、酶用量及pH为4个试验因子,以蚕豆蛋白的水解度(DH)为目标,进行中心组合试验设计(表1)。通过Design Expert 8.0.5软件对试验数据进行回归分析,用以确定蚕豆蛋白酶解的最佳工艺条件。
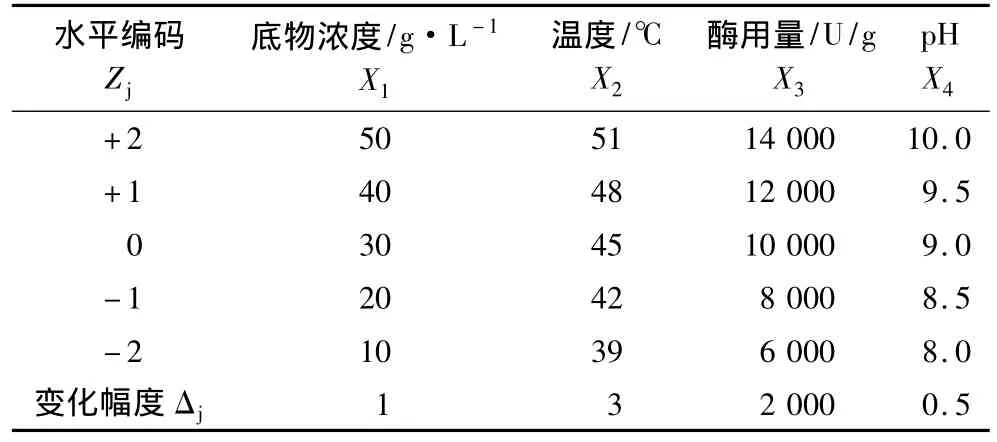
表1 中心组合设计因素与水平
1.2.4 蚕豆多肽酒发酵试验
1.2.4.1 蚕豆多肽酒发酵的单因素试验
分别考察加糖量、酵母用量、发酵温度、发酵时间对蚕豆多肽酒酒精含量的影响,确定蚕豆多肽酒发酵的适宜条件。各因素的试验范围为加糖量:14%、16%、18%、20%、22%;酵母用量:0.05%、0.10%、0.15%、0.20%、0.25%;发酵温度:19、22、25、28、31 ℃;发酵时间:3、4、5、6、7、8、9 d。试验重复3次,取平均值。
1.2.4.2 蚕豆多肽酒发酵条件优化
在单因素的基础上,以加糖量、酵母接种量、发酵温度为因素,以酒精含量为指标,采用四因素三水平L9(34)的正交试验(表2)进行优化选择,试验重复3次,取平均值。
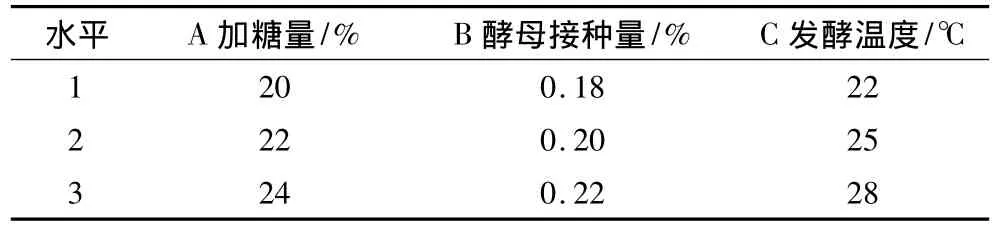
表2 蚕豆多肽酒发酵正交试验设计
1.3 测定指标与方法
1.3.1 酒精度的测定
采用酒精计法[10]。
1.3.2 蚕豆蛋白基本营养成分测定
蛋白含量测定:凯氏定氮法GB 5009.5—1985;淀粉测定:菲林试剂滴定法GB 5006—1985;粗纤维测定:酸碱处理法GB 5009.10—1985;粗灰分测定:550℃灼烧法GB 5009.4—1985;水分测定:直接干燥法 GB 5009.3—1985。
1.3.3 水解度的测定[11]
水解度(DH)=N1/N2×100%
式中:N1为水解后生成的NH2基的量/g/100 mL;N2为样品总氮含量/g/100 mL。
水解后生成的NH2基的量由氨基氮的测定法即双指示剂甲醛滴定法测得,样品总含氮量由微量凯氏定氮法测定。
1.3.4 DPPH·清除能力测定[12-13]
取一定浓度的样品溶液4 mL加入1 mL用无水乙醇配制的DPPH·溶液,并使DPPH·终浓度为0.1 mmol/L。用力振摇混匀后置暗室中静置30 min,于517 nm波长处测定吸光度。按下式计算DPPH·清除率。
DPPH·清除率=[1-(Ax-Ax0)/A0)]×100%
式中:Ax为加入样品溶液和DPPH·后的吸光度;Ax0为样品溶液本底的吸光度;A0为DPPH·和蒸馏水的吸光度。
1.3.5 氧自由基清除率测定[14-15]
采用邻苯三酚自氧化法测定。取50 mmol/L Tris-HCl缓冲液(pH 8.2)4.5 mL,置于 25 ℃水浴中保温20 min,分别加入1 mL样品溶液和0.4 mL 25 mmol/L邻苯三酚溶液,混匀后于25℃水浴中反应5 min,加入1 mL 8 mmol/L HCl终止反应,于299 nm处测定吸光度(Ax),空白对照组以相同体积蒸馏水代替样品。每个试样做3个平行样,取平均值,按下式计算O2-·清除率:
O2-·清除率 =(A0-Ax)/A0×100%
式中:A0为空白对照液吸光度,Ax为样品溶液吸光度。
1.3.6 羟自由基清除率测定[16-17]
在试管中加入0.5 mL 10 mmol/L水杨酸-乙醇溶液,0.5 mL 样品溶液 0.5 mL 10 mmol/L FeSO4溶液,3.5 mL蒸馏水,最后加入5 mL 100 mmol/L H2O2启动Fenton反应,摇匀后于510 nm处测定吸光度A1;取0.5 mL的蒸馏水代替10 mmol/L FeSO4溶液所测得的吸光度为A2;取0.5 mL的蒸馏水代替酶解液所测得的吸光度为A3。羟自由基清除率表示为:
·OH 清除率=[1-(A1-A2)/A3]×100%
2 结果与分析
2.1 蚕豆蛋白基本组成成分分析
本试验制备的蚕豆蛋白粉中蛋白质含量为82.6%(表3),此外还含有部分的淀粉和纤维物质。在蛋白酶解过程中底物浓度以净蛋白含量计算。

表3 蚕豆蛋白主要组成成分/%
2.2 蚕豆蛋白酶解试验
2.2.1 回归模型的建立及显著性检验
采用4因素中心组合试验设计对蚕豆蛋白酶解的工艺进行优化,试验方案及结果见表4。以蚕豆蛋白的水解度Y为响应面,底物浓度(X1),酶解温度(X2),酶用量(X3),pH(X4)为自变量,采用 Design expert 8.0.5软件对表4中的数据进行二次多元回归拟合,得到碱性蛋白酶酶解蚕豆蛋白的数学模型为(已剔除不显著项):
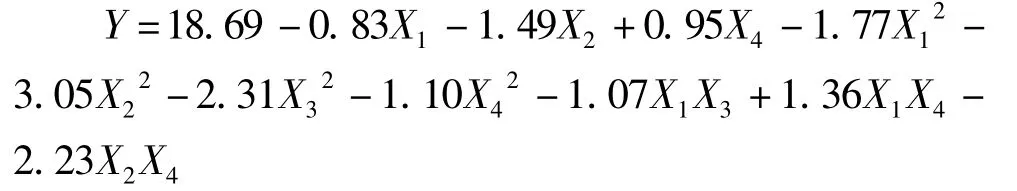
回归方程经方差分析后进行显著性及拟合度检验。由表5可知,回归方程P=0.000 1<0.01,达到极显著水平,失拟项检验P=0.139 4>0.01,复相关系数R2=0.988 1,S/N(信噪比)为 31.187 远大于 4,表明该数学模型中4个因素对酶解蚕豆蛋白水解度的影响达98.81%,而其他因素的影响和误差占1.19%,即只有1.19%的变异不能由该模型解释,预测值和实测值有高度的相关性。该回归方程可较好地描述各因素与响应值之间的真实关系,可利用该回归方程确定最佳酶解工艺条件。
各个因素与蚕豆蛋白水解度的显著性分析结果(表5)表明,底物浓度(X1)、酶解温度(X2)、pH(X4)对水解度的影响达到极显著水平,即底物浓度、酶解温度和pH对水解度有极显著的影响;4个因素的二次项均极显著,表明4个因素对蚕豆蛋白水解度的影响不是简单的线性关系,存在明显的二次关系;底物浓度(X1)与加酶量(X3),底物浓度(X1)与pH(X4)、酶解温度(X2)与pH(X4)的交互项回归系数极显著,即表明它们之间存在明显的交互作用。
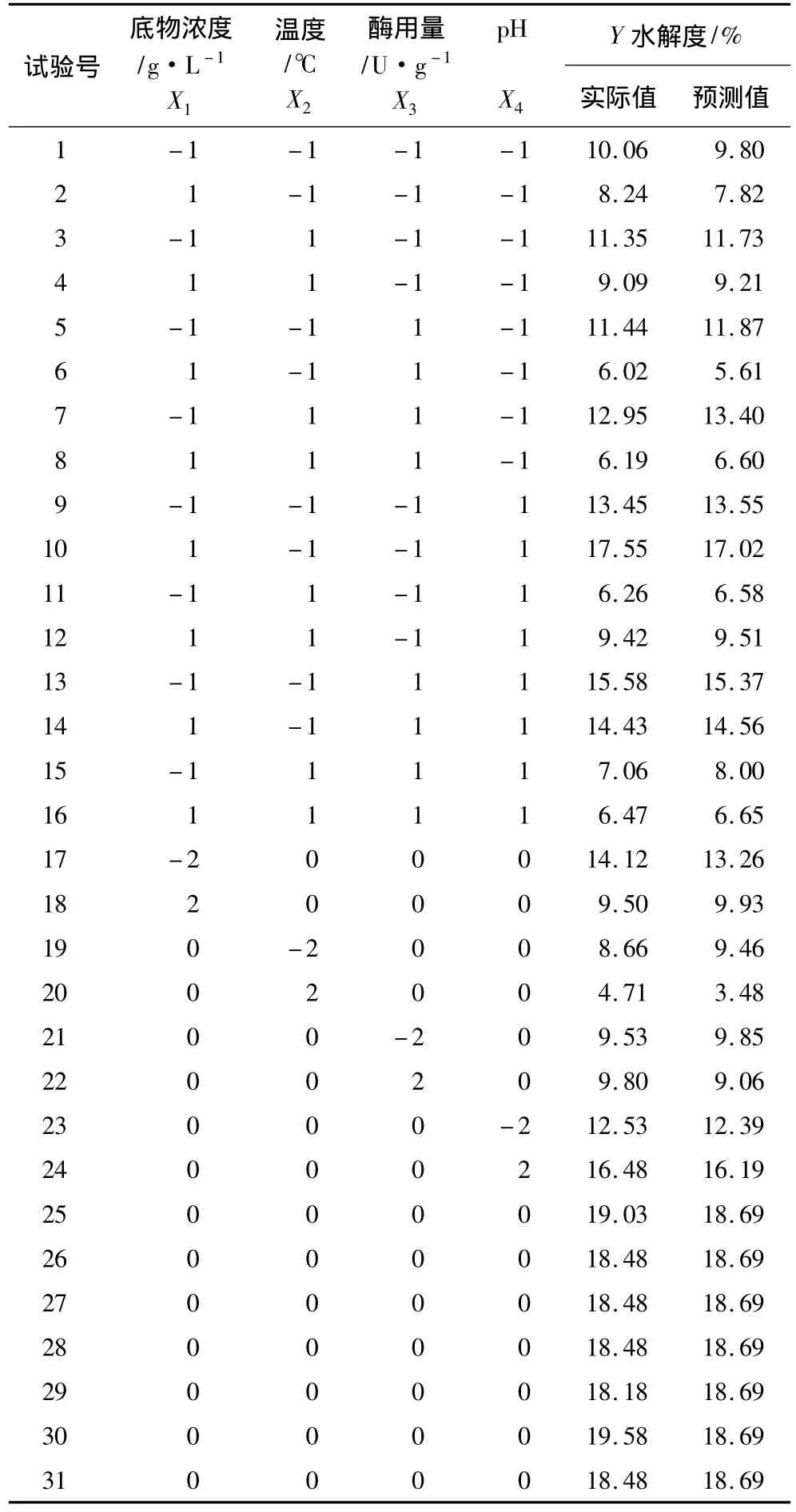
表4 中心组合设计试验结果
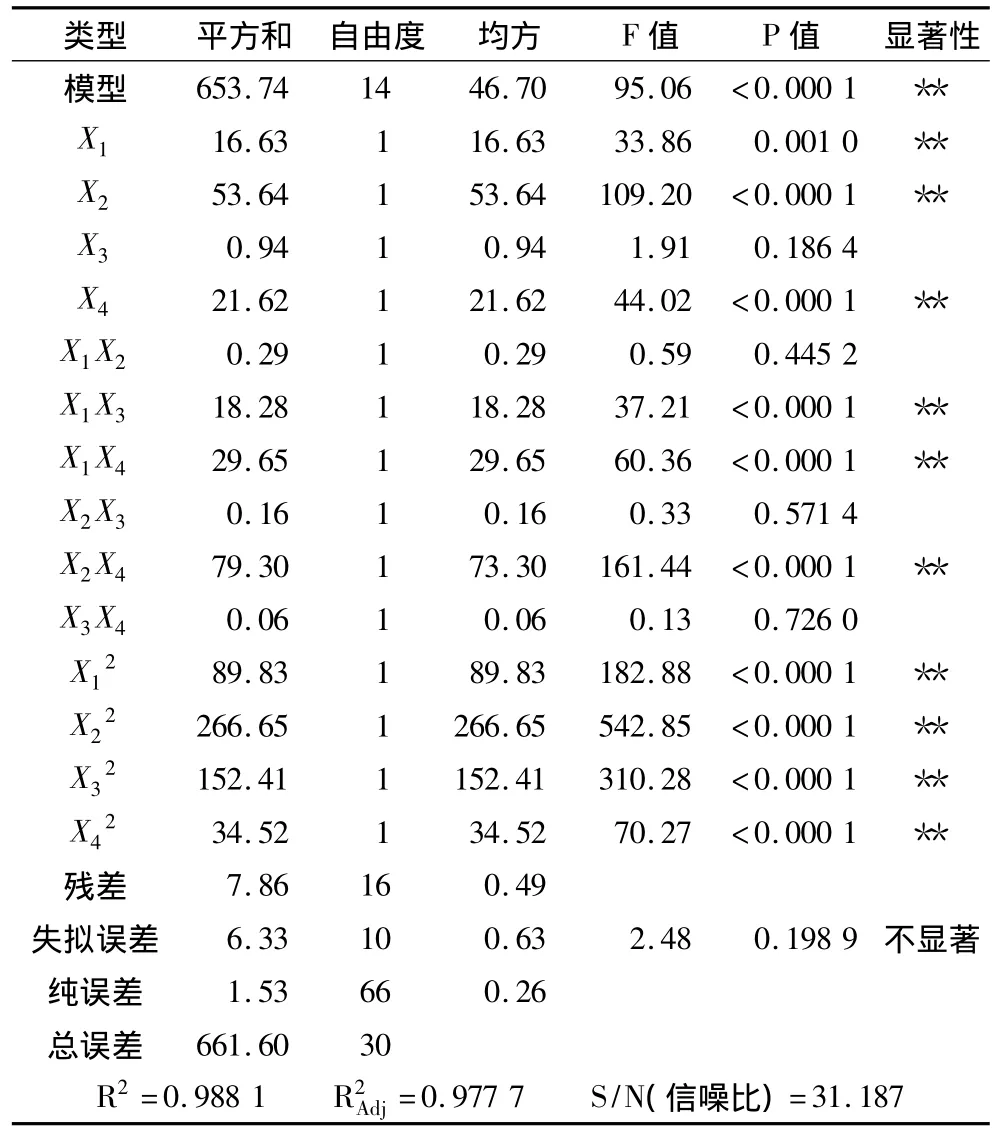
表5 回归模型的方差分析表
2.2.2 蚕豆蛋白酶解的优化工艺条件
在试验结果分析及模型拟合的基础上,利用Design expert 8.0.5软件进一步优化试验参数,即为获得最大水解度情况下,优化得到碱性蛋白酶酶解蚕豆蛋白的适宜工艺参数为 X1=0.12、X2= -0.61、X3=-0.089、X4=1.00,Y=19.741 1%。即当底物浓度为32 U/g,水解温度为43.17 ℃,酶用量为9 821.12 U/g,pH 9.50的条件下酶解2 h,蚕豆蛋白的水解度理论最大值为19.741 1%。在优化的工艺参数条件下酶解蚕豆蛋白,实际测得蚕豆蛋白水解度为19.64%,与预测值基本符合。
2.3 蚕豆多肽酒发酵工艺条件
2.3.1 加糖量对发酵酒酒精含量的影响
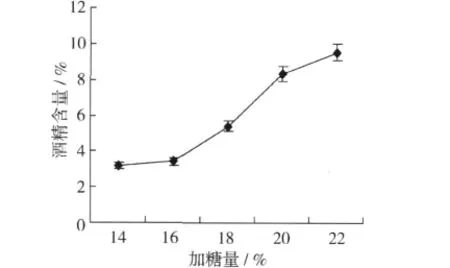
图1 加糖量对蚕豆多肽酒发酵酒酒精含量的影响
由图1可知,随着加糖量的增加,蚕豆多肽酒酒精含量不断增加,但增加的趋势趋于平缓。加糖量低,发酵不完全,酒精生成量较缓,发酵酒的最终酒精度低。随着加糖量的增多,发酵酒精度升高。但当加糖量达到20%以上时,发酵的酒精含量基本不在增加,加糖量应选择20%~22%。
2.3.2 酵母接种量对发酵酒酒精含量的影响
由图2可知,随着酵母接种量的增加,蚕豆多肽酒的酒精含量先升高后降低。接种酵母量少,发酵不充分,产生酒精的速度缓慢且发酵酒的最终酒度低。随着接种酵母量的加大,发酵速度加快,生成较多的酒精。但当酵母接种量达到0.2%以上时,发酵酒的酒精含量基本稳定,说明接种量过大会导致酵母早衰,同时会出现菌体自溶现象,并会产生苦味和酵母臭味,从而影响产品的品质。综合考虑产品的风味、酒精度和经济性,活性干酵母接种量选择0.2%。
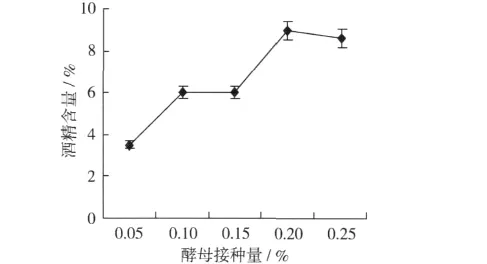
图2 酵母接种量对蚕豆多肽酒发酵酒酒精含量的影响
2.3.3 发酵温度对发酵酒酒精含量的影响
图3可知,随着发酵温度的升高,发酵酒的酒精含量呈现先增加后升高的趋势。发酵温度较低时,酵母发酵速度较慢,发酵酒的酒度低。随着发酵温度的升高,酵母生长速度加快,能较充分利用营养物质产生酒精,使得发酵酒酒度较高。当发酵温度达到28℃时,发酵温度过高,酵母发酵速度过快,不利于发酵酒风味的形成,口感较差,而且高温发酵容易引起酵母早衰,发酵能力减弱,糖分不能得到充分利用,在发酵后期容易出现酸败。因此要获得较高酒精度的蚕豆多肽酒,就必须把发酵温度控制在适当的水平,既要保证较高的发酵速度,又要获得较高的酒精度。所以发酵温度选择25℃。
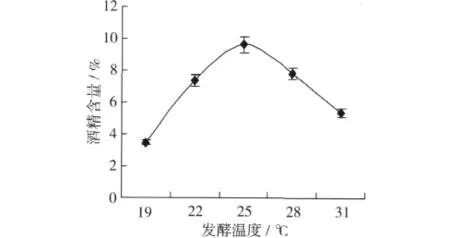
图3 发酵温度对蚕豆多肽酒发酵酒酒精含量的影响
2.3.4 发酵时间对发酵酒酒精含量的影响
由图4可知,蚕豆多肽酒的酒精含量随着发酵时间的延长出现不断增加的趋势,发酵前6 d酒精含量增加显著,发酵6 d以后,发酵酒酒精趋于稳定,发酵接近终点,因此发酵时间选择6 d。
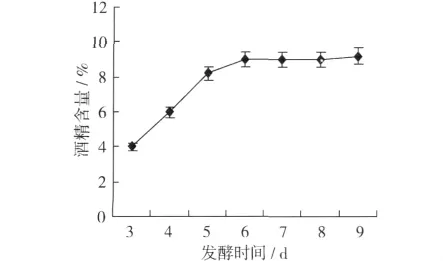
图4 发酵时间对蚕豆多肽酒发酵酒酒精含量的影响
2.3.5 蚕豆多肽酒发酵的正交试验结果
由表6可知,各因素对多肽酒发酵酒精度的影响顺序为C>B>A。即发酵温度对蚕豆多肽酒酒精含量的影响最大,其次是酵母接种量,最后是加糖量。极差分析的最优组合为A1B3C3。即加糖量20%、酵母添加量0.22%、发酵温度28℃。在此条件下制得的蚕豆多肽酒的酒精含量为9.6%,呈棕黄色,口感醇正、鲜爽、无涩味、略有苦味,具有发酵酒的醇香。
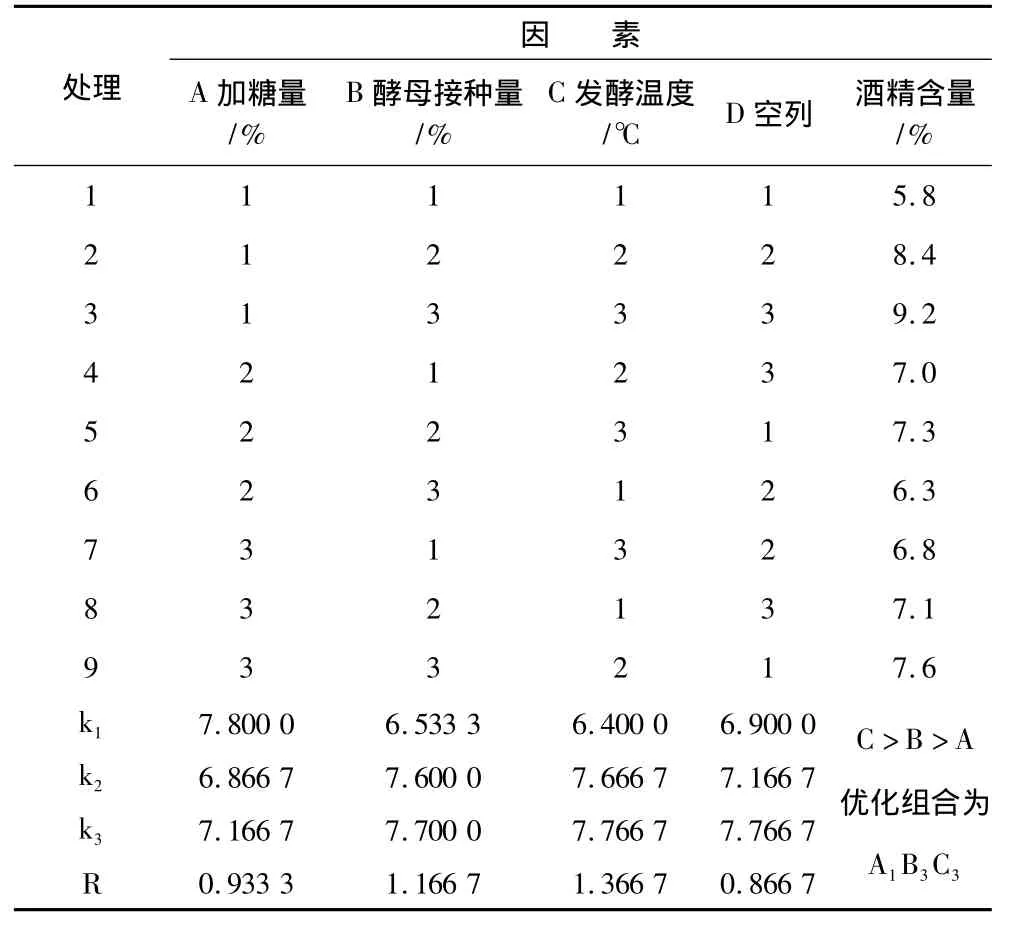
表6 蚕豆多肽酒正交试验结果与分析
2.4 蚕豆多肽酒发酵过程中抗氧化性变化
从图5可以看出,随着发酵的进行,蚕豆多肽酒的·OH清除率和DPPH·清除率均出现先降低后升高的趋势。发酵3 d时·OH清除率和DPPH·清除率均达到最低点。当发酵至4 d时,·OH清除率和DPPH·清除率又随发酵的进行而增加,当发酵至5 d以后·OH清除率和DPPH·清除率增加的趋势变缓,基本趋于稳定,比发酵前有所增加。这是由于酵母菌生长繁殖需要营养,因此在最初的发酵过程中酵母消耗了发酵液中的部分多肽,使其发酵酒的·OH清除率和DPPH·清除率有所降低,随发酵时间的延长,酵母菌发酵产生蛋白酶进而酶解蛋白质生成氨基酸和多肽,从而增加了发酵液中多肽含量,使发酵酒的·OH清除率和DPPH·清除率有所升高。
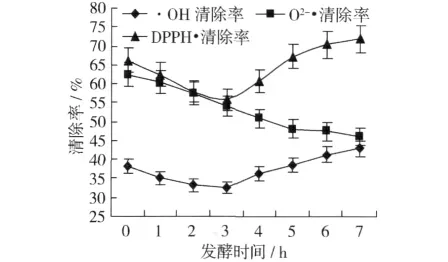
图5 蚕豆多肽酒发酵过程中抗氧化性变化
在发酵前4 d,随着发酵时间的延长,蚕豆多肽酒的O2-·清除率逐渐下降,当发酵至4 d以后,O2-·清除率下降的趋势逐渐趋于平缓,发酵至7 d时O2-·清除率由发酵前的62.43%下降至45.98%。原因有待进一步研究。
3 结论
3.1 采用碱性蛋白酶酶解蚕豆蛋白的最佳工艺条件为:底物浓度32 U/g,水解温度43.17℃,酶用量9 821.12 U/g,pH 9.50,在此条件下酶解2 h,蚕豆蛋白的水解度达到19.64%。
3.2 确定蚕豆多肽酒发酵的适宜条件为:加糖量20%、酵母添加量0.22%、发酵温度28℃,发酵时间6 d,在此条件下制得的蚕豆多肽酒的酒精含量为9.6%,呈透明的棕黄色,口感醇正、鲜爽、略有苦味,具有发酵酒的醇香。
3.3 蚕豆多肽酒具有较强的抗氧化性。蚕豆多肽酒的·OH清除率和DPPH·清除率较发酵前有所提高,O2-·清除率比发酵前有所降低。
[1]李正明,王兰君.植物蛋白生产工艺与配方[M].北京:中国轻工业出版社,1998:11-43
[2]宋绪晓.蚕豆蛋白的营养特点加工技术及利用途径[J].中国粮油学报,1993,8:51 -54
[3]周如太.豆类粉丝厂废水中蛋白质的回收利用[J].饲料工业,1995,16(9):40 -41
[4]Vose JR.Production and functionality of starches and protein isolates from legume seeds(field peas and horse-bean)[J].Cereal Chemistry,1980,57(6):406 -4101
[5]KORHONEN H,PIHLANTO A.Food -derived bioactive peptides- opportunities for designing future foods[J].Current Pharmaceutical Design,2003,9:1297 -1308
[6]齐海萍,胡文忠,范圣第.乳清多肽酒的开发[J].食品工业科技,2006,5:133 -135
[7]崔蕊静,李汉臣,杜茂宝,等.豆乳酒发酵条件优化[J].农业工程学报,2007,23(7),257 -262
[8]李雪琴,苗笑亮.蚕豆分离蛋白的制备及其功能性质研究[J].粮食与饲料工业,2003,(5):41 -43
[9]姜莉,徐怀德,陈金海,等.核桃多肽的制备及核桃多肽酒的研制[J].食品科学,2009,30(8):307 -310
[10]王叔淳.食品卫生检验技术手册[M].第3版.北京:化学工业出版社,2002:506
[11]李红敏,周小理.荞麦多肽的制备及其抗氧化活性的研究[J].食品科学,2006,27(10):301 -306
[12]LEE Y L,YEN M T,MAU J L.Antioxidant properties of various extracts from Hypsizigus marmoreus[J].Food Chemistry,2007,104(1):1 -9
[13]TSAI S Y,HUANG S J,MAU J L.Antioxidant properties of hot water extracts from Agrocybe cylindracea[J].Food Chemistry,2006,98(4):670 -677
[14]高春燕,田呈瑞.枸杞多糖体外抗氧化特性研究[J].粮食与油脂,2005(7):28-29
[15]QI H M,ZHANG Q B,ZHAO T T,et al.Antioxidant activity of different sulfate content derivatives of polysaccharide extracted from Ulvapertusa(Chlorophyta)in vitro[J].Internationa Journal of Biological Macromolecules,2005,37:195 -199
[16]徐怀德,殷金莲,陈沁.甲鱼酶解产物抗氧化功能的研究[J].中国食品学报,2007,7(4):25 -32
[17]LIMY Y,MURTI,JAYA J.Antioxidant properties of Phyllanthus amarus extracts as affected by different drying methods[J].LWT,2007,40:1664 -1669.
