重组酿酒酵母全细胞催化合成莱鲍迪苷A*
2012-09-12刘欢李艳严明陈圣郝宁许琳
刘欢,李艳,严明,陈圣,郝宁,许琳
(南京工业大学生物与制药工程学院,江苏南京,210009)
重组酿酒酵母全细胞催化合成莱鲍迪苷A*
刘欢,李艳,严明,陈圣,郝宁,许琳
(南京工业大学生物与制药工程学院,江苏南京,210009)
用经密码子优化后合成的甜叶菊UDP糖基转移酶UGT76G1编码基因构建了表达该酶的重组酿酒酵母YPH499(pYES2-UGT)。建立了通过柠檬酸钠调节酿酒酵母细胞内由葡萄糖到尿苷二磷酸葡萄糖(UDPG)的代谢通量,用于催化甜菊苷合成莱鲍迪苷A的全细胞催化方法。优化后的催化体系为:甜菊苷1 g/L,葡萄糖20 g/L,普郎尼克F6810 g/L,MgCl26 g/L,柠檬酸钠15 g/L,pH 7.2,细胞密度200 g湿细胞/L反应液,在37℃下经72 h后转化生成莱鲍迪苷A 267.89 mg/L。
甜叶菊,莱鲍迪苷A,糖基转移酶,UGT76G1,全细胞催化
莱鲍迪苷A(rebaudioside A,RA苷)是一种无毒、安全、低热能、高甜度的天然甜昧剂,其甜度是蔗糖的150~300倍,热值仅为蔗糖的1/300[1],而且口味纯正,没有后苦味。RA苷是从甜菊叶中提取出来的甜菊糖中的一种糖苷成分。目前,已从甜菊糖中至少发现了8种糖苷[2],其中最主要的3种糖苷成分在甜叶菊叶片中的含量通常为:甜菊苷(ST苷)9.1%,RA苷3.8%,莱鲍迪苷C 0.6%[3]。市售甜菊糖一般以ST苷为主要成分,虽然ST苷甜度约为蔗糖的200倍,但其略带甘苦的后味影响了甜菊糖的口感。因此,提高RA苷相对含量有助于改善甜菊糖味质。
UDP-糖基转移酶UGT76G1能特异性地催化ST苷通过一步糖基化反应合成RA苷[4]。然而,甜叶菊中天然UGT76G1含量甚微,分离纯化成本高,难以获取大量的酶蛋白,并且,糖基转移反应中需要昂贵的尿苷二磷酸葡萄糖(UDPG)作为糖基供体,必然导致RA苷酶促合成应用的经济性差。全细胞催化利用微生物细胞提供的酶系作为催化剂,细胞内多种酶系的存在可以实现酶的级联反应,从而弥补了酶法催化中级联催化过程不易实现的不足,其方法制备简单,在生物催化领域中具有不容忽视的优势。本文即构建重组表达UGT76G1的酿酒酵母菌,初步研究RA苷的全细胞催化合成。为了避免添加UDPG作为辅底物,本研究在反应体系中加入糖酵解途径的抑制剂柠檬酸,主要通过调控6-磷酸果糖激酶的活性,提高向糖原合成等途径的UDPG通量,将相对廉价的葡萄糖在重组酵母细胞内合成UDPG以满足UGT76G1所催化的转糖基反应的需要。
1 材料和方法
1.1 试剂与仪器
基因和引物分别由南京金思瑞和上海美吉公司合成;限制性内切酶购于NEB公司;T4 DNA连接酶、Taq DNA聚合酶、限制性内切酶和DNA Marker购自Takara公司,质粒DNA抽提试剂盒、DNA片段纯化与胶回收试剂盒购于上海申能博彩有限公司;标准品ST苷和RA苷购自曲阜海根甜菊制品有限公司。
1.2 菌株和质粒
大肠杆菌菌株E.coli DH5α和酿酒酵母菌株S.cerevisiae YPH499为本实验室保藏,pMDTM18-T载体购自TaKaRa公司,质粒pYES2为本实验室保藏,pYES2-UGT是本实验构建的带UGT76G1糖基转移酶基因的重组质粒。
1.3 培养基
大肠杆菌完全培养基液体LB:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L。完全培养基液体YPD:10 g/L酵母提取物,20 g/L蛋白胨,20 g/L葡萄糖。选择培养基液体SC-U(SC基本培养基[9]缺乏尿嘧啶),其中碳源为20 g/L葡萄糖。SCGal-U即将SC-U培养基中葡萄糖用半乳糖代替。
1.4 基因的优化合成与重组菌的构建
检索NCBI GeneBank数据库,根据AY345974基因序列,使用OptimumGeneTM软件对此基因进行合成前的优化设计。在不改变氨基酸序列的前提下,用酿酒酵母偏好的密码子替代原基因中的稀有密码子,将优化后的基因命名为UGT。基因合成由金思特公司完成。
根据合成的UGT基因序列信息,用primer5.0软件设计构建表达载体所用的引物并加设酶切位点,设计的上下游引物分别为:
P1:5’-CGGAATTCAAACAATGTCTGAAAATAAGACTGAAACTACTG-3',
P2:5’-CCGCTCGAGTTATAATGATGAAATATAAGAAACCAA-3'。
引物由上海美吉公司合成。PCR反应条件为:94℃变性5 min;按如下参数循环30次:94℃变性30S,60℃退火30 s,72℃ 延伸2 min,循环30次;最后72℃延伸10 min。
将PCR扩增的基因片断通过“TA”克隆的方式连接到克隆载体pMDTM18-T上,构建克隆质粒pMDTM18-T-UGT并测序。然后用EcoR I和Xho I双酶切测序结果正确的pMDTM18-T-UGT和表达质粒pYES2,纯化后将两者连接构建重组质粒pYES2-UGT,将重组质粒热击转化入E.coli DH5α得到重组菌DH5α(pYES2-UGT),提取质粒进行PCR以及用BamH I进行单酶切鉴定,最后将鉴定结果正确的重组质粒pYES2-UGT转入酿酒酵母YPH499感受态中,得到的重组YPH499(pYES2-UGT)菌体悬液涂布于SC-U筛选平板上,于30℃培养,直至长出单菌落。
1.5 重组酶诱导表达
重组菌YPH499(pYES2-UGT)在液体YPD中,30℃培养活化。然后按2%接种量转接新鲜液体SC-U中,30℃,培养48 h,使菌体生物量积累。室温6000 r/min离心10 min,获得菌体用0.1 mol/L磷酸钾缓冲液(pH=7)悬浮洗涤后,离心收获菌体,转移至SCGal-U培养基中进行诱导,30℃,12 h。诱导后室温离心,所得菌体即可用于破碎后测酶活或者全细胞催化实验。
1.6 酶活性测定
将离心收集的重组酿酒酵母细胞,用磷酸钾缓冲液洗涤两次,加入Yeast Buster蛋白抽提试剂进行处理,破碎细胞。然后于4℃,12000 r/min离心5 min,收集酶粗提液备用。
在1.5 mL的反应体系中(1.2 mol/L ST苷、4 mol/L UDPG、3 mol/L MgCl2、10 μg/mL BSA、pH=7.2)[10],加入适量酶粗提液反应,30℃室温12 h后,高温加热5 min终止反应。以不加酶液的反应液做空白对照。12000 r/min离心1 min后上清液用高效液相色谱(HPLC)进行分析,色谱条件为:色谱柱Lichrospher NH2柱(250 mm×4.6 mm,5 μm);流动相为V(乙睛)∶V(水)=80∶20;流速1 mL/min;柱温;40℃;检测波长:210 nm。
在完成抹面施工后要进行水泥混凝土路面的表面横向纹理处理和路面压槽施工。压槽施工中要做到对混凝土表面干湿度的有效把握,例如可采用现场用手试摁的方式进行检查。同时要在两侧模板位置上放置一根槽钢,保证槽钢位置平面朝下,凹面则要朝上,这是为压纹机提供合理的过往轨道空间[3]。
酶活力单位定义为:在上述反应条件下,30℃,1 min催化形成1 μmol RA苷所需要的酶量为1个活力单位(U)。
1.7 全细胞催化体系的初步建立以及优化
取1.5小节中所得2 g湿细胞,转移至小三角瓶中,10 mL反应体系中加入下述物质:底物ST苷1 g/L,UDPG2g/L,通透剂1%,MgCl24 g/L,磷酸钾缓冲液0.1 mol/L,pH=7.0,30℃,反应72 h后离心,上清液用HPLC分析。在此体系基础上先考察了通透剂的影响,并通过加入代谢调节物质柠檬酸钠,用20 g/L的葡萄糖成功地替代UDPG作为辅底物,至此,全细胞催化体系初步建立。在此基础上,对柠檬酸钠浓度、MgCl2浓度、pH、温度这4个因素分别进行了优化。
2 结果与分析
2.1 基因的优化合成与重组菌的构建
以优化后合成的UGT基因为模板,用引物P1和P2进行PCR扩增,扩增的产物经1.0%琼脂糖凝胶电泳鉴定,电泳结果由图2(a)可知,PCR产物为单一条带,对应片断大小约在1.3~1.4 kb之间,与预期结果相符合(目的产物大小是1348 bp)。重组载体构建的过程如图1所示。
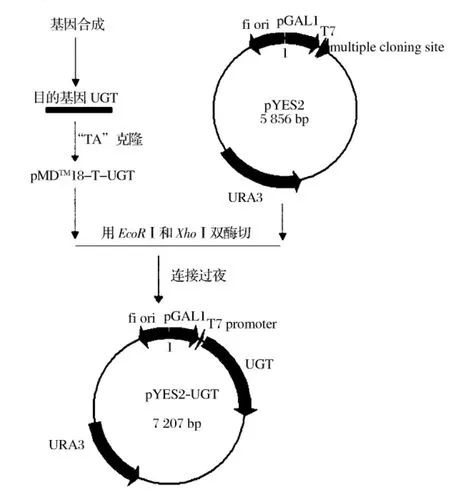
图1 重组质粒pYES2-UGT构建示意图
重组质粒pYES2-UGT转化入E.coli DH5α得到的重组菌DH5α(pYES2-UGT),提取质粒,以此为模板,用P1和P2引物进行PCR鉴定,用BamHⅠ进行单酶切鉴定,其结果分别见图2(b)和2(c),与预期相符,预期的2个片段大小分别为:6668 bp,536 bp。将鉴定后的重组质粒导入YPH499挑阳性克隆,即为重组菌YPH499(pYES2-UGT)。
2.2 重组酶的活性测定
活化后的重组菌按2%接种量转接新鲜SC-U中,30℃,培养48 h,使菌体生物量积累。室温洗菌,集菌,菌体移至SCGal-U培养基中诱导,30℃,12 h。诱导后菌体,加入YeastBuster蛋白抽提试剂处理,破碎细胞,离心所得酶粗提液进行酶活测定。在1.5 mL的反应体系中(1.2 mmol/L ST苷、4 mmol/L UDPG、3 mmol/L MgCl2、10 μg/mL BSA、pH=7.2),重组菌YPH499(pYES2-UGT)的酶活性为7.1 U/mg湿菌体。液相结果如图3所示,1.2 mmol/L ST苷最终转化生成0.63 mmol/L RA苷,转化率达到55%。

图2 UGT的基因扩增与重组质粒pYES2-UGT的鉴定
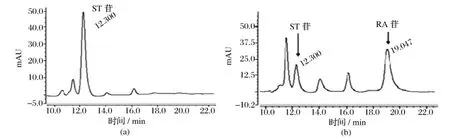
图3 粗酶液催化ST苷生成RA苷的HPLC图谱
2.3 全细胞催化体系的初步建立
2.3.1 通透剂对全细胞催化的影响
底物只有进入细胞后才能在胞内酶的催化下进行有效的转化,因此,细胞膜通透性成为全细胞催化反应所需考虑的首要问题。在添加UDPG条件下考察了吐温80、TritonX100浓度为1%(v/v),CTAB、普郎尼克F68为1%(g/L)等几种物质对细胞膜通透性的影响。将诱导表达后的重组菌体离心,按1.7小节所述进行全细胞催化反应,结果如图4所示。
可以看出,未添加任何通透剂时,几乎检测不到RA苷的量;而加入通透剂后,ST苷与UDPG能够进入细胞,在重组菌诱导产生的UGT76G1糖基转移酶的催化下,将ST苷转化为甜度更高的RA苷。其中,作为一种新型的高分子非离子表面活性剂,普郎尼克F68在此转化体系中表现出较佳的通透性。
2.3.2 以葡萄糖作为辅底物建立全细胞催化体系

图4 通透剂对全细胞催化的影响
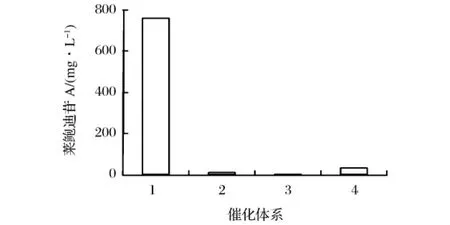
图5 全细胞催化体系的建立
从图5可以看出,加入1%(g/L)普郎尼克F68条件下,直接添加葡萄糖时,RA苷无明显合成;但是当在添加葡萄糖的同时加入柠檬酸钠时,转化生成的RA苷量较明显,可达到32 mg/L。这种有效的转化结果可能是由于柠檬酸是糖酵解途径中6-磷酸果糖激酶的有效抑制剂,即在一定程度上抑制了糖酵解途径,促使6-磷酸葡萄糖转化成1-磷酸葡萄糖,进而提高了UDPG的合成量。
2.4 全细胞催化体系的条件优化
2.4.1 柠檬酸钠浓度的影响。
考察了不同柠檬酸钠浓度对全细胞催化合成RA苷的影响,结果如图6所示。其它反应条件:MgCl24 g/L,pH7.0,30℃。

图6 不同柠檬酸钠浓度对全细胞催化的影响
柠檬酸钠浓度1~15 g/L时,RA苷的生成量逐渐增加;在15 g/L时,RA苷量达到最高;当浓度在15~25 g/L时,RA苷量呈现明显下降趋势。这说明添加适量浓度的柠檬酸钠,对调节酵母代谢途径从而促进UDPG生成起到较大作用,而过高浓度的柠檬酸钠可能对糖酵解途径抑制较大,从而使酵母基本代谢受到影响。
2.4.2 pH的影响
考察了不同pH的缓冲液对全细胞催化合成RA苷的影响,结果如图7所示。反应条件:柠檬酸钠15 g/L,MgCl24 g/L,30℃。
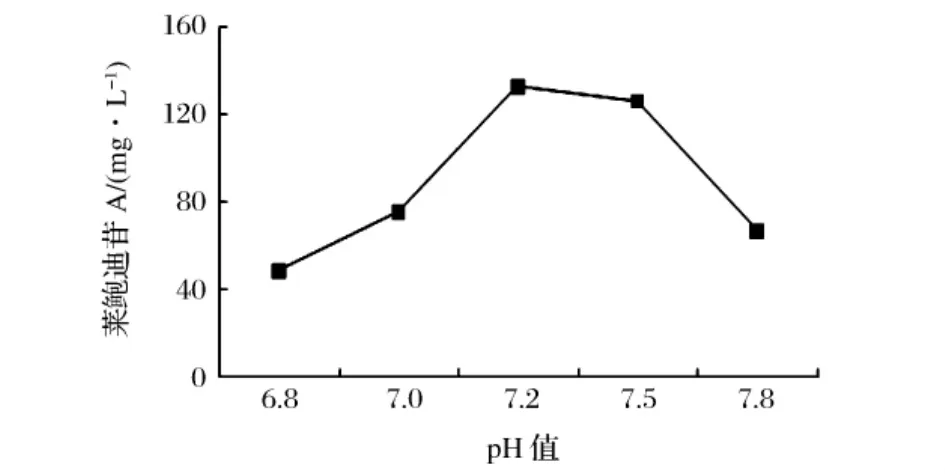
图7 不同催化反应pH对全细胞催化的影响
pH≤7.0时,RA苷生成量较低,这可能是由于在酸性缓冲液中UGT7G1酶的活性较低所致,因为在对该酶的性质进行研究时,我们发现该酶在pH<7.0时,酶活性很低;当pH为7.2~7.5时,RA苷的量较高;pH为7.8时,RA苷量骤然减少,这可能是由于碱性较强的溶液中Mg2+易沉淀,从而影响酶活性。因此,本研究中重组细胞催化合成RA苷反应缓冲液的最佳pH为7.2。
2.4.3 MgCl2浓度的影响
考察了不同Mg2+浓度对全细胞催化合成RA苷的影响,结果如图8所示。反应条件:柠檬酸钠15 g/L,pH 7.2,30℃。
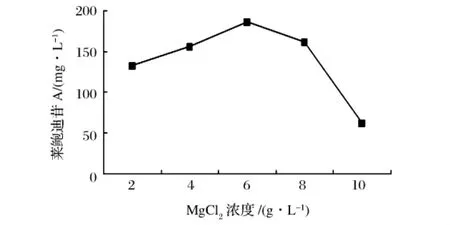
图8 不同MgCl2浓度对全细胞催化的影响
催化反应MgCl2浓度在2~6 g/L时,RA苷生成量随着MgCl2浓度的升高逐渐增加;RA苷量在MgCl2浓度6 g/L时达到最大值(187 mg/L),之后骤然下降,MgCl2浓度为10 g/L时,RA苷的量较低。陈睦传等人提出,催化合成UDPG的尿嘧啶核苷二磷酸葡萄糖焦磷酸化酶是依赖Mg2+的催化反应[11],适宜浓度的Mg2+可以提高酶活。因此,本研究中重组细胞催化反应较佳MgCl2浓度为6 g/L。
2.4.4 温度的影响
考察了不同温度下重组菌催化合成RA苷量的变化,结果如图9所示。反应条件:柠檬酸钠15 g/L,MgCl26 g/L,pH 7.2。

图9 不同温度对全细胞催化的影响
当催化反应温度≤37℃时,RA苷生成量随着温度的升高而增加,说明在25~37℃间提高温度对RA苷量有一定促进作用。这可能是一方面温度的提高,有利于提高重组菌的UGT76G1酶活性;另一方面可能是由于温度变化时,酵母会在体内储备糖原来应对暂时环境条件的变化[7-8],而糖原合成途径有利于促进UDPG生成。在37~42℃时,RA苷量逐步减少,这可能是由于太高的温度影响了菌体内大部分酶的活性,有文献提到,尿嘧啶核苷二磷酸葡萄糖焦磷酸化酶UDPG-PPLase于41℃时活性大部分丧失[11]。在37℃时,RA苷的量达到最高,为267.89 mg/L,因此,本研究中此全细胞催化反应以37℃为佳。
3 讨论
本研究构建了表达甜叶菊UDP糖基转移酶UGT76G1的重组酿酒酵母YPH499(pYES2-UGT),将重组细胞用于催化合成RA苷的研究中。建立了通过调节酵母细胞内由葡萄糖合成UDPG的代谢途径增强其通量的方法,优化后重组细胞催化ST苷合成RA苷的反应条件为:ST苷1 g/L,葡萄糖20 g/L,普郎尼克F6810 g/L,MgCl26 g/L,柠檬酸钠15 g/L,pH 7.2,细胞密度200 g湿细胞/L反应液,反应温度37℃,反应时间48 h,优化后RA苷的生成量可达267.89 mg/L。生物全细胞转化方法提高RA苷相对含量的策略对于提高甜菊糖品质具有一定的潜在研究价值,对酿酒酵母UDPG相关代谢途径的研究以及提高UGT76G1活性的相关研究将作为后继工作的重点。
[1]陈慕英,于喜水,孙玉华,等.甜菊苷类的研究[J].中医药信息,2001,18(3):23-24.
[2]Geuns JMC.Stevioside[J].Phytochemistry,2003,64(5):913-921.
[3]Brandle JE.Steviol glycoside biosynthesis[J].PhytoehemiStry,2007,68(14):1855-1863.
[4]Humphrey TV,Richman AS,Menassa R,et al.Spatial organisation of four enzymes from Stevia rebaudiana that are involved in steviol glycoside synthesis[J].Plant Molecular Biology,2006,61(1):47-62.
[5]唐香山,张学文.酿酒酵母表达系统[J].生命科学研究,2004,S1:106-109.
[6]Dragan CA,Buchheit D,Bischoff D,et al.Glucuronide production by whole-cell biotransformation using genetically engineered fission yeast Schizosaccharomyces pombe[J].Drug Metabolism and Disposition,2010,38(3):509-515.
[7]Parrou JL,Teste MA,Franqois J.Effects of various types of stress on the metabolism of reserve carbohydrates in Saccharomyces cerevisiae:genetic evidence for a stress-induced recycling of glycogen and trehalose[J].Microbiology,1997,143(6):1891-1900.
[8]Wilson WA,Roach PJ,Montero M,et al.Regulation of glycogenmetabolisminyeast and bacteria[J].FEMS Microbiology Reviews,2010,34(6):952-985.
[9]萨姆布鲁克J,拉塞尔DW.分子克隆实验指南[M].黄培堂,译.3版.北京:科学出版社,2002:1601-1604.
[10]Richman A,Swanson A,Humphrey T,et al.Functional genomics uncovers three glucosyltransferases involved in the synthesis of the major sweet glucosides of Stevia rebaudiana[J].Plant Journal,2005,41(1):56-67.
[11]陈睦传,李里焜,洪维廉,等.甜菊叶片细胞UDPG PPLase基本特征及电镜细胞化学定位[J].厦门大学学报,1993,32(05):634-641.
ABSTRACTThe synthetic UDP glycosyl-transferase UGT76G1 coding gene with modification was inserted into the vector pYES2 with the restriction site of EcoR I and Xho I to construct the recombinant Saccharomyces cerevisiae YPH499(pYES2–UGT)strain,which can express UDP glycosyl-transferase UGT76G1.A whole cell catalysis method for adjusting UDPG synthesis metabolic pathway of the yeast cell was established by providing glucose for carbon source and enhancing the UDPG flux with the substrate Stevioside.The optimal conditions for the whole cell catalysis system were as follows:1 g/L Stevioside,20 g/L glucose,10 g/L PluronicF68,6 g/L MgCl2,15 g/L citric acid sodium,pH 7.2,the cell density was 200 g wet cells/L reaction solution,the reaction temperature was 37℃,the reaction time was 72 h.Under the optimal conditions,the output of Rebaudioside A could reach 267.89 mg/L.
Key wordsstevioside,rebaudioside A,glycosyl-transferase,UGT76G1,whole cell catalysis
Biosynthesis of Rebaudioside A by Whole Cell of Recominant Saccharomyces cerevisiae
Liu Huan,Li Yan,Yang Ming,Chen Sheng,Hao Ning,Xu Lin
(Biotechnology and Pharmaceutical Engineering,Nanjing University of Technology,Nanjing 210009,China)
硕士研究生(李艳为通讯作者)。
*国家自然科学基金项目(21106068);江苏省自然科学基金项目(BK2011801);高等学校博士学科点专项科研基金(20113221120002);江苏省普通高校自然科学研究计划项目(10KJB530004)。
2012-03-14,改回日期:2012-05-03
