响应面分析法优化脐橙皮中多酚类物质提取工艺
2012-09-11冯卫华白卫东谭杏婷
秦 艳,冯卫华,*,白卫东,2,谭杏婷,沈 棚
(1.仲恺农业工程学院轻工食品学院,广东广州 510225;2.华南农业大学食品学院,广东广州510642)
响应面分析法优化脐橙皮中多酚类物质提取工艺
秦 艳1,冯卫华1,*,白卫东1,2,谭杏婷1,沈 棚1
(1.仲恺农业工程学院轻工食品学院,广东广州 510225;2.华南农业大学食品学院,广东广州510642)
目的:利用响应面优化法对脐橙皮粗多酚的提取条件进行优化。方法:在单因素实验基础上选取实验因素与水平,根据Box-Behnken Design(BBD)实验设计原理采用三因素三水平的响应面分析法,依据回归分析确定各工艺条件的影响因素,以脐橙皮多酚物质含量为响应值作响应面分析实验。结果:分析各个因素的显著性和交互作用后,得出脐橙皮多酚物质浸提的最佳工艺条件为乙醇体积分数51%、浸提温度62℃、浸提时间2h、料液比1∶20(w/v)、浸提2次,脐橙皮多酚物质一次提取含量可达20.2mg/g。结论:曲面回归方程与实验结果拟合性好,此模型合理可靠,可用于实际预测。
脐橙皮,多酚物质,响应面分析
Abstract:Objective:The main research object was navel orange peel.Besides,an optimization of extraction process for from navel orange peel was established.Methods:Based on the single factor analysis,a 3-factor,3-level Box-Behnken experimental design was applied to evaluate the effect of the three factors,including extraction temperature,ethanol concentration and ratio of material to liquid.Results:The optimal extraction conditions were ethanol concentration of 51%(v/v),extraction temperature 62℃,extraction time 2h,solid-toliquid ratio 1∶20(w/v) and 2 times for extraction.Temperature was the most important affecting factor of polysaccharide extraction,followed by ethanolconcentration.Under such extraction conditions,the experimental yield of polyphenols obtained after the first extraction was up to 20.2mg/g.Condusion:It was close to predicted value.
Key words:navel orange peel;polyphenols;response surface methodology
脐橙人称“柑橘之王”[1],是芸香科植物甜橙Citrus sinensis(L.)Os-beck栽培品种的成熟果实,是柑橘品种最优良的一个甜橙种类,其营养丰富,含有人体所必需的各种营养成分。柑橘加工过程中,皮渣是主要副产品,占总量的20%~40%[2]。脐橙皮渣中含有大量的植物活性成分——多酚,植物多酚为植物体内的复杂酚类次生代谢物,主要存在于植物的皮、根、叶、果中,在植物中的含量仅次于纤维素、半纤维素和木质素[3]。许多实验研究资料均显示,植物多酚具有抗肿瘤、抗病毒、抗衰老等方面的生理活性。多酚的这些生理活性与其具有的清除自由基和抗氧化性能密切相关[4]。研究表明,多酚的抗氧化能力很强,它在阻止血脂升高的同时,还可以增加高密度脂蛋白的含量[5]。因此,植物多酚已被称作人类健康的“第7营养素”。多酚可用在保健食品中,起到强身健体的功效,也可用于食品中,以延长食品的货架期[6]。多酚类物质能够明显抑制多种细菌、真菌、病毒和溃疡,控制感染性疾病的发生[7-9]。同时,植物多酚在抗诱变、抗肿瘤、抗病毒、抗微生物、抗衰老等方面具有良好的作用,对一些严重危害人体健康的疾病如高血压、心脏病、癌症等具有一定的治疗或预防作用[10-13]。本文在单因素实验的基础上,选用响应面优化法对脐橙皮渣中多酚的提取进行了优化,期望为脐橙皮多酚方面的研究工作者们提供一定的参考数据。
1 材料与方法
1.1 材料与仪器
橙皮粉 脐橙,购于广州好有多超市,脐橙手工去皮,除去脐橙皮内部缨络,将脐橙皮在50℃下恒温干燥,而后粉碎,过40目筛,橙皮粉密封后于常温下保存备用;没食子酸、福林酚试剂 Sigma Chemical Co.,St.Louis,MO;Na2CO3,无水乙醇。
DU730型紫外可见分光光度计 美国BECKMAN COUCTER;HY-2型调速多用振荡器 国华电器有限公司;FA1004型电子天平 北京赛多利斯仪器系统有限公司;DZKW-4型电热恒温水浴锅 北京中兴伟业仪器有限公司;RE52-C型旋转蒸发仪 巩义市予华仪器设备有限公司;800型电动离心机 江苏金城国盛实验仪器厂。
1.2 多酚(TPC)的测定
1.2.1 没食子酸标准曲线的建立 精确称取没食子酸0.50g,定容至100mL容量瓶中,再取此液1mL稀释至100mL,得浓度为0.05mg/mL的标准溶液。精确量取0、0.1、0.3、0.5、0.7、0.9mL置于10mL的离心管中,对应的没食子酸含量分别为5、15、25、35、45μg,分别加入3mL蒸馏水,0.25mL的福林酚,1min后加入20%(w/v)Na2CO3溶液0.75mL混匀,用蒸馏水定容至5mL,混合液于75℃恒温下水浴10min后,立即冰浴,离心(4500r/min,15min),于760nm波长测定吸光度值,以蒸馏水为对照。用Excel软件对数据进行分析,以没食子酸的含量为横坐标,吸光度值为纵坐标,得一元线性回归方程。
1.2.2 多酚含量的测定 采用福林-肖卡法[14]。精确移取0.5mL多酚粗提液,按照绘制标准曲线方法显色,于最大吸收波长760nm处测吸光度并计算含量。脐橙皮多酚的含量表示为每克干重样品中含有的多酚量(以没食子酸计,mg/g)。
1.3 单因素实验
选用乙醇溶剂浸提法作为提取方法。对可能影响脐橙皮多酚得率的几个因素(乙醇体积分数、料液比、提取时间和提取温度)分别做单因素实验,按照多酚的测定方法(福林-肖卡法),计算多酚含量。
1.3.1 乙醇体积分数的确定 称取2g左右的脐橙皮粉,分别选用体积分数为30%、40%、50%、60%与70%的乙醇溶液作为提取液,料液比(w/v):1∶20,在室温下避光提取3h,过滤得到滤液,立即测定其多酚含量。
1.3.2 料液比的确定 称取2g左右的脐橙皮粉末,选用体积分数为60%的乙醇溶液作为提取液,料液比(w/v):1∶5、1∶10、1∶15、1∶20、1∶25,在室温下避光提取3h,过滤得到滤液,以1∶25所得滤液体积为标准,用60%的乙醇定容至该体积,立即测定其多酚含量。
1.3.3 提取温度的确定 称取2g左右的脐橙皮粉末,选用体积分数为60%的乙醇溶液作为提取液,料液比(w/v)为1∶20,分别在室温(25℃)、40、50、60、70、80、90℃下避光提取3h,过滤得到滤液,立即测定其多酚含量。
4)实时交通路况和天气预报技术。实时交通信息除包括城市道路拥堵情况外,还应该包括整个区域的交通状况,路面的维修情况,路面情况等。实时天气不仅指当年某个市或县当天的天气预报,还应包括即将发生或者已经发生的灾害性气象,出行目的地的天气状况等,具备动态的交通和天气状况,才能为客货运输、交通出行带来很大方便。
1.3.4 提取时间的确定 称取2g左右的脐橙皮粉末,选用体积分数为60%的乙醇溶液作为提取液,料液比(w/v):1∶20,在室温下避光分别提取1、2、3、4、5、6h,过滤得到滤液,立即测定其多酚含量。
1.4 提取条件的优化
根据单因素实验对乙醇体积分数、料液比、提取时间、提取温度进行综合考虑,采用三因素三水平,根据Box-Behnken Design(BBD)设计法设计响应面实验,分析脐橙皮多酚在不同提取条件下的含量,从而优化出最佳提取条件。实验因素与水平设计见表1。
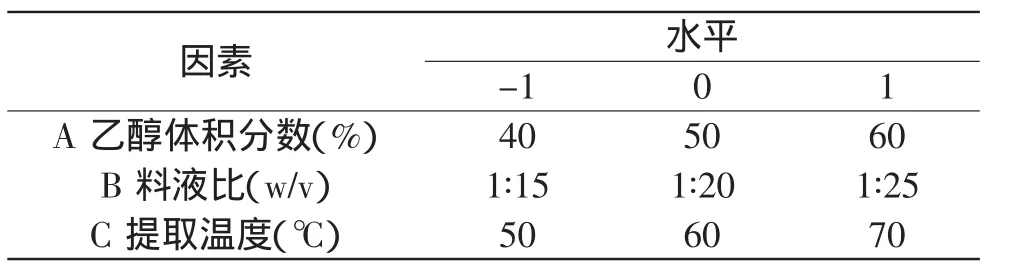
表1 响应面因素水平表Table 1 Factors and levels in response surface analysis
1.5 验证实验
以脐橙皮为材料,采用优化的提取条件浸提,过滤得到滤液,立即测定提取液中的多酚含量。
1.6 浸提级数的确定
以脐橙皮为材料,采用优化的提取条件连续重复提取三次,立即测定每次提取液中的多酚含量。
2 结果与分析
2.1 标准曲线的建立
采用采用福林-肖卡法绘制没食子酸标准曲线,得没食子酸含量(X)与吸光值(Y)之回归方程方程Y=0.0182X-0.0444,R2=0.9916。样品中总酚含量以没食子酸含量表示。
2.2 单因素实验
2.2.1 乙醇体积分数对脐橙皮多酚含量的影响 由于乙醇浸提的选择性好,对植物细胞的穿透能力强,浸出率高,提取时间短,溶解出的杂质少,提取物不易霉变,且乙醇毒性小,因此,参照有关文献[15],并在预备实验的基础上选用乙醇作为提取溶剂。又由于高温、日照均不利于多酚的稳定[16],因此本研究采用常温避光提取。
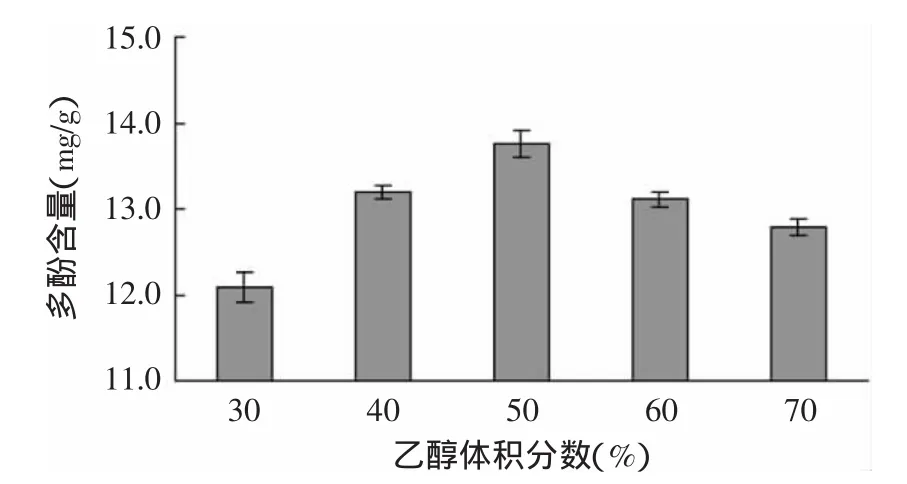
图1 乙醇体积分数对脐橙皮多酚含量的影响Fig.1 Effect of ethanol concentration on extraction rate of polyphenols from navel orange peel
图1为在室温(25℃)、料液比1∶20(w/v)、避光提取3h的条件下,乙醇体积分数对脐橙皮提取液中多酚含量的影响。当乙醇体积分数数达到50%时,提取液中多酚含量最大,之后随着体积分数的增大,含量反而降低。主要是因为乙醇体积分数不同,极性也不同[17],当乙醇体积分数为50%左右时,可能与脐橙皮多酚的极性相似,故脐橙皮多酚的溶解度最大;而乙醇体积分数偏离50%时,均不利于脐橙皮多酚的提取。因此,乙醇体积分数选定在50%左右为宜。
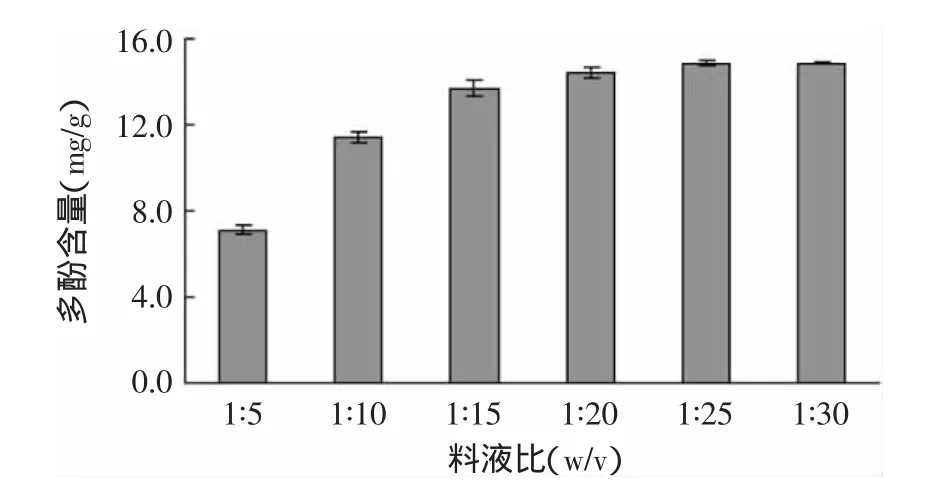
图2 料液比对脐橙皮多酚含量的影响Fig.2 Effect of material-to-liquid ratio on extraction rate of polyphenols from navel orange peel
2.2.3 提取温度对脐橙皮多酚含量的影响 图3为选用60%乙醇溶液为提取剂,在料液比为1∶20,避光提取3h的条件下,提取温度对脐橙皮提取液多酚含量的影响。当温度达到60℃时,提取液中多酚的含量达到最大,之后随着温度的升高含量反而降低。温度是影响提取的重要因素之一。在一定的温度范围,提高温度可能有利于多酚的提取;但是由于多酚中含有大量的酚羟基,其化学性质及其活泼,某些酚类物质在较高的温度下不稳定[19],故当提取温度超过60℃时,脐橙皮多酚的含量随着温度的升高反而降低。Antolovich[19]的研究也发现,当温度达到60℃后,多酚提取含量显著下降。因此,脐橙皮多酚的提取温度选为60℃左右。
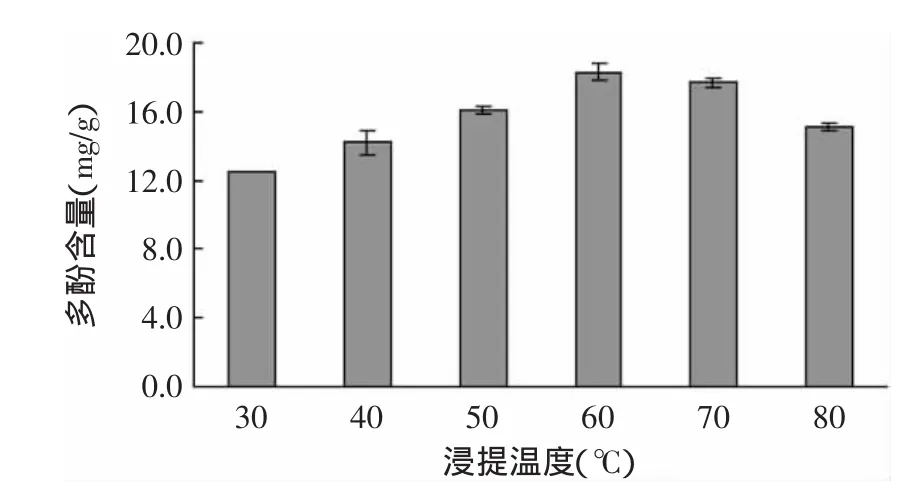
图3 温度对脐橙皮多酚含量的影响Fig.3 Effect of temperature on extraction rate of polyphenols from navel orange peel
2.2.4 提取时间对脐橙皮多酚含量的影响 图4为选用60%乙醇溶液作为提取剂、在室温(25℃)、料液比1∶20的条件下,提取时间对脐橙皮提取液多酚含量的影响。脐橙皮提取液中多酚含量在2、3、4、5h时显著高于1h(p<0.05);当提取时间超过2h后,延长提取时间,提取液中多酚含量无显著差异(p<0.05),但呈现下降趋势,故延长提取时间有利于多酚的提取。但是由于多酚易氧化[20],提取时间过长反而会破坏多酚类物质的酚羟基结构,导致其得率降低[21]。因此,提取时间选定为2h。
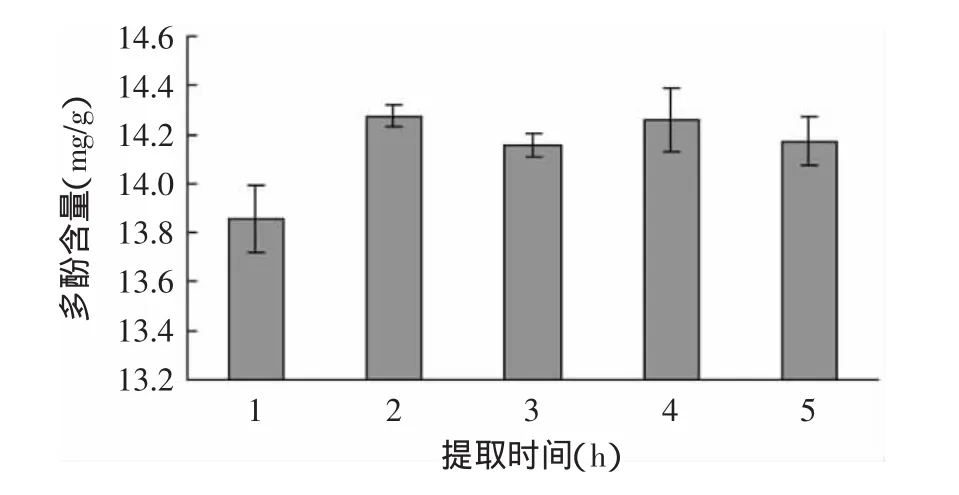
图4 提取时间对脐橙皮多酚含量的影响Fig.4 Effect of time on extraction rate of polyphenols from navel orange peel
2.3 响应面法优化脐橙皮多酚提取工艺
2.3.1 响应面分析因素水平的选取 根据Box-Behnken的中心组合实验设计原理,结合上述单因素影响的实验结果,选取乙醇体积分数(A)、料液比(B)和提取温度(C)3个影响因素,在单因素实验的基础上采用三因素三水平的响应曲面分析方法,共15个实验点。由Box-Behnken Design设计方案所得的实验结果见表2。
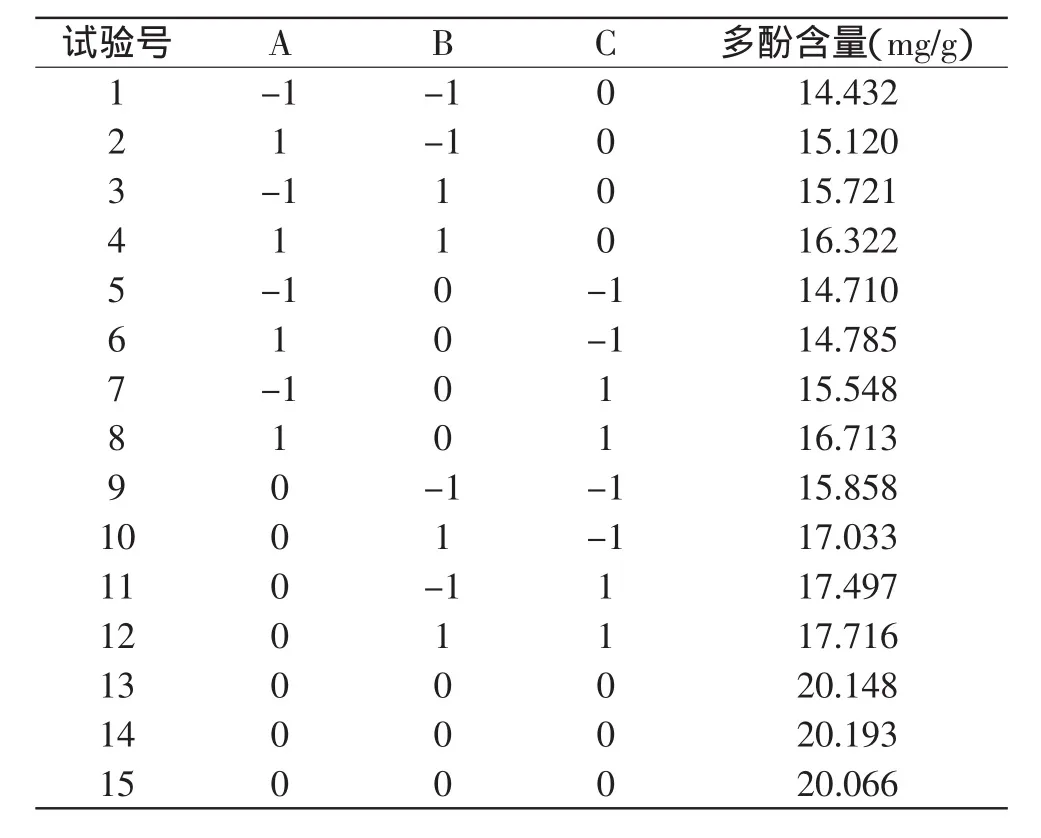
表2 Box-Behnken设计方案及其响应值Table 2 Box-Behnken experimental design and corresponding experimental polysaccharide yields
2.3.2 数学模型及其显著性检验 按照Design Expert软件中的Box-Behnken Design模型对表2的数据进行多元回归拟合,得到多酚含量对乙醇体积分数(A)、液料比(B)、提取温度(C)的二次多项回归模型为:Y=20.14+0.32A+0.49B+0.64C-3.16A2-1.57B2-1.53C2-0.022AB+0.27AC-0.24BC,对该模型进行显著性检验,结果见表3,回归模型系数显著性检验见表4。

表3 多酚提取回归模型的方差分析结果Table 3 Analysis of variance for quadratic polynomial modeI of polyphonoI extraotion
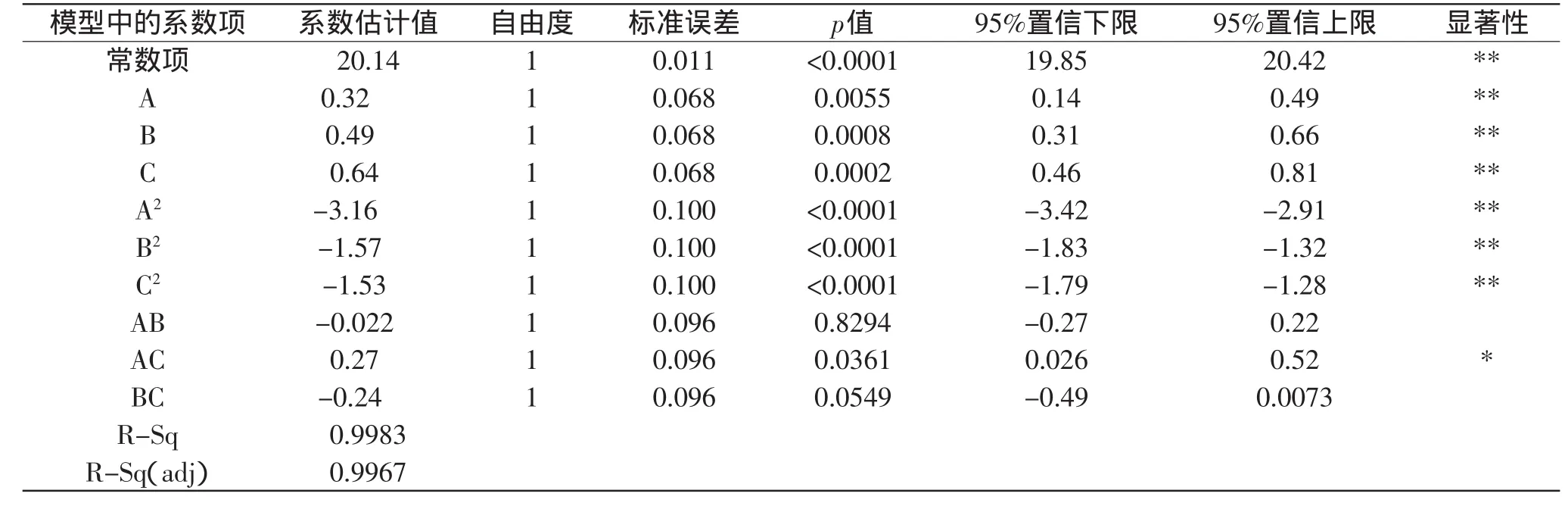
表4 多酚提取回归方程系数显著性检验结果Table 4 Test result of significance for regression coefficient of polyphenol extraction
由表3可知,整体模型显著性水平p<0.01,表明二次方程模型达到极显著水平;同时失拟项p=0.0681>0.05,表明差异不显著,说明残差均由随机误差引起。由表4可知,调整系数R2=0.9967,说明响应值的变化有99.67%来源于所选变量,即提取温度、乙醇体积分数和料液比;相关系数R为0.9983,表明实测值与预测值高度相关。综合以上所述,说明模型拟合程度良好,实验误差小。因此,该模型可较好地描述各因数与相应值之间的真实关系,可利用模型来分析和预测脐橙皮多酚的提取工艺结果。
由表4回归模型系数显著性检验结果可知,回归方程的一次项A、B、C显著,并且可看出影响顺序为:C>B>A,即:提取温度>料液比>乙醇体积分数;二次项A2、B2、C2极显著;交互项除AC外,其他均不显著(p>0.05)。
2.3.3 响应面优化与分析 利用Design Expert 7.1.6软件,绘制各影响因素对脐橙皮多酚含量的响应曲面图,考察所拟合的响应面的形状,分析乙醇体积分数(A)、料液比(B)和提取温度(C)对脐橙皮多酚含量的影响。如果一个响应曲面坡度相对平缓,表明其可以忍受处理条件的变异,而不影响到响应值的大小,相反,如果一个响应曲面坡度异常陡峭,表明响应值对于处理条件的改变非常敏感[22]。
比较图5~图7可知,乙醇浓度、料液比和提取时间对脐橙皮多酚含量的影响极为显著,表现为曲面较陡,其中提取温度对脐橙皮多酚含量的影响最大。另外,结合等高线的疏密程度可看出,图6响应面曲面较陡且等高线较紧密,故乙醇体积分数与提取温度之间的交互作用比较强,而乙醇体积分数与料液比、料液比与提取温度之间两两交互作用比较弱。
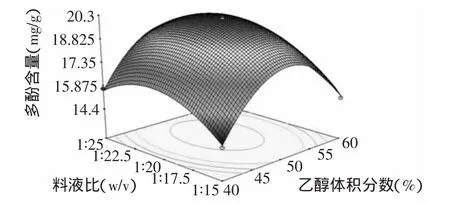
图5 乙醇体积分数与料液比对多酚含量的影响Fig.5 Effect of ethanol concentration and material-to-liquid ratio on extraction rate of polyphenols
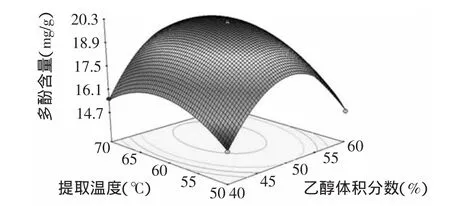
图6 乙醇体积分数与提取温度对多酚含量的影响Fig.6 Effect of ethanol concentration and extracting temperature on extraction rate of polyphenols
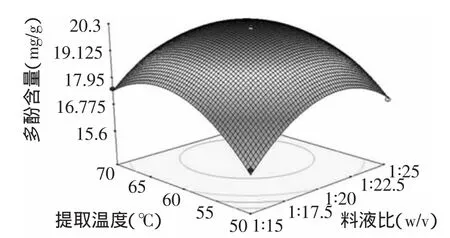
图7 提取温度与料液比对多酚含量的影响Fig.7 Effect of extracting temperature and extracting time on extraction rate of polyphenols
2.3.4 优化与验证 从上述回归模型中求得最优工艺条件为体积分数50.58%,料液比1∶20.69,温度62.01℃,脐橙皮提取液多酚含量的理论值为20.24mg/g。由于以上最佳条件未包括在响应面优化的15组实验中,需进一步进行实验验证。为了操作方便,将以上条件修正为乙醇体积分数51%、提取温度62℃、料液比1∶20。验证实验结果表明,在最佳提取条件下,脐橙皮提取液多酚含量为20.2mg/g(RSD=0.58%),与预测值相差不大,说明该方程与实际情况拟合很好,充分验证了所建模型的正确性,说明响应面法适用于脐橙皮多酚提取工艺进行回归分析和参数优化。
2.4 浸提次数的确定
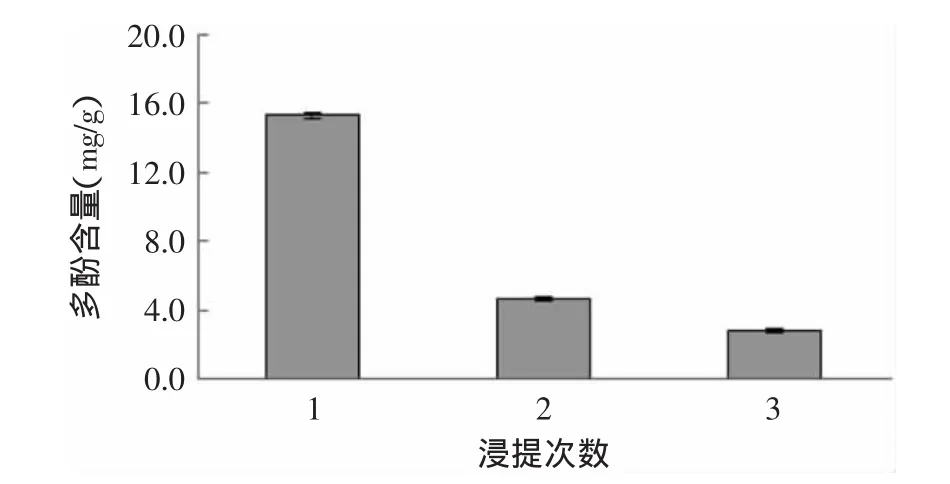
图8 浸提次数对脐橙皮多酚含量的影响Fig.8 Effect of extraction number on extraction rate of polyphenols from navel orange peel
图8为选用51%乙醇溶液为提取液,在温度62℃、提取2h、料液比1∶20的条件下连续重复提取脐橙皮多酚3次,测定每次提取液的多酚含量。每次提取占总的多酚提取量的比例分别为72.10%、18.58%和9.33%。前两次提取的多酚量占总提取量的90.67%。因此,本研究确定浸提次数为2次。
3 结论
在单因素的实验基础上,运用响应面实验方法,结合回归模型的数学分析,对脐橙皮多酚提取工艺进行了优化。通过实验得到的最优工艺参数为乙醇体积分数51%、浸提温度62℃、浸提时间2h、料液比1∶20(w/v)、浸提2次,在此条件下,脐橙皮多酚得率可达20.2mg/g。
[1]胡正月,朱清能,谢日星.国外脐橙育种与栽培概况综述[J].江西园艺,2000(5):29-30.
[2]刘晓军.柑橘加工副产品加工利用[J].农产品加工·学刊,2007(11):29-30.
[3]王旗,刘恩岐.植物多酚的研究现状[J].山西农业科学,2009,37(1):92-94.
[4]宋立江,狄莹.植物多酚的研究与利用的意义及发展趋势[J].化学进展,2004,5(2):162.
[5]李雪莹,王文杰.植物单宁的生理作用及经济价值[J].内蒙古林业科技,2004,4(4):22.
[6]Abram V,Donko M.Tentative Identification of polyphenols in sempervivum tectorum and assessment of the antimicrobial activity of sempervivum L[J].J Agric Food Chem,1999,47(2):485-489.
[7]Chung KT, Wong TY, Wei CI, et al.Tannins and human health:A review[J].Crit Rev Food Sci,1998,38:421-464.
[8]Ikken Y,Morales P,Martinez A,et al.Antimutagenic effect of fruit and vegetable ethanolic extracts against N-nitrosamines evaluated by the Ames test[J].J Agric Food Chem,1999,47(8):3257-3264.
[9]Vilevas W,Sanomimiya M,Rastrelli L,et al.Isolation and structure elucidation of two new flavonoid glycosides from the infusion of maytenus aquifolium leaves.Evaluation of the antiulcer activity of the infusion[J].J Agric Food Chem,1999,47(2):403-406.
[10]Hertog MGL, Hollman PCH,van de Putte B.Content of potencially anticarcinogenic flavonoids of tea infusion,wines,and fruit juices[J].J Agric Food Chem,1993,41(8):1242-1246.
[11]Dupont MS,Bennet RN,Mellon FA,et al.Polyphenols from alcoholic apple cider are absorded,metabolized,and excreted by humans[J].J Nutr,2002,132(2):172-175.
[12]Leontowiez H,Gorinstein S,Loejej A,et al.Comparative content of some bioactive compounds in apples,peaches,and pears and their influence on lipids and antioxidant capacity in rats[J].J Nutr Biochem,2002,13(10):603-610.
[13]Chinnici F,Bendini A,Gaiani A,et al.Radical scavenging activities of peels and pulps from cv.Golden Delicious apples as related to their phenolic composition[J].J Agric Food Chem,2004,52(15):4684-4689.
[14]雷昌贵,陈锦屏,卢大新,等.食品中多酚类化合物的测定方法及其研究进展[J].食品发酵与工业,2007,33(1):100-104.
[15]Hinneburg I,Neubert RHH.Influence of Extraction parameters on the phytochemical characteristics of extracts from buckwheat(Fagopyrum esculentum) Herb[J].J Agric Food Chem,2005,53(1):3-7.
[16]彭长连,林植芳,林桂珠.光对大本植物叶片清除有机自由基能力的影响[J].植物学报,2000,42(4):393-398.
[17]伍春,徐立,刘骏驰,等.响应曲面法优化新疆药桑桑皮总多酚提取工艺[J].食品科学,2011(2):104-107.
[18]Rubilar M,Pinelo M,Ihl M,et al.Murta leaves (Ugni molinae Turcz)as a source of antioxidant polyphenols[J].J Agric Food Chem,2006,54(1):59-64.
[19]Antolovich M,Pernzler P,Robards K,et al.Sample preparation in the determination of phenolic compounds in fruits[J].Analyst,2000,125:989-1009.
[20]Cillers JJL,Singleton VL.Characterization of the products of nonenzymic autoxidative phenolic reaction in a caffeic acid modelsystem[J].J Agric Food Chem,1991,39(7):1298-1303.
[21]邓仕任,夏林波.响应面法优化芫花总黄酮的提取工艺[J].中国食品添加剂,2012(2):70-76.
[22]陈莉,屠康,王海,等.采用响应面曲面法对采后红富士苹果热处理条件的优化[J].农业工程学报,2006,22(2):159-163.
Optimization of polyphenol extraction from navel orange peel by response surface methodology
QIN Yan1,FENG Wei-hua1,*,BAI Wei-dong1,2,TAN Xing-ting1,SHEN Peng1
(1.College of Light Industry and Food,Zhongkai University of Agriculture and Engineering,Guangdong Guangzhou 510225,China;2.College of Food Science,South China Agricultural University,Guangzhou 510642,China)
TS201.2
B
1002-0306(2012)20-0231-06
2012-06-27 *通讯联系人
秦艳(1986-),女,在读研究生,研究方向:果蔬贮藏与加工、生物活性成分提取纯化及功能分析。
广东省教育部产学研结合项目(2010B090400257);广东省科技计划农业攻关项目(2011A020202010);广东省科技计划社会发展项目(2011B031000001)。
