疏棉状嗜热丝孢菌耐热脂肪酶在无孢黑曲霉中的高效表达
2012-09-11李德明
陈 婧,王 斌,李德明,潘 力
(华南理工大学生物科学与工程学院,广东广州510006)
疏棉状嗜热丝孢菌耐热脂肪酶在无孢黑曲霉中的高效表达
陈 婧,王 斌,李德明,潘 力*
(华南理工大学生物科学与工程学院,广东广州510006)
综合考虑密码子偏爱性、RNA稳定性以及自由能等因素,对疏棉状嗜热丝孢菌(Thermomyces lanuginosus)耐热脂肪酶(tll)基因序列进行密码子优化并全基因合成。将合成的tll基因连接到克隆载体,然后亚克隆到表达载体pHGWPT-tll,采用根癌农杆菌介导转化无孢黑曲霉SH-2。经过三丁酸甘油酯平板、SDS-PAGE以及Western Blotting鉴定,成功表达了tll基因。发酵72h,转化子脂肪酶酶活最高达36U/mL。转化子经等离子诱变得到的突变株的脂肪酶比活力比出发菌株提高约37%。
疏棉状嗜热丝孢菌,耐热脂肪酶,黑曲霉,重组表达
Abstract:We optimized the codon usage of Thermomyces lanuginosus lipase(tll) gene based on codon usage bias,RNA stability and free energy,and synthesized the optimized tll gene.The obtained tll gene was inserted into a clone vector,and then subcloned to the expression vector pHGWPT-tll.The vector pHGWPT-tll was transformed into non-spore Aspergillus niger SH-2 via Agrobacterium tumefaciens-mediated transformation using hygromycin B resistant gene as the selection marker.A.niger transformants bearing the tll gene,were selected by tributyrin hydrolyzing plate.The recombinant protein was verified by SDS-PAGE and Western blotting.After 72h fermentation,the lipase activity of transformants reached 36U/mL.Furthermore,the tll transformants was subjected to mutagenesis via atmospheric and room temperature plasma(ARTP).The specific activity of the mutants was 37%higher than that of the original transformants,suggesting that tll gene could be highly expressed in A.niger.
Key words:Thermomyces lanuginosus;thermostable lipase;Aspergillus niger;recombinant expression
黑曲霉具有很强的蛋白分泌能力[1],蛋白产量可达到30g/L以上[2],是重要的蛋白生产平台之一[2-4],被美国FDA认定为安全菌株(GRAS),使其在各领域中受到的关注与日俱增[5]。随着根癌农杆菌介导的转化(Arobacterium tumefaciens mediated transformation,ATMT)在丝状真菌中的成功应用[6-10],黑曲霉更多被作为转化宿主进行外源基因表达[11]。一般黑曲霉分生孢子头呈褐黑色、分生孢子梗长短不一(图1A),本研究使用的无孢黑曲霉为工业诱变菌,有很强的糖化酶分泌能力,不产孢子、菌落呈乳白色且菌丝短小(图1B)。粗短的菌丝易形成小而松散的菌球,有益于代谢产物的产生[12],因此该菌拥有良好的工业应用前景。疏棉状嗜热丝孢菌(T.lanuginosus)是一种嗜热真菌,其脂肪酶具有专一性强、选择性好、稳定性高等优点[13],广泛应用于有机酸合成[14]、食物加工及油的水解等行业,具有重要的经济价值。Wai Prathumpai等[15]将其在黑曲霉(NW297-14和NW297-24)中表达,以硝基苯基丁酸为底物,酶活达到6U/mL;郑艳等[16]以毕赤酵母为宿主,以橄榄油为底物,酶活达到7.2U/mL。目前,还没有将疏棉状嗜热丝孢菌耐热脂肪酶在无孢黑曲霉中表达的报道。本研究使用黑曲霉糖化酶启动子构建表达载体,利用根癌农杆菌介导tll基因转化至无孢黑曲霉SH-2,然后使用突变率高、突变谱广、重复性好[17]的等离子诱变技术进行诱变,实现tll在无孢黑曲霉中的高效重组表达。
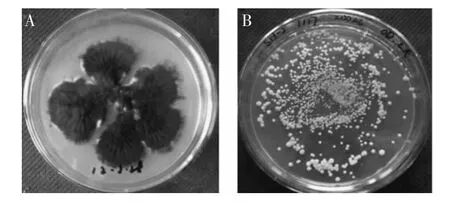
图1 淀粉培养基培养的黑曲霉MA169.4和无孢黑曲霉SH-2Fig.1 Aspergillus niger MA169.4 and Sporeless Aspergillus niger SH-2 cultured on solid starch medium
1 材料与方法
1.1 材料与仪器
黑曲霉SH-2 糖化酶生产企业;根癌农杆菌LBA4404 广东省农科院;疏棉状嗜热丝孢菌耐热脂肪酶基因tll(3’端添加His6组氨酸标签)南京金斯瑞生物科技有限公司合成;双元表达载体质粒pHGW(含潮霉素抗性基因HygBr)比利时植物学研究中心(VIB);大肠杆菌Mach1T1、ccdB Survival 本实验室保藏;潮霉素 美国Merck公司;乙酰丁香酮sigma-aldrich公司;三丁酸甘油酯 百灵威公司;限制性内切酶 美国Fermentas公司;PCR引物 Invitrogen合成;LC、IM和MM培养基[9],淀粉培养基(g/L) 牛肉膏3,蛋白胨10,酵母粉2,淀粉10,NaCl 2,琼脂粉17,pH5.5;CD培养基(g/L) 葡萄糖20,硝酸钠3,KCl 0.5,MgSO40.5,K2HPO41、FeSO40.01,琼脂粉15,pH5.5。
Centrifuge5418型离心机、Mastercycler gradient PCR仪 德国eppendorf公司;ÄKTA explorer蛋白纯化系统 美国GE公司;ARTP生物育种机 北京思清源生物科技公司等。
1.2 实验方法
1.2.1 耐热脂肪酶基因表达载体的构建 利用引物Sig-forward/Sig-reverse PCR扩增黑曲霉糖化酶基因的信号肽及起始密码子ATG上游10bp序列(Kozak序列);利用引物TLL-forward/TLL-reverse PCR扩增经密码子优化的tll基因,再利用融合PCR,将上述两个片段连接成一个DNA片段,命名为Sig-tll。
以黑曲霉基因组DNA为模板,利用引物PglaA-forward/PglaA-reverse扩增黑曲霉糖化酶启动子(PglaA),利用引物TglaA-forward/TglaA-reverse扩增糖化酶终止子(TglaA),再利用融合PCR,将上述两个片段连接成一个DNA片段,命名为PT。PT片段经连接克隆载体pSIMPLE-18 EcoRV/BAP Vector后,测序验证正确后用HindIII/XbaI双酶切亚克隆到农杆菌双元载体pHGW,命名为pHGWPT。
用PvuII酶切质粒pHGWPT并去磷酸化处理,将片段Sig-tll经磷酸化处理后连接到质粒pHGWPT上的启动子(PglaA)和终止子(TglaA)之间,通过PCR筛选方向性,挑选方向正确的重组子测序验证,质粒命名为pHGWPT-tll。所有引物序列见表1。
1.2.2 根癌农杆菌介导耐热脂肪酶表达载体转化无孢黑曲霉SH-2 参照朱锦辉等[18]报道的方法,将构建的pHGWPT-tll表达载体转化根癌农杆菌LBA4404,挑选阳性转化子并提取质粒进行鉴定。
参照Caroline B Michielse等[9]报道的转化方法,利用根癌农杆菌介导pHGWPT-tll转化无孢黑曲霉SH-2并得到转化子。将转化子单菌落转接至含0.5%(v∶v)三丁酸甘油酯的CD固体培养基(三丁酸甘油酯平板)上,30℃培养2d,观察转化子周围有无水解圈出现,对转化子进行初步鉴定。分别提取宿主菌SH-2和转化子的基因组DNA,利用引物glaA-forward/glaA-reverse、TLL-forward/TLL-reverse及hygB-forward/hygB-reverse分别扩增黑曲霉糖化酶基因(glaA,约1kb)、耐热脂肪酶基因(Sig-tll,约1kb)及潮霉素抗性基因(HygBr,约1kb)进行鉴定。
使用2%糖(1%葡萄糖+1%麦芽糖)为碳源的YPD培养基,30℃,250r/min,分别对宿主菌SH-2和转化子发酵3d。携带His6组氨酸标签的tll蛋白能与亲和层析柱牢固结合而进行有效洗脱,因此将发酵液离心过滤后使用His-tag亲和层析柱纯化,纯化后转化子的tll蛋白使用考马斯亮蓝法测定浓度;以橄榄油为底物,采用标准方法[19-20]测定脂肪酶活力;并进行SDS-PAGE电泳检测和Western Blotting进一步鉴定。酶活力单位定义为每分钟催化底物水解产生1μmol脂肪酸的酶量。
1.2.3 等离子突变株的选育及鉴定 使用ARTP育种机对转化子进行等离子诱变。参照样品制备流程制备样品,选取时间梯度30、60、90、120、180s进行诱变,诱变后的菌液分别稀释50、500、5000倍涂布于淀粉培养基,30℃培养5d。挑取菌落大的单菌落转接于三丁酸甘油酯平板上,通过水解圈的大小初步判断脂肪酶活力,对突变株进行筛选。

表1 PCR引物序列Table 1 The sequences of PCR primers
经过二次筛选,选定水解圈最大的突变株单菌落研究,30℃、250r/min对其发酵,测定纯化后突变株tll蛋白的浓度和脂肪酶活力。
1.2.4 耐热脂肪酶的生物学特性 耐热脂肪酶的最适反应温度:选取温度梯度50、55、60、65、70、75、80℃,以橄榄油为底物进行脂肪酶活测定,酶活最高时的温度即为重组耐热脂肪酶的最适反应温度。
耐热脂肪酶的最适反应pH:以橄榄油为底物,调整反应缓冲液pH分别为3.0、5.0、7.0、8.0、9.0、11.0,进行脂肪酶活测定,酶活最高时的pH即为重组耐热脂肪酶的最适反应pH。
2 结果与讨论
2.1 耐热脂肪酶基因表达载体的构建
通过融合PCR扩增耐热脂肪酶基因(Sig-tll),电泳结果显示基因片段大小与预计一致(图2A),通过亚克隆得到耐热脂肪酶的表达载体pHGWPT-tll(图2B)。HindIII/XbaI双酶切表达载体pHGWPT-tll,得到与目的片段大小相符的片段(约2.7K,图2C),表明耐热脂肪酶表达载体构建成功。

图2 Sig-tll基因的扩增及耐热脂肪酶表达载体的酶切鉴定Fig.2 PCR amplification of Sig-tll gene and identification of its expression vector by enzyme digestion
2.2 黑曲霉转化子的鉴定
挑选MM培养基上菌落大的单菌落(图3A),转移至三丁酸甘油酯平板。培养2d,出现水解圈的菌落,初步确定为转化子,而宿主菌SH-2菌落周围无水解圈(图3B)。

图3 pHGWPT-tll表达载体转化无孢黑曲霉SH-2Fig.3 Transformation of sporeless A.niger SH-2 with expression vector pHGWPT-tll
分别以宿主菌SH-2和转化子的基因组为模板,经PCR扩增所得的glaA、HygBr及Sig-tll片段大小与预计一致(图4A),且Sig-tll基因测序结果与原始序列一致,证实所得转化子为阳性克隆。SDS-PAGE电泳结果显示,转化子在32ku处有蛋白条带,与tll蛋白大小相符[16],Western Blotting鉴定表明,转化子有对应耐热脂肪酶tll的条带,而宿主菌SH-2没有(图4B),进一步确定转化子成功表达疏棉状嗜热丝孢菌耐热脂肪酶。

图4 转化子的鉴定Fig.4 Verification of transformant
2.3 等离子突变株的鉴定
对转化子进行等离子诱变,经二次筛选得到突变株。结果显示,宿主菌SH-2(图5A,1)在三丁酸甘油酯平板不形成水解圈,转化子(图5B,1)形成明显的水解圈。对水解圈最大的突变株(图5B,2)进行发酵,纯化后转化子、突变株tll蛋白的浓度、脂肪酶活力及酶的比活力见表2。结果显示,虽突变株和转化子的脂肪酶活力相差不大,但同转化子相比,突变株的比活力提高37%。此外,转化子和突变株的脂肪酶活力分别达到36、35U/mL,远高于疏棉状嗜热丝孢菌脂肪酶在毕赤酵母中的表达水平(7.2U/mL)[16]。
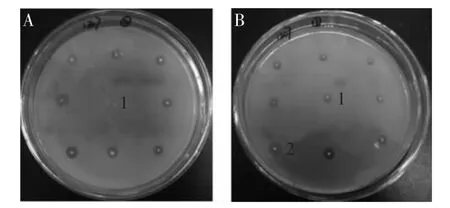
图5 等离子突变株的筛选Fig.5 Screening of lipase mutant

表2 纯化后转化子、突变株tll蛋白浓度、酶活力及酶的比活力Table 2 Protein concentration,enzyme activity and specific activity of tll after purification
2.4 耐热脂肪酶最适反应温度及最适反应pH
不同pH缓冲液环境下,分别测定宿主菌SH-2和突变株的脂肪酶活力。结果显示,宿主菌SH-2的脂肪酶活力在缓冲液pH为3.0~11.0之间较低且没有明显变化;突变株在缓冲液pH为3.0~11.0区间脂肪酶活力较高,且在缓冲液pH8.0时,酶活力最高,超过pH8.0酶活力显著下降。
在不同温度下分别测定宿主菌SH-2和突变株的脂肪酶活力。结果显示,宿主菌SH-2的脂肪酶活力在50~80℃之间较低且无较大变化;突变株则在50~60℃区间保持较高酶活力,且酶活力在60℃时达到最高,超过60℃,酶活力显著下降。上述结果与疏棉状嗜热丝孢菌脂肪酶在毕赤酵母中表达时基本一致[18]。

图6 耐热脂肪酶最适反应pH及最适反应温度Fig.6 The optimum pH and optimum temperature of the tll lipase
3 结论
疏棉状嗜热丝孢菌耐热脂肪酶具有作用温度高、副产物少、作用稳定等优点,得到越来越多的关注。该酶传统的生产方法是通过内源分泌得到的,产物量少、质量参差不齐、无法产业化等限制了其应用。目前,对疏棉状嗜热丝孢菌耐热脂肪酶的重组表达研究较少,国外Wai Prathumpai等使用米曲霉淀粉酶启动子将其在黑曲霉(NW297-14和NW297-24)中表达,但是酶活力较低。本研究对疏棉状嗜热丝孢菌耐热脂肪酶基因进行密码子优化,使其自由能由-291.9kcal/mol降至-303.3kcal/mol。自由能降低,大大减少了mRNA两端二级结构的产生,增加mRNA稳定性从而提高蛋白表达量。研究使用黑曲霉自身糖化酶强启动子构建质粒,经根癌农杆菌介导转化至无孢黑曲霉SH-2,得到的转化子经过连续传代培养后,稳定性良好且脂肪酶活力达到36U/mL。在此基础上,使用等离子诱变技术对转化子进行诱变,效果显著,实现了耐热脂肪酶在无孢黑曲霉的重组高效表达。
本文采用的潮霉素抗性基因(HygBr)虽然在真菌研究中应用极为广泛,但潮霉素是一种细菌毒素,属于氨基环多醇类抗生素,它可通过干扰蛋白合成而抑制原核和真核生物的生长,这极大的限制了其在食品等工业的应用。因此选择一种能够应用于食品工业的筛选标记如营养互补型选择标记,使其能够广泛应用于食品工业,为该酶的工业化生产提供条件,这将是本课题今后深入研究的方向。
[1]De Bekker C,van Veluw G J,Vinck A,et al.Heterogeneity of Aspergillus niger microcolonies in liquid shaken cultures[J].Applied and environmental microbiology,2011,77(4):1263-1267.
[2]Punt P J,van Biezen N,Conesa A,et al.Filamentous fungi as cell factories for heterologous protein production[J].Trends in biotechnology,2002,20(5):200-206.
[3]Conesa A,Punt P J,van Luijk N,et al.The secretion pathway in filamentous fungi:a biotechnological view[J].Fungal genetics and biology:FG&B,2001,33(3):155-171.
[4]Lubertozzi D,Keasling J D.Developing Aspergillus as a host for heterologous expression[J].Biotechnology advances,2009,27(1):53-75.
[5]Perrone G,Stea G,Epifani F,et al.Aspergillus niger contains the cryptic phylogenetic species A.awamori[J].Fungal biology,2011,115(11):1138-1150.
[6]Combier J.P,Melayah D,Raffier C,et al.Agrobacterium tumefaciens-mediated transformation as a tool for insertional mutagenesis in the symbiotic ectomycorrhizal fungus Hebeloma cylindrosporum[J].FEMS microbiology letters,2003,220(1):141-148.
[7]Michielse C B,Hooykaas P J,van den Hondel C A,et al.Agrobacterium-mediated transformation as a tool for functional genomics in fungi[J].Current genetics,2005,48(1):1-17.
[8]Yang L,Yang Q,Sun K,et al.Agrobacterium tumefaciens mediated transformation of ChiV gene to Trichoderma harzianum[J].Applied biochemistry and biotechnology,2011,163(8):937-945.
[9]Michielse C B,Hooykaas P J,van den Hondel C A,et al.Agrobacterium-mediated transformation of the filamentous fungus Aspergillus awamori[J].Nature protocols,2008,3(10):1671-1678.
[10]潘力,李俊星,苗小康.根癌农杆菌介导酸性蛋白酶在泡盛曲霉中表达的研究[J].食品工业科技,2010,32(5):5.
[11]Schuster E,Dunn-Coleman N,Frisvad JC,et al.On the safety of Aspergillus niger-a review[J].Applied microbiology and biotechnology,2002,59(4-5):426-435.
[12]杨海龙,吴天祥,章克昌.丝状真菌发酵生产中形态的影响与发酵罐设计[J].生物技术,2003,13(1):3.
[13]Roberto Fernandez-Lafuente.Lipase from Thermomyces lanuginosus:Uses and prospects as an industrial biocatalyst[J].Journal of Molecular Catalysis B:Enzymatic,2010,62:15.
[14]Brzozowski AM,Derewenda U,Derewenda ZS,et al.A model for interfacial activation in lipases from the structure of a fungal lipase-inhibitor complex[J].Nature,1991,351:491-494.
[15]Prathumpai W,Flitter SJ,McIntyre M,et al.Lipase production by recombinant strains of Aspergillus niger expressing a lipaseencoding gene from Thermomyceslanuginosus[J].Applied microbiology and biotechnology,2004,65(6):714-719.
[16]郑艳,周波,宋宁宁,等.疏棉状嗜热丝孢菌脂肪酶基因的克隆及其在毕赤酵母中的高效表达[J].菌物学报,2009,28(2):6.
[17]曾宪贤,武宝山,吕杰.离子束生物技术在生命科学中的应用[J].核技术,2006,29(2):3.
[18]朱锦辉,权军利,何玉科,等.根癌农杆菌感受态细胞的制备以及质粒ProkⅡ对其转化的研究[J].西北农林科技大学学报,2006,34(7):4.
[19]K.ARIMA,W-H.Liu,T.BEPPU.Studies on the Lipase of Thermophilic Fungus Humicola lanuginosa[J].Agr Biol Chem,1972,36(5):2.
[20]滕宏飞,王丹静,徐青,等.橄榄油乳化法测定脂肪酶活性的优化研究[J].食品工业,2011(6):3.
Effectively expression of Thermomyces lanuginosus thermostable lipase in non-spore Aspergillus niger
CHEN Jing,WANG Bin,LI De-ming,PAN Li*
(School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006,China)
TS201.3
A
1002-0306(2012)20-0160-40
2012-04-23 *通讯联系人
陈婧(1987-),女,硕士研究生,研究方向:工业微生物。
国家自然科学基金项目(30970045);“十二五”农村领域国家科技计划(2011AA100905)。
