有序介孔碳对罗丹明B的吸附行为研究
2012-09-11李群艳聂祚仁
孙 何,李群艳,韦 奇,聂祚仁
(北京工业大学材料科学与工程学院,北京 100124)
有序介孔碳对罗丹明B的吸附行为研究
孙 何,李群艳,韦 奇,聂祚仁
(北京工业大学材料科学与工程学院,北京 100124)
以嵌段共聚物F127为模板剂,间苯二酚/甲醛为碳源,在酸性条件下制备了孔径为6.44 nm,BET比表面积为661.98 m2/g,孔容为0.46 cm3/g的有序介孔碳(Ordered Mesoporous Carbon,OMC)。将所得有序介孔碳材料应用于罗丹明B(RhB)的吸附,并对吸附等温线和吸附动力学进行了研究。结果表明,吸附行为符合Langmuir吸附等温线及准2级动力学吸附。通过计算吸附过程中的吸附自由能ΔG0、焓ΔH0、熵ΔS0等热力学参数,表明吸附行为是自发进行的且是放热反应。溶液的pH值会对吸附量产生明显的影响,这主要是由于不同的pH值会对RhB的聚合产生明显的影响,从而导致分子尺寸的变化进而影响吸附量。
有序介孔碳 罗丹明B 吸附 热力学 动力学
罗丹明B(C28H31N2O3Cl,分子量479,RhB)是一种常用的人工染料,广泛应用于纺织印染工业、食品添加剂和作为荧光示踪分子[1]。与其接触会对人类和动物的皮肤、眼睛和呼吸系统产生刺激性伤害,对人类和动物的致癌性、生殖健康和发育伤害、神经毒性以及长期毒性已经被实验所证明。各国科学家已付出许多努力通过光催化或者吸附去除环境中的罗丹明B[2-4],并考察了吸附过程中的热力学和动力学行为。活性炭[5]、工业废料[6]、离子交换树脂[7]、重晶石[8]等材料已经被应用于罗丹明B的吸附去除及吸附行为研究。
介孔碳材料由于其由于其较大的比表面积及孔容、可调的孔径及形貌、稳定的化学性能,正越来越广泛的被应用于生物分子及药物的吸附和缓释、污染物的吸附去除等方面。Zhao等[9]分别以具有三维均匀孔道的介孔碳球(Uniform Mesoporous Carbon Spheres,UMCS)和具有二位六方结构的纤维状有序介孔碳(Fibrous Ordered Mesoporous Carbon,FOMC)为载体,对低水溶性的洛伐他汀(LOV)进行吸附研究,比较了LOV在这两种载体上的吸附和释放速率。结果表明,较大的孔径更加有利于LOV的吸附溶解。Guo等[10]研究了以有序介孔硅SBA-15为硬模板制备的CMK-3型有序介孔碳对水溶液中RhB的吸附行为。但是,这种方法制备介孔碳过程繁琐,成本较高,不利于大范围应用。采用更加简便的软模板法[11],以嵌段共聚物F127为模板剂,间苯二酚/甲醛为碳源,在酸性条件下一步合成了孔径较大的有序介孔碳(Ordered Mesoporous Carbon,OMC),并以其作为吸附剂对RhB进行吸附,系统研究了吸附过程中的吸附等温线及吸附动力学行为,对吸附热力学参数进行了计算。
1 实验部分
1.1 有序介孔碳的制备
有序介孔碳采用软模板法制备[11]。具体过程如下:2.5 g F127(99%,Sigma-Aldrich)溶解在11.9mL乙醇(AR,北京化工厂)和6.6mL去离子水中,得到澄清透明溶液。加入2.5 g间苯二酚(AR,天津市福晨化学试剂厂),在30℃持续搅拌至完全溶解后加入2.2mL 37%HCl(AR,北京化工厂)和2.5mL甲醛(AR,北京化工厂)溶液。搅拌1 h后,溶液呈乳白色,再持续30 min后停止搅拌,在室温下陈化12 h后,100℃热聚合24 h。在氮气保护下,以2℃/min升温至180℃保温5 h,再以2℃/min升温至400℃,接着以5℃/min升温至850℃并保温2 h。所得黑色固体即为有序介孔碳。
1.2 有序介孔碳的表征
样品的晶体结构是在是在德国Bruker AXS D8 Advance型X射线衍射仪上完成的。采用CuKα辐射,石墨单色器,管电压 40 kV,管电流 100 mA,步长 0.02o,步速 0.5 (o)/min。N2吸附脱附分析是在美国Micrometritics ASAP 2020M比表面与孔隙度分析仪上进行的。样品在分析前先在真空下200℃脱气5 h。样品的比表面积是采用BET方法,在相对压力在0.05~0.2的范围内从吸附分支上获得的。基于Klevin方程,采用BJH方法计算孔径分布曲线。孔容从吸附分支上在相对压力0.99处获得。透射电子显微镜(TEM)采用JEOL JEM-2010型,测试前将样品在无水乙醇中超声分散后滴于涂有碳膜的铜网上,干燥后观察。
1.3 罗丹明B的吸附实验
利用Thermo Evolution-600型紫外-可见分光光度计在556 nm处测定RhB在溶液中的浓度。吸附等温线是将5 mg有序介孔碳分别加入到15mL不同浓度(0.01~0.1 mg/mL)的RhB水溶液中,在恒温摇床中以200 r/min的转速恒温振荡24 h获得的。将吸附体系在4 000 r/min的离心机中离心分离,取上层清液,测定其浓度。平衡溶液浓度为溶液原浓度减去上清液浓度。OMC吸附量qe由公式(1)确定:

式中qe为OMC平衡吸附量,mg/g;c0为原始溶液浓度,mg/L;ce为溶液平衡浓度,mg/L;V为溶液体积,L;m为加入的OMC质量,g。
RhB在OMC上随时间的吸附量则是在0.1 mg/mL的溶液中,采用上述吸附方法,分别吸附0~24 h,通过计算qe得到。
2 结果与讨论
2.1 材料的结构表征
从图1样品的N2吸附-脱附等温线图可以看出,所得样品其等温线符合典型的第IV类等温线和H1型滞后环,说明所得材料为典型的介孔材料,且其孔径大小均匀、形状规则。从其孔径分布图(图1插图)可以看出,样品最可几孔径为6.44 nm,大于罗丹明B的分子尺寸(1.59 nm×1.18 nm×0.56 nm)[12],说明其可以用于对RhB的吸附和分离。OMC的BET比表面积为661.98 m2/g,孔容为0.46 cm3/g。

图1 介孔碳的吸附-脱附等温线和孔径分布(插图)Fig.1 Nitrogen adsorption-desorption isotherms and pore size distriution curves(inset)

图2 介孔碳的小角XRD和TEM(插图)Fig.2 Small-angle XRD patterns and TEM image(inset)of OMC
从图2介孔材料的小角X射线衍射(X-Ray Diffraction,XRD)图上可以看出,样品在2θ为0.7o附近出现一个明显的衍射峰,说明所得介孔碳具有良好的有序结构,这从TEM图上也可以直观地观察到。
2.2 吸附等温线
图3是40℃时不同浓度RhB在有序介孔碳上吸附24 h的吸附量。从图中可以看出,随着RhB浓度的增加,RhB在OMC上的吸附量呈非线性增加,这主要是由于在低浓度阶段 RhB分子在吸附剂表面浓度较低,随着吸附的进行,可用于吸附的表面位置逐渐减少,导致RhB的吸附量并不能随浓度的增加而正比例增加。但是当浓度增加到80 mg/L时,吸附量逐渐趋于稳定,达到105 mg/g,可以认为其吸附达到饱和。RhB在OMC上的吸附量比在CMK-3介孔碳上有明显增加[10],这可能是由于 OMC的孔径(6.44 nm)比CMK-3的孔径(3.9 nm)要大,RhB分子更容易进去孔道中去且不容易堵塞孔道。
将吸附所得数据分别用Langmuir等温线和Freundlich等温线进行线性拟合,拟合曲线如图4所示。
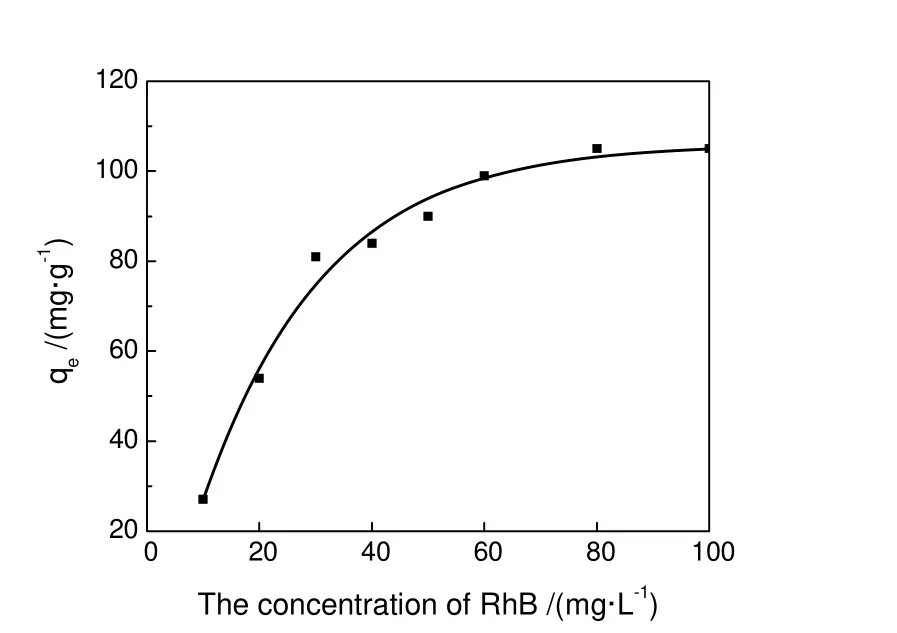
图3 不同浓度下RhB在介孔碳上的吸附量Fig.3 The adsorption amount of RhB by OMC with different concentration of RhB
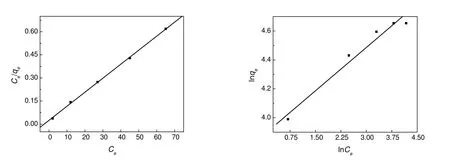
图4 RhB在有序介孔碳上吸附的Langmuir(左)和Frenundlich(右)吸附拟合曲线Fig.4 Adsorption curves fitted by Langmuir equation(left) and Freundlich equation(right)
Langmuir和Freundlich等温线拟合公式如下

式中qe为平衡时的吸附量,mg/g;qm为极限吸附量,mg/g;Ce为平衡时溶液浓度,mg/L;KL为与自由能有关的Langmuir常数;KF,n为Freundlich常数。
Langmuir线性拟合其线性相关系数为0.999 63,大于Freundlich线性拟合的0.983 13,而且从Langmuir拟合计算出来的最大吸附量qm为109.9 mg/g,与实验中所得饱和吸附量105 mg/g也比较接近,说明不同浓度RhB在有序介孔碳上的吸附行为更加符合Langmuir吸附规律。许多有机分子在不同吸附质上的吸附往往也遵循Langmuir吸附等温线[13,14]。由于介孔碳表面不带电荷[15],RhB分子主要靠范德华力进行吸附。Langmuir吸附说明OMC作为吸附质,表面性质均匀,吸附点分布均匀,RhB与OMC之间吸附作用力范德华力相对较小,所以RhB在OMC表面只能发生单分子层吸附,一个吸附位点只能吸附一个吸附剂分子。
通过计算分离因子RL,可以评估吸附行为是否有利于进行。若RL大于1,表示吸附行为不适宜进行,RL等于1,表示吸附行为是线性过程,RL在0到1之间,说明吸附行为容易发生,RL等于0则表示吸附行为是不可逆过程[16]。RL值根据下面公式计算得出

用Langmuir吸附拟合所得数据KL,经计算得到RL为0.026 8,介于0和1之间,说明吸附行为易于进行[17]。与C-20型离子交换树脂对RhB的吸附其RL在0.245~0.429[7],棕榈壳基活性炭在不同RhB浓度RL最小值0.085 3[18]相比,RhB在OMC中吸附的RL要小的多,说明OMC更加有利于对RhB的吸附[15]。
2.3 吸附热力学参数
取最大浓度100 mg/L的RhB溶液,在298~313 K的温度内分别进行吸附实验。从表1可以看出,RhB的吸附量随着温度的升高而降低。吸附过程中的热力学参数吉布斯自由能ΔG0、焓变ΔH0、熵变ΔS0等可以用Yu的方法[19]根据所得实验数据进行计算并用来分析实验过程中的现象。ΔG0根据公式(5)来计算

式中K为吸附平衡常数,K可由下式求得

ΔH0的值根据公式(7),以T-1为横坐标,lnK为纵坐标,对所得数据点进行线性拟合,斜率即为-ΔH0/R。
线性拟合图如图5所示。
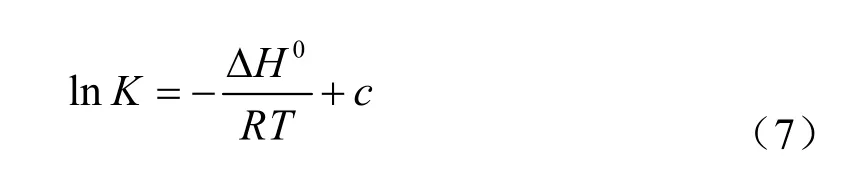
式中c为常数。
ΔS0的值根据吉布斯-亥姆霍兹方程(Gibbs-Helmholtz Equation)(方程8)计算所得
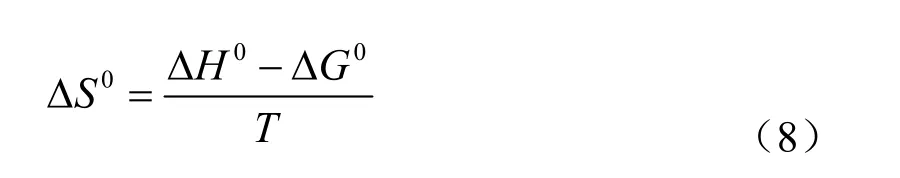
所得ΔG0、ΔH0、ΔS0数据列于表(1)中。从表(1)可以看出,ΔG0均为负值,说明RhB在有序介孔碳上的吸附是自发进行的过程,ΔH0值为负值说明吸附过程是个放热过程。在其他实验条件相同的情况下,OMC对RhB的吸附量随着温度的升高而逐渐减小,这与所得数据结果相一致。ΔS0为正值表明OMC对RhB有很好的亲和性[7],且在吸附过程中,RhB在吸附界面上是无序和随机吸附的[5]。
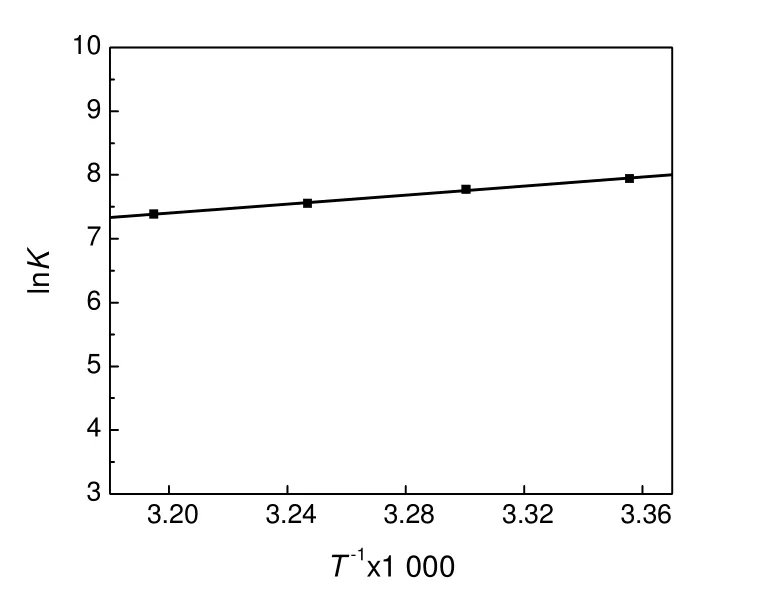
图5 lnK和T-1的关系Fig.5 The lnK versus T-1

表1 RhB在OMC上吸附的热力学数据Table1 The thermodynamic parameters for the adsorption of RhB onto OMC
2.4 吸附动力学
图6是40℃时 RhB随着时间的变化在OMC上的吸附量。在开始的时间内,吸附量随着时间的增加快速增加,当吸附时间达到5 h以后,吸附量逐渐趋于稳定。分别采用准一级动力学模型(公式9),以时间t作为横坐标,ln(qe-qt)为纵坐标,准二级吸附动力学模型(公式10),以时间t为横坐标,t/qt为纵坐标,对吸附数据进行线性拟合,拟合图如图(7)所示。

k1是准一级动力学的平衡速率常数,g/(mg·h-1);k2是准二级动力学的平衡速率常数,g/(mg·h-1);t是时间,h;qe为平衡时吸附量,mg/g;qt为t时的吸附量,mg/g。

图6 RhB在有序介孔碳上随时间变化的吸附量Fig.6 RhB adsorption on OMC with different time
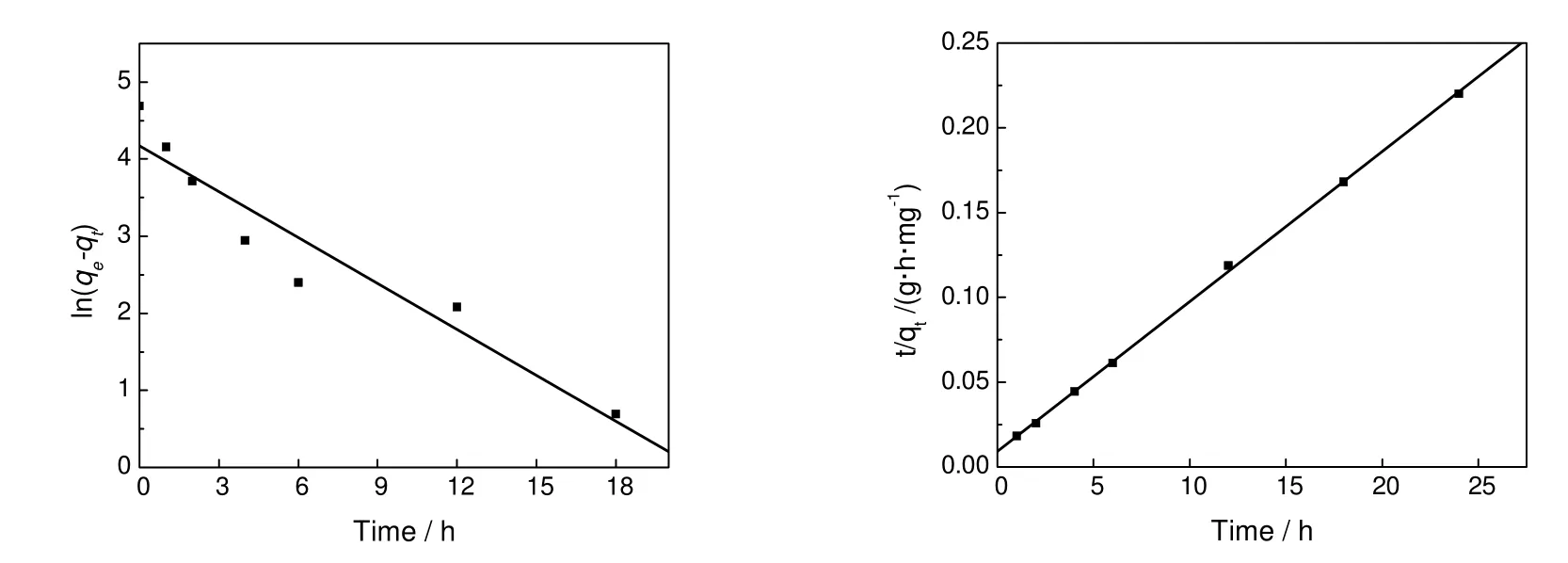
图7 RhB在有序介孔碳上吸附行为的准一级动力学(左)和准二级动力学(右)拟合Fig.7 Pseudo-first-order(left) and pseudo-second-order(right) kinetics for adsorption of RhB onto OMC
采用准二级动力学模型拟合所得直线其线性相关系数为0.999 77,要大于采用准一级动力学模型拟合所得直线的线性相关系数0.957 78。从模型中估算所得平衡吸附量来看,准二级动力学模型为113 mg/g,与实验所得105 mg/g比较接近,而由准一级动力学模型拟合方程所得为65.04 mg/g,与实验所得数据差距比较大。由以上两点可以看出,RhB在OMC上的吸附更加符合准2级动力学模型,这与RhB在大多数多孔吸附质上的吸附行为相一致。Eftekhari[4]、Arivoli[5]、Maedeh[18]等分别研究了RhB在AlMCM-41、酸活化活性炭、棕榈壳基活性炭上的吸附动力学,结果表明,与准一级动力学模型相比,RhB在这三种材料上的吸附行为也更加符合准二级动力学模型。
2.5 pH值的影响
溶液的pH值会对RhB在载体上的吸附产生明显的影响。从图8可以看出,随着溶液的pH值从3增加到7的过程中,RhB在介孔碳上的吸附量随着pH值的增加而增加;但是随着 pH值的继续增加,吸附量则呈现逐渐下降的趋势。这主要是因为在较低的pH值下(pH<4),RhB是阳离子,其主要是以单分子形式在溶液中分布,随着pH值的升高,RhB的双性离子型态会导致RhB的聚合,形成二聚体的RhB分子[20]。如果材料的孔径较小,会阻碍二聚体RhB的进入从而导致吸附量的下降。比如以稻米壳为原料制备的介孔碳[21],由于其孔径在2.0 nm左右,二聚体难以进入到孔道中且易堵塞孔道从而导致吸附量的下降。而本文中介孔碳由于其孔径为6.44 nm,大于RhB二聚体的尺寸,不会阻碍由于pH值增加形成的二聚体在孔道中的扩散,在吸附位点发生单分子成吸附,从而引起吸附量的增加。RhB二聚体的增加是由于RhB双性粒子上羧基和氧杂蒽基的相互作用。当pH值大于7以后,随着pH值的增加,OH-离子的存在会使得―N+和―COO-之间产生竞争作用从而导致RhB二聚体的减少,从而引起吸附量随着pH的增加而减小。

图8 吸附量与pH关系曲线Fig.8 Effect of pH on the adsorption amount of RhB by OMC
3 结 论
a) 以嵌段聚合物F127为模板,间苯二酚/甲醛为碳源,在酸性条件下制备了介孔碳。小角XRD、N2吸附和TEM表征结果表明所得材料具有良好的有序结构,其孔径为6.44 nm。
b) OMC对RhB的吸附结果表明,吸附过程符合Langmuir吸附等温线以及准二级动力学吸附。吸附自由能ΔG0为负值、ΔH0为正值说明吸附过程是放热过程且吸附行为是自发发生的。
c) RhB在不同pH水溶液中的吸附量是不同的,在pH为7时达到最大值,这是由于pH的改变导致RhB聚合状态的变化,从而影响了RhB分子的大小进而对其在OMC上的吸附量产生明显影响。
[1] Jain R, Mathur M, Silarwar S, et al. Removal of the hazardous dye rhodamine B through photocatalytic and adsorption treatments [J]. Journal of Environmental Management. 2007, 85(4):956-964.
[2] Machado E L, Dambros V D, Kist L T, et al. Use of ozonization for the treatment of dye wastewaters containing rhodamine B in the agate industry [J]. Water Air and Soil Pollution. 2012, 223(4):1753-1764.
[3] Peng L, Qin P F, Lei M, et al. Modifying Fe3O4nanoparticles with humic acid for removal of rhodamine in water [J]. Journal of Hazardous Materials. 2012, 209:193-198.
[4] Eftekhari S, Habibi Y A, Sohrabnezhad S. Application of AlMCM-41 for competitive adsorption of methylene blue and rhodamine B:thermodynamic and kinetic studies [J]. Journal of Hazardous Materials. 2010, 178(1-3):349-355.
[5] Arivoli S, Thenkuzhali M. Kinetic, mechanistic, thermodynamic and equilibrium studies on the adsorption of rhodamine B by acid activated low cost carbon [J]. E-Journal of Chemistry, 2008, 5(2):187-200.
[6] Jain A K, Gupta V K, Bhatnagar A, et al. Utilization of industrial waste products as adsorbents for the removal of dyes [J]. Journal of Hazardous Materials, 2003, 101(1):31-42.
[7] Al-Rashed S M, Al-Gaid A A. Kinetic and thermodynamic studies on the adsorption behavior of rhodamine B dye on duolite C-20 resin [J].Journal of Saudi Chemical Society, 2012, 16(2):209-215.
[8] Vijayakumar G, Yoo C K, Elango K, et al. Adsorption characteristics of rhodamine B from aqueous solution onto baryte [J]. Clean-Soil Air Water, 2012, 38(2):202-209.
[9] Zhao P, Wang L H, Sun C S, er al. Uniform mesoporous carbon as a carrier for poorly water soluble drug and its cytotoxicity study [J].European Journal of Pharmaceutice and Biopharmaceutics, 2012, 80(3):535-543.
[10] 郭 卓, 张维维, 王立锋, 等. 新型介孔碳的制备及对罗丹明B的吸附动力学研究 [J]. 现代化工, 2006 , 26(2):95-98.Guo Zhuo, Zhang Weiwei, Wang Lifeng, et al. Synthesis and adsorption kinetics of mesoporous carbon to rhodamine B [J]. Modern Chemical Industry, 2006, 26(2):95-98.
[11] Wang X Q, Liang C D, Dai S. Facile synthesis of ordered mesoporous carbons with high thermal stability by self-assembly of resorcinol-formaldehyde and block copolymers under highly acidic conditions [J]. Langmuir, 2008, 24(14):7500-7505.
[12] Zhuang X, Wan Y, Feng C M, et al. Highly efficient adsorption of bulky dye molecules in wastewater on ordered mesoporous carbons [J].Chemistry of Materials, 2009, 21(4):706-716.
[13] Wang S B, Zhu Z H. Characterisation and environmental application of an australian natural zeolite for basic dye removal from aqueous solution [J]. Journal of Hazardous Materials, 2006, 126(3): 946-952.
[14] Rauf M A, Qadri S M, Ashraf S, et al. Adsorption studies of toluidine blue from aqueous solutions onto gypsum [J]. Chemical Engineering Journal, 2009, 150(1):90-95.
[15] Vinu A, Miyahara M, Ariga K. Biomaterial immobilization in nanoporous carbon molecular sieves: influence of solution pH, pore volume, and pore diameter [J]. Journal of Physical Chemistry B, 2005, 109(13):6436-6441.
[16] Vadivelan V, Kumar K V. Equilibrium, kinetics, mechanism, and process design for the sorption of methylene blue onto rice husk [J]. Journal of Colloid and Interface Science, 2005, 286(1):90-100.
[17] Venkatraman B R, Hema M, Rajachandrasekar T, et al. Adsorption of ferrous ion from aqueous solution by acid activated low cost carbon obtained from natural plant material [J]. Research Journal of Chemistry and Environment, 2007, 11(1):70-78.
[18] Mohammadi M, Hassani A J, Mohamed A R, et al. Removal of rhodamine B from aqueous solution using palm shell-based activated carbon:adsorption and kinetic studies [J]. Journal of Chemical and Engineering Data, 2010, 55(12):5777-5785.
[19] Yu Y, Zhang Y Y, Wang Z H. Adsorption of water-soluble dye onto functionalized resin [J]. Journal of Colloid and Interface science, 2001,242(2):288-293.
[20] Ghanadzadeh A, Zanjanchi M A, Tirbandpay R. The role of host environment on the aggregative properties of some ionic dye materials [J].Journal of Molecular Structure, 2002, 616(1-3):167-174.
[21] Guo Y P, Zhao J Z, Zhang H, et al. Use of rice husk-based porous carbon for adsorption of rhodamine B from aqueous solutions [J]. Dyes and Pigments, 2005, 66(2):123-128.
Study on Adsorption Process of Rhodamine B on Ordered Mesoporous Carbon
Sun He,Li Qunyan,Wei Qi,Nie Zuoren
(College of Materials Science and Engineering, Beijing University of Technology, Beijing 100124, China)
Ordered mesoporous carbon materials(OMC) was synthesized from polymerization of resorcinol and formaldehyde in the presence of poly(ethylene oxide)-poly(propylene oxide)-poly(ethylene oxide) triblock copolymer(Pluronic F127) under acidic conditions. The obtained OMC with BET surface area of 661.98 m2/g,pore volume of 0.46 cm3/g and pore size of 6.44 nm was applied for adsorption of Rhodamine B(RhB) dye from aqueous solution and the adsorption isotherm and adsroption kinetics were investigated. The results show that the adsorption process follows the Langmuir isotherm and pseudo-second-order kinetic models. The thermodynamic parameters free energy of adsorption (ΔG0), enthalpy (ΔH0) and entropy (ΔS0) changes were calculated and the obtained data indicates that the adsorption process is spontaneous and exothermic. The adsorption amount can be significantly influenced by the pH of the aqueous solution, because the pH can change the aggregation state of RhB and the size of RhB which will affect the adsorption amount of RhB onto OMC.
ordered mesoporous carbon; rhodamine B; adsorption; thermodynamic; kinetics
O647.3
A
1001—7631 ( 2012) 03—0225—07
2012-05-07;
2012-05-30。
孙 何(1982-),男,博士研究生;李群艳(1974-),女,副教授,通讯联系人。E-mail:qyli@bjut.edu.cn。
国家863计划课题(2009AA03Z213);国家自然科学基金项目(21171014)。
