LC-MS法测定拟南芥原生质体脱落酸的研究
2012-08-16MohammedHumayunKABIR童建华黄志刚萧浪涛
郭 磊,Mohammed Humayun KABIR,童建华,黄志刚,萧浪涛
(湖南农业大学植物激素与生长发育湖南省重点实验室,长沙410128)
脱落酸(ABA)参与了植物的种子萌发、气孔运动、开花、结果和衰老等多个生长发育进程并在逆境应答系统中起着重要的作用[1-2].很多ABA缺陷或抗性突变体种子不休眠或发生胎萌,多个ABA超敏感的拟南芥突变体种子休眠程度加强,表明ABA是一种重要的内源萌发抑制剂,许多种子成熟期间有2个ABA积累高峰期[1].脱落酸在植物的逆境信号转导系统中起着重要的作用[3].水稻在水分胁迫状态下,根源ABA是植物体内ABA的主要来源,可能是植物体在逆境情况下根系感受逆境信息而产生的一种向地上部传递的逆境信号[4].因此,准确测定脱落酸的含量对于深入阐明脱落酸介导的发育过程和逆境应答等有关机制十分必要和迫切.
传统植物激素检测方法主要有放射免疫法、酶联免疫法、气相色谱法、高效液相色谱法、气相色谱-质谱联用法和液相色谱-质谱联用法等[5-7].这些检测方法通常是以植物组织为测定对象,但存在一定局限性.首先植物组织中的大量木质素、纤维素、蜡质、角质等成分,均是构成材料鲜重或干重的一部分,但在不同植物组织和器官中的含量不一致,以原生质体数量代替植物组织质量对植物激素进行衡量在统计方法上具有一定特色.其次,从植物组织中提取植物激素时需要较多的前处理步骤,不仅影响了测定的速度,且增加了潜在的误差[8].采用原生质体作为测定材料可以在一定程度上减少这些问题.利用纤维素酶、离析酶酶解细胞壁得到原生质体[9-10],通过对原生质体的离心纯化,已除去了不少影响植物激素检测灵敏度的物质,用这种材料作为植物激素检测的对象,可以降低误差、提高植物激素测定的精确度和灵敏度.本文以原生质体为材料,研究了采用LC-MS法测定拟南芥原生质体的脱落酸,避免了细胞间隙中的复杂化学组成干扰,提高了植物激素测定的灵敏度和精度,完善了经典的植物激素测定技术.
1 材料与方法
1.1 试验材料及培养
试验材料:拟南芥(Arabidopsis thaliana L.)哥伦比亚生态型(Col-0).土培拟南芥的培养条件:拟南芥Col-0种子消毒、春化后,播种于混合土(m(营养土)∶m(蛭石)∶m(沙子)=1∶1∶1)中,生长 30 d 左右(光照周期为16 h光照/8 h黑暗,温度为22℃,湿度为70%),取莲座叶用于叶片原生质体的制备(图1A).液体MS培养拟南芥条件:拟南芥Col-0种子消毒、春化后,播种于MS固体培养基上(光照周期为16 h光照/8 h黑暗,温度为22℃,湿度为70%),生长7 d后转入MS液体培养基在摇床上(30 r/min)进行无菌培养8~10 d,取根系用于原生质体的制备(图1B).
1.2 试验方法
1.2.1 主要仪器和试剂 主要仪器包括 Waters Acquity-SQD液质联用仪,Olympus BX51荧光显微镜,Jouan RCT-60真空冷冻离心浓缩系统.主要有纤维素酶R-10、离析酶R-10(Yacult Honsha Co.,Tokyo,Japan),ABA 标准品(HPLC 级,美国 SIGMA公司,纯度大于98%)、乙腈、甲醇、甲酸(色谱纯,美国TEDIA公司).

图1 在液体MS培养基(A)和营养土(B)上培养得到的拟南芥Figure 1 Arabidopsis cultivated in solid MSmedium(A),liquid MSmedium(B)and soil
1.2.2 拟南芥原生质体的制备 酶解液配方:1.5% 纤维素酶 R-10,0.4% 离析酶 R-10,20 mmol/L;KCl,20 mmol/L MES(pH 5.7),0.1%BSA,0.4 mol/L 甘露醇,10 mmol/L CaCl2,0.45 μm滤膜过滤后,KOH校正pH为5.7.
WI溶液配方:0.5 mol/L 甘露醇,20 mmol/L KCl,4 mmol/L MES(pH 5.7),0.45 μm 滤膜过滤后,KOH校正pH 为5.7.
叶片原生质体的制备:将叶片纵向切成1~2 mm宽的细条,置于酶解液中.25℃恒温摇床上50 r/min游离4 h.酶解液通过74μm细胞筛网过滤后,将滤液4℃、60 r/min离心1 min,取沉淀悬浮于WI溶液中,重复洗涤3次,利用血球计数板计算原生质体数量,4℃ 100 r/min离心5 min后去掉上清,得到叶片原生质体样品用于脱落酸的提取和测定.
根系原生质体的制备:将根系用手术剪纵向切碎,置于酶解液中,25℃恒温摇床上50 r/min震荡4 h,进行原生质体的游离.将酶解液通过74μm细胞筛网过滤后,将拟南芥根系原生质体滤液4℃、200 r/min离心1 min,取沉淀悬浮于WI溶液中,重复洗涤3次,通过血球计数板计算原生质体数量,4℃、200 r/min离心5 min后去掉上清,得到根系原生质体样品用于脱落酸的提取和测定.
1.2.3 脱落酸的提取与测定 将原生质体样品用液氮反复冻融破碎细胞;加入700μL 80%预冷的甲醇,充分混匀后,置于4℃中浸提15 h以上;4℃,16 000 r/min离心10 min后取上清;于残渣中加入500μL 80%预冷的甲醇重复浸提2次,每次浸提4 h;离心后合并3次上清液,置于冷冻浓缩机中浓缩至干.将浓缩干的样品溶解于20μL 10%甲醇进行LC-MS分析.
脱落酸的测定条件:(1)液相色谱条件:色谱分析柱为 Acquity UPLC® BEH C18,100 ×2.1 mm,1.7 μm;以甲醇和水梯度为流动相洗脱,起始体积分数为10%的甲醇,2 min后甲醇体积分数变为100%;流速0.25 mL/min;柱温35 ℃.(2)质谱条件:采用SIR测定模式;负离子;锥孔电压30 V;毛细管电压3.0 kV;离子源温度120℃;脱溶剂温度350℃;脱溶剂气流速600 L/h;反吹气流速50 L/h;m/z(263.2).
2 结果与分析
通过Olympus BX51荧光显微镜对拟南芥叶片和根系原生质体进行观察,发现经酶解游离后得到了较纯净的原生质体(图2).
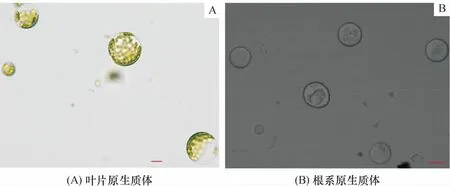
图2 拟南芥叶片原生质体(A)和拟南芥根系原生质体(B)Figure 2 Protoplasts of Arabidopsis leaves(A)and protoplasts of Arabidopsis roots(B)
LC-MS测得的ABA的峰型较好(图3),得到的ABA数据较精确.通过ABA标准品制作的标准曲线,用外标峰面积法测定得到了不同数量土培拟南芥叶片原生质体和液体MS培养拟南芥根系原生质体的ABA含量(图4)及土培拟南芥叶片原生质体和液体MS培养拟南芥根系原生质体的ABA含量与原生质体数目之间的线性方程,相关系数分别为0.992 3,0.993 1(表 1),线性关系较好.原生质体ABA的检测下限由样品中的ABA含量和检测仪器的灵敏度决定.Waters Acquity-SQD液质联用仪对ABA溶液的检测下限为1.07 ng/mL.土培拟南芥叶片原生质体和MS液体培养拟南芥根系原生质体的ABA含量的检测下限分别为3万和2万个.液体MS培养的拟南芥处于无菌环境下,受到高湿、水胁迫,密闭环境等影响,故其ABA含量较高.
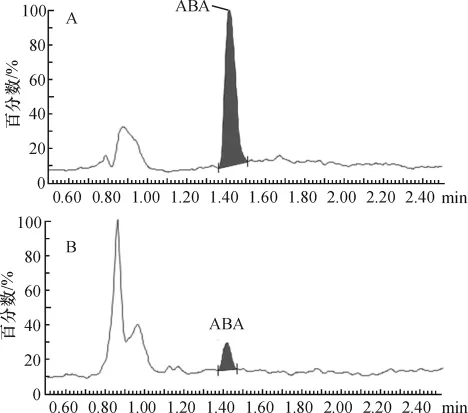
图3 ABA标准品(A)与样品(B)LC-MS图谱Figure 3 LC-MS of ABA standard(A)and sample(B)
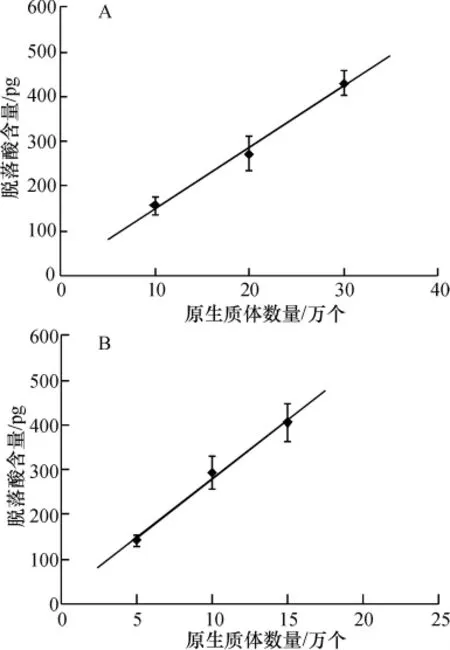
图4 土培拟南芥叶片原生质体(A)和水培根系原生质体(B)ABA含量与原生质体数量的线性图Figure 4 Linear relationship between ABA content and number of protoplasts

表1 LC-MS测得的拟南芥原生质体ABA含量与原生质体数量之间的线性方程和相关系数Table 1 Linear equation and correlation coefficient between protoplasts numbers and the ABA content determined by LC-MS
3 讨论与结论
本试验通过高效液相色谱与质谱联用,建立了提取并快速定量拟南芥根系和叶片分离的原生质体脱落酸含量的方法.通过Waters Acquity-SQD液质联用仪测得的ABA样品的峰型较好,所测ABA数据较精确,原生质体的ABA含量与原生质体数目之间的线性关系较好.原生质体的检测下限主要由仪器的灵敏度和细胞中植物激素水平决定.
但利用原生质体测定植物激素也面临着一些问题.通过原生质体测定植物激素对研究人员的操作要求较高.原生质体容易破碎,所以移取时,要选取口径适中的移液枪枪头,操作要轻柔.原生质体离心后要快速去上清并重新加入溶液重悬,否则原生质体容易堆积,影响原生质体的计数.在遮光条件下对原生质体进行操作,在一定程度上减少原生质体的破碎而影响试验结果.在原生质体制备过程中植物激素降解等情况有待进一步的研究确定.
本实验以原生质体数量代替植物组织质量对植物激素进行衡量,在统计方法上具有一定特色.利用原生质体测定植物激素可以减少复杂化学组份的干扰,简化了前处理步骤,降低了误差,从而提高植物激素测定的灵敏度和精确度.今后可在提取ABA时在样品中加入同位素标记的ABA标准品,在试验的每一步测定回收率,改进提取方法,以实现更精确的测定.
[1]FINKELSTEIN R R,GAMPALA S S,ROCK C D.Abscisic acid signaling in seeds and seedlings[J].Plant Cell,2002,14:S15-S45.
[2]FINKELSTEIN R R.Studies of abscisic acid perception finally flower[J].Plant Cell,2006,18(4):786-791.
[3]ZHU JK.Salt and drought stress signal transduction in plants[J].Annu Rev Plant Biol,2002,53:247-273.
[4]萧浪涛,王少先,彭克勤,等.自然干旱胁迫下配方肥增效剂对水稻内源激素的影响[J].中国水稻科学,2005,19(5):417-421.
[5]PAN X,WELTIR,WANG X.Quantitative analysis of major plant hormones in crude plant extracts by highperformance liquid chromatography-mass spectrometry[J].Nat Protoc,2010,5(6):986-992.
[6]DUFFIELD PH,NETTINGA G.Methods for the quantitation of abscisic acid and its precursors from plant tissues[J].Anal Biochem,2001,289(2):251-259.
[7]GOMEZ-CADENAS A,POZO O J,GARCIA-AUGUSTIN P,et al.Direct analysis of abscisic acid in crude plantextracts by liquid chromatography——electrospray/tandem mass spectrometry[J].Phytochem Anal,2002,13(4):228-234.
[8]SCHMELZ E A,ENGELBERTH J,ALBORN H T,et al.Simultaneous analysis of phytohormones,phytotoxins,and volatile organic compounds in plants[J].Proc Natl Acad Sci U SA,2003,100(18):10552-10557.
[9]SHEEN J.Signal transduction in maize and Arabidopsis mesophyll protoplasts[J].Plant Physiol,2001,127(4):1466-1475.
[10]YOO SD,CHO Y H,SHEEN J.Arabidopsis mesophyll protoplasts:A versatile cell system for transientgene expression analysis[J].Nat Protoc,2007,2(7):1565-1572.
