绵羊血浆中多拉菌素的H P L C测定及其药动学研究
2012-08-08石艳丽韩彩霞张子群李晓云宋铭忻
石艳丽,李 巍,韩彩霞,张子群,李晓云,宋铭忻
(1.东北农业大学动物医学学院,哈尔滨 150030;2.中国农业大学动物医学学院,北京 100193;3.黑龙江出入境检验检疫局,哈尔滨 150036)
多拉菌素(Doramectin,DRM)是20世纪90年代美国辉瑞公司研制开发的新一代大环内酯类抗寄生虫药物,DRM是一种阿维菌素的衍生物,经过生物突变合成,在阿维菌素的C25上引入一环己烷而成,是一种最新的动物体内外广谱抗寄生虫药[1-3]。DRM为高亲脂类物质,在动物体内具有分布广、组织排除缓慢、生物半衰期长等特点,因而生物利用率高[4-5]。其药代动力学特性受给药途径、药物剂型、动物种类和个体差异的显著影响[6]。
本研究成功研制了多拉菌素浇泼剂,并经临床试验证明具有高效、广谱、安全及使用方便等特点。为了进一步研究多拉菌素浇泼剂的作用特点,为临床用药提供理论依据,本文采用C18柱进行样品前处理与纯化,HPLC测定样品中多拉菌素的含量,对多拉菌素浇泼剂在绵羊体内的药物代谢动力学进行研究。
1 材料与方法
1.1 药品和试剂
多拉菌素原料药(浙江海正药业有限公司提供,批号040801),纯度:87.3%;多拉菌素标准品(Sigma公司,批号33993),纯度:84.6%;N-甲基咪唑,99%;三氟醋酸酐,化学纯(批号F20050926,国药集团化学试剂有限公司);乙腈及甲醇,色谱纯(德国默克公司);肝素(批号F20071010,上海山溏化工有限公司)。
1.2 动物
健康绵羊6只,体重(30±0.48)kg,雌雄各半,试验前饲养观察一周,给药前12 h起禁食,自由饮水,采样期间正常饲养。
1.3 仪器及色谱条件
安捷伦高效液相色谱系统;低温高速离心机(德国Beckman);旋转蒸发器,Laborota 4003型(德国Heidolph公司);真空抽气泵,2XZ型(中国临海市精工真空设备厂);固相萃取柱:ODSC18柱(100 g·L-1)(中国科学院大连化学物理研究所);色谱柱:Kromasil KR100C18(250 mm×4.6 mm,5 μm);流动相:甲醇(100%);流速:1.0 mL·min-1;进样量:20 μL;激发波长:365 nm;发射波长:475 nm;柱温:30℃。
1.4 溶液配制
1.4.1 标准溶液的配制
精密称取DRM的标准品25 mg,置于100 mL容量瓶中,用甲醇(色谱级)溶解并稀释定容,摇匀,得标准储备液(250 μg·mL-1),置于4℃冰箱保存,使用时根据试验需要用甲醇(色谱级)配制到所需浓度。
1.4.2 衍生化试剂的配制
A液:N-甲基咪唑∶无水乙腈(1∶1,V/V)
B液:三氟乙酸酐∶无水乙腈(1∶2,V/V)
1.5 给药与血样采集
按照治疗剂量0.5 mg·kg-1·bw-1多拉菌素浇泼剂涂擦于绵羊的两耳及背部,并分别于给药前及给药后的2、4、6、8、12、24 h及2、3、4、5、6、7、9、11、14、17、20、24、28、35 d于绵羊颈静脉采集血样,10 mL·次-1,肝素抗凝并迅速置冰水中保存,3 000 r·min-1离心10 min,分离血浆并转入另一离心管中,于-20℃保存备用。
1.6 药物提取及衍生化
取0.5 mL血浆样品添加DRM标准工作液,涡旋震动1 min。加入5 mL乙腈,涡旋震动混匀2 min,3 500 r·min-1离心5 min,取上清,重复两次,合并上清液。置于旋转蒸发仪中,减压蒸干,加入0.5 mL乙腈,涡旋震动混匀,加入9.5 mL水,充分混匀,用C18固相萃取柱进行纯化。固相萃取程序:C18柱先用5 mL乙腈进行洗脱,再用5 mL蒸馏水进行淋洗,将样品过C18柱,依次用1 mL甲醇,10 mL乙酸乙酯进行洗脱并收集洗脱液,用氮气在60℃沙浴中吹干,残留物用100 μL N-甲基咪唑-乙腈溶液溶解,加入150 μL三氟乙酸酐-乙腈溶液混匀,静置15~30 min,再加入750 μL无水甲醇终止反应,待上机测定。
1.7 线性范围与最低检测浓度
取血浆样品0.5 mL,加入多拉菌素标准品溶液,使血浆中多拉菌素的浓度(C)分别为0.1、0.5、1、5、10、15、25、50、75、100 ng·mL-1,参照1.6法制样,进行HPLC检测,记录色谱图,得峰面积(A),每个样品重复测定5次,以A对C进行线性回归,得回归方程,根据血浆和组织标准曲线的相关系数估计样品中多拉菌素定量的线性范围。按信噪比≥3来确定DRM在血浆中的最低检测浓度。
1.8 精密度及回收率的测定
分别配制含多拉菌素高、中、低(40、20、5 ng·mL-1)3种浓度的血浆样品各3份,参照1.6方法操作,分别于同日内及连续不同日测定,计算其日内变异系数和日间变异系数及该提取方法的回收率。
1.9 数据处理与统计分析
血药浓度-时间数据运用Marquardt法迭代拟合,通过对模型拟合的评价,根据AIC最小原则选出最佳模型,计算药代动力学参数,数据处理选用中国药理学会编制的3P97程序运行,统计值以平均数±标准差表示(X±S)。
2 结果与分析
2.1 色谱分离
在上述色谱条件下,DRM标准品、空白血浆、空白血浆添加药物色谱图见图1~3。由图谱可见,本试验所选用的分析条件可以较好地分离DRM,色谱图基线平稳,杂质少,DRM与杂质分离良好,色谱峰对称性好,DRMB1a和B1b分离良好,保留时间适中(B1a为9.5 min),表明DRM的HPLC检测条件是比较理想的,从图中可以看出,DRM在测定条件下与血浆成分分离良好。
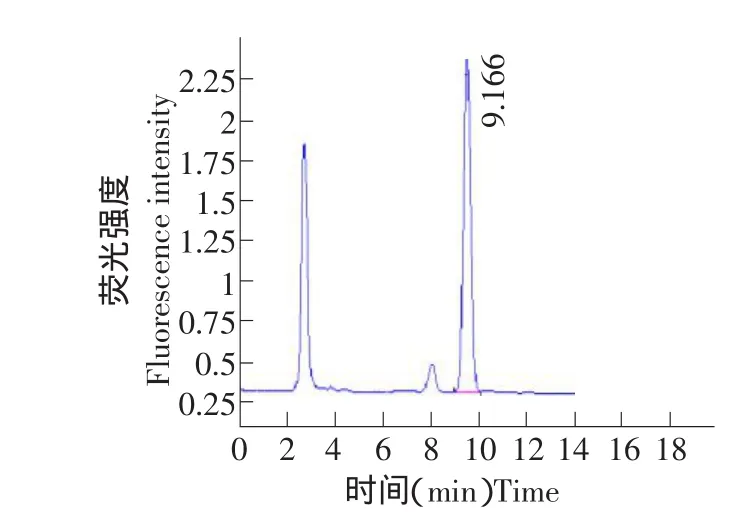
图1 多拉菌素标准品的HPLC色谱Fig.1 HPLC chromatograms of standard preparation of doramectin

图2 空白血浆色谱Fig.2 HPLC chromatograms of blank plasma sample
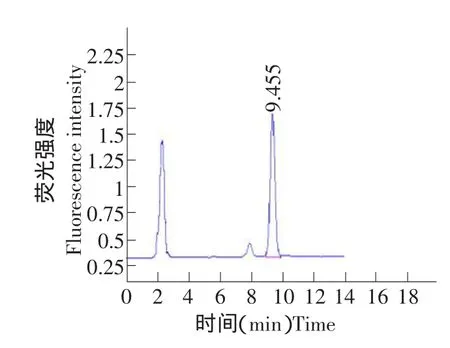
图3 含多拉菌素血浆色谱Fig.3 HPLC chromatograms of plasma containing doramectin
2.2 线性范围与检测灵敏度
多拉菌素在1~100 ng·mL-1浓度范围内线性关系良好。以A(峰面积)对C(血药浓度)进行线性回归,得回归方程为y=0.287x+0.431,R2=0.9985。最低检测浓度为0.1 ng·mL-1。
2.3 精密度及回收率
结果见表1。

表1 绵羊血浆中多拉菌素的回收率及变异系数Table 1 Recovery rate and Variation coefficient of doramectin in sheep plasma
由表1可知,多拉菌素的回收率介于98.4%~101.5%之间,日间和日内变异系数均小于10%,表明本试验方法回收率高,准确度高,符合药代动力学要求。
2.4 多拉菌素浇泼剂在绵羊体内的药动学
给药后不同时间点的绵羊血浆经过样品处理并进行HPLC测定。给药后35 d绵羊血浆中的DRM浓度均低于检测线,药时曲线见图4。

图4 绵羊血浆样品中时间—多拉菌素平均浓度散点图Fig.4 Graphic of mean doramectin concentrations distributed at distinct time points in sheep plasma
绵羊皮肤浇注多拉菌素浇泼剂后的主要药代动力学参数。将试验所得的血药浓度-时间数据经3P97程序计算可知,绵羊皮肤浇注多拉菌素浇泼剂后在体内的过程符合二室模型,有关药代动力学参数见表1。
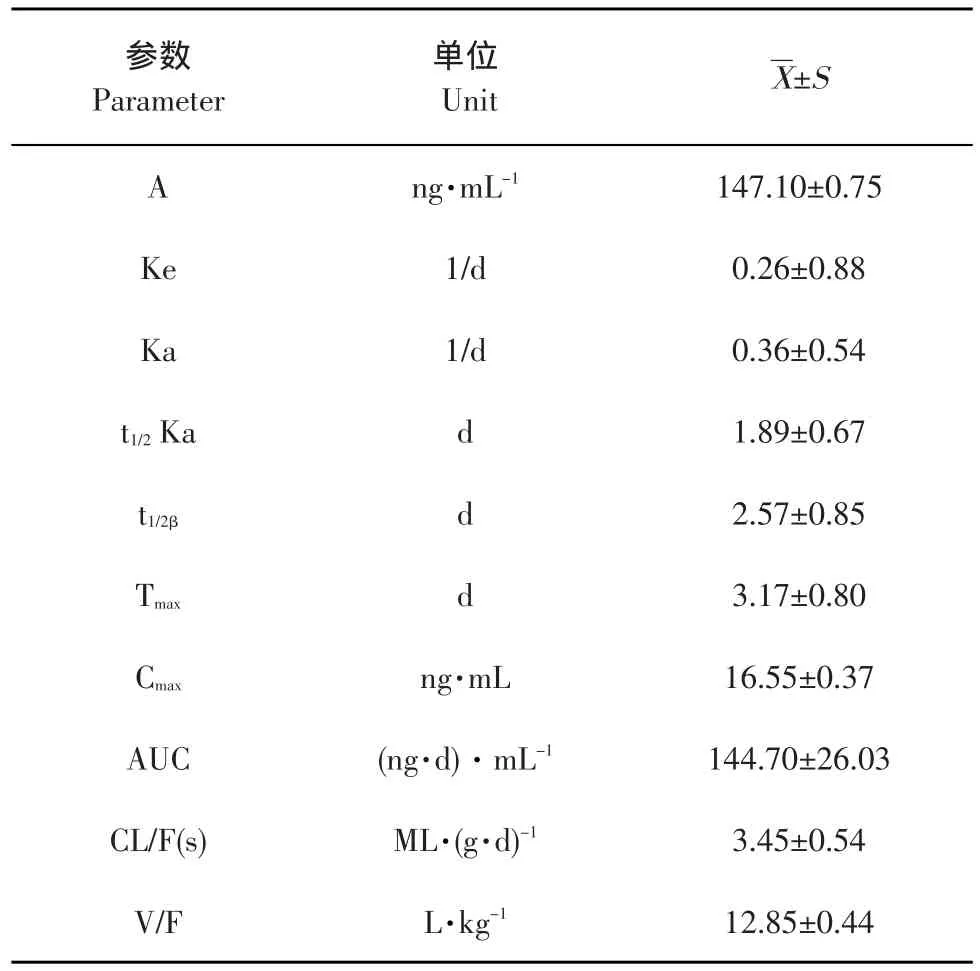
表2 多拉菌素浇泼剂在绵羊体内的药代动力学参数Table 2 Pharmacokinetics parameter of doramectin pour-on in sheep (n=6)
3 讨论与结论
本试验单剂量(0.5 mg·kg-1BW)给绵羊背部浇注0.5%多拉菌素浇泼剂后,血浆中药物浓度的消除半衰期(T1/2Kβ)为4.95 d,根据半衰期判断,多拉菌素属于慢性消除药物,这与张萍等在犬上的动力学研究(按照0.3 mg·kg-1BW皮下注射给药,消除半衰期为4.78 d)[7]及张继瑜等在猪上的药动学研究(按照0.3 mg·kg-1BW静脉注射,消除半衰期为6.11 d)[10]结果较接近。本试验中多拉菌素在绵羊体内的分布半衰期(T1/2kα)为1.89 d,较多拉菌素在犬皮下注射给药时分布半衰期0.58 d及在猪静脉注射给药时分布半衰期1.09 d要大,说明0.5%多拉菌素浇泼给药在绵羊体内的分布相对其对犬皮下注射及猪静脉注射的分布较慢,这主要与动物的种属差异和不同的给药途径有关。
药时曲线下面积(AUC)反映进入体循环药量的多少,它是评价药物吸收程度的一个重要指标[8-9]。药时曲线某一时间区段下的AUC反映该时间内的体内药量,代表了一次给药后的吸收总量,反映药物被吸收的程度[11]。本试验条件下背部浇泼多拉菌素在绵羊体内的AUC为(144.7±23.36)ng·d·mL-1,这与张萍等[7]皮下注射于犬上AUC值(187.43±24.99)ng·d·mL-1结果相接近,表明0.5%多拉菌素浇泼剂在绵羊体内的吸收较好。
药物经血管外给药吸收后的血药浓度最大值称为药峰浓度(Cmax),与给药剂量、给药途径、给药次数、动物种属等有关。药物达到峰浓度所需的时间即为药峰时间(Tmax),取决于吸收速率和消除速率。两者是反映药物吸收快慢的重要指标。本试验中背部皮肤浇泼多拉菌素于绵羊时的Cmax为(19.93±0.37)ng·mL-1,Tmax为(3.18±0.89)d与Lifschitz等皮下注射于牛上的Tmax值(3.86±1.11)d结果[12]相接近,表明多拉菌素浇泼剂在绵羊体内的吸收较快。
本试验选用AIC法对多拉菌素在绵羊体内的房室模型进行判定,即根据不同的AIC值,可以确定最佳模型。AIC值越小,则该模型拟合度越好,特别是当两种模型的残差平方和值很接近时AIC值较小的模型是最适模型。本试验条件下测出的多拉菌素在绵羊体内过程符合二室开放模型,这与张继瑜等在猪体内注射多拉菌素的研究结果[10]相同,而张萍等在犬上注射多拉菌素的动力学模型为一室模型[7],可见动物种属差异对药物的动力学特征是有影响的。大环内酯类药物在动物血浆中的动力学特性可变性较大,这在牛试验中已得到证明[13],本试验中多拉菌素在绵羊体内的血浆浓度也存在着差异,该结果表明多拉菌素在动物个体内吸收和代谢的个体差异性,在相同的试验条件下,这种现象对伊维菌素在牛、猪、绵羊和山羊中同样存在,这可能与动物的体况、性别、年龄和生理状况有关,但与药物的固有特性关系不大[10]。
综上,药物配方组成或给药途径不同,可明显影响药物的吸收速率,进而影响其生物半衰期和最大血药浓度。多拉菌素浇泼剂在绵羊体内血药浓度较高,吸收分布迅速,可为临床用药提供依据。
[1] Goude A C,Evans N A,Gration K A F,et al.Doramectin,A potent novel endectocide[J].Vet Parasitol,1993,49(1):5-15.
[2] Bousquet-Melou A,Mercadier S,Alvinerie M,et al.Endectocide exchanges between grazing cattle after pour-on administration of doramectin,ivermectin and moxidectin[J].Int J Parasitol,2004,34(11):1299-1307.
[3] 高玉红,郭照成,刘方悦,等.多拉菌素的研究进展及应用[J].东北农业大学学报,2009,40(4):141-144.
[4] Sallovitz J M,Lifschitz A,Imperiale F,et al.Doramectin concentration profiles in the gastrointestinal tract of topicallytreated calves:Influence of animal licking restriction[J].Vet Parasitol,2005,133(1):61-70.
[5] 高玉红,路义鑫,石艳丽,等.多拉菌素浇泼剂临床前毒理学试验研究[J].中国兽药杂志,2010,44(1):41-43.
[6]Mckellar Q A,Benchaoui H A.Avermectins and milbemycins[J].J Vet Pharmacol Therap,1996,19(5):331-335.
[7] 张萍,王加才,江善祥.多拉菌素在犬体内药代动力学研究[J].云南农业大学学报,2007,22(3):389-392.
[8] Wen H Q,Pan B L,Yuwan Wang,et al.Plasma and milk kinetics of eprinomectin following topical or oral administra-tion to lactating Chinese Holstein cows[J].Vet Parasitology,2010,174:72-76.
[9] Dupuy J,Jean-Francois S,Alvinerie M,et al.Plasma and milk kinetic ofeprinomectin and moxidectin in lactating water buffaloes(Bubalus bubalis)[J].Vet Parasitology,2008,157:284-290.
[10] 张继瑜,李剑勇,周绪正,等.猪肌肉注射多拉菌素的药物动力学研究[J].动物医学进展,2005,26(8):83-86.
[11] 刘超任.药物制剂药时曲线下的有效面积[J].中国医药工业杂志,1993,24(9):400-401.
[12] Lifschitz A,Sallovitz J,Imperiale F.et al.Pharmacokinetic evaluation of four ivermectin generic formulations in calves[J].Vet Parasitol,2004,119(2-3):247-257.
[13] Nowakowski M,Lynch M,Smith D,et al.Pharmacokinetics and bioequivalence of parenterally administred doramectin in cattle[J].J Vet Pharmacol Therap,1995,18(4):290-298.
