民猪CIRP基因的克隆与冷诱导研究
2012-08-08张冬杰杨国伟
张冬杰,刘 娣,汪 亮,别 墅,杨国伟
(黑龙江省农业科学院,哈尔滨 150086)
冷诱导RNA结合蛋白(Cold inducible RNA-binding protein,CIRP)是在哺乳动物细胞中发现的首种冷应激或冷休克蛋白,伴随冷应激过程过量表达[1]。日本Nishiyama实验室首次从小鼠睾丸细胞中分离到冷诱导RNA结合蛋白,发现温和冷处理(29~22℃)可显著提高小鼠CIRP mRNA水平,相反热处理(39和42℃)则降低其表达水平 。日本Saito实验室研究证实牛蛙脑中CIRP在冬季强烈表达,而在夏季表达量很低。这表明CIRP表达可能在动物冬眠过程中发挥一定作用[3]。日本Aoki实验室和Nishiyama实验室分别证实CIRP具有RNA分子伴侣活性[4]。英国Banks实验室在发育的非洲爪蟾神经组织内发现该基因瞬时表达,这表明在神经发生过程中发挥重要作用[5]。我国从2005年对CIRP进行研究。李安民实验室报道CIRP在脑缺血时表达及亚低温下冷诱导CIRPmRNA在大鼠脑内的表达情况[6];杨焕民实验室克隆BALB/C鼠睾丸组织中CIRP,并制备与鉴定CIRP多克隆抗体[7]。为进一步探讨CIRP基因在猪上的生物学功能,本研究克隆民猪的CIRP基因mRNA序列,对该基因在不同组织的表达水平进行了检测,并分析冷诱导下该基因的表达变化情况。
1 材料与方法
1.1 材料
75日龄民猪3窝共计12头,将每窝个体随机分成2组即常温组和低温组,每组各6头,购自黑龙江省农科院畜牧研究所。2009年12月25日到2010年1月6日期间,将常温组置于正常舍内饲养,温度控制在(10±2)℃,低温组在舍外半敞式大棚内饲养,温度为(-20±3)℃,两组均饲喂相同的饲料。处理结束后,屠宰,取腿部肌肉组织各10 g,以液氮保存带回实验室,-80℃冰箱冻存。
感受态细胞(购自北京原平皓生物技术有限公司);rTaq酶、限制性内切酶BamHⅠ和HindⅢ、T 载体、TaKaRa RNA PCR Kit(AMV)Ver3.0(购自TaKaRa公司);胶回收试剂盒和质粒提取试剂盒(购自天根生化科技有限公司);SYBR Green PCR Master Mix(购自美国ABI公司);TRIZOL(购自Invitrogen公司)。
1.2 方法
1.2.1 民猪CIRP基因的克隆
以GenBank上已公布的人CIRP基因序列(NM_001280)为源序列,使用BLAST在线软件进行相似序列搜索,找到一条猪的完整EST序列(AK235139),经反复比对后,初步认定为该EST序列即为猪的CIRP基因序列,据此共设计2对引物进行CDS全长序列的扩增,引物序列如下:CIRP1F: 5'GCCGTTGTGCTGTGCTGTCT 3', CIRP2R:5'TAGTCCCTGGAGCCGCCATA 3',预计扩增长度510 bp左右;CIRP3F:5'GCTCCAGGGACTACTA CAGC 3',CIRP4R:5'CCTTAGCCACTTCAAATA CAACAT 3',预计扩增长度800 bp。PCR扩增结束后使用胶回收试剂盒回收目的片段,连入T载体后,转化入大肠杆菌,过夜培养后,摇菌提质粒,送交北京华大生物公司测序。
1.2.2 生物信息学分析
用DNAMAN6.0和DNAStar7.0软件对所测得序列进行拼接和分析;用ProtParam tool软件进行氨基酸组成、等电点分析;利用用NCBI的Conserved Domains程序对蛋白的保守结构域进行预测;使用TMpred和TMHMM对蛋白质进行跨膜区分析;利用NetPhos 2.0 Server和NetPhosK 1.0 Server软件对蛋白质进行磷酸化位点的预测。
1.2.3 冷诱导后CIRP基因的表达变化
将常温组和低温组个体肌肉的cDNA分别混合,获得2个cDNA池,分别记为常温组和低温组。设计1对特异性引物用以Real-time PCR检测,选择β-actin基因作为看家基因,引物序列如下 : CIRP5F: 5'TGTTCCTGAGCGTAGCAT 3',CIRP6R: 5'TCCTTAGCCACTTCAAATA 3', actinF:5'CGGGACCTGACCGACTACCT 3',actinR:5'GG GCCGTGATCTCCTTCTG 3'。分别以这2个cDNA池为模板,采用二步法进行Real-time PCR扩增。反应体系如下:上、下游引物各0.8 μL,Mix 10 μL,模板0.8 μL,H2O 7.6 μL,共计20 μL。反应程序如下:95℃10 min,95℃30 sec,60℃1 min,40个循环。反应结束后,获得每个样本的Ct值,使用如下换算公式进行目的基因最终的相对定量结果:2-△△ct,其中ΔΔCt=(Ct,目的基因-Ct,管家基因)实验组-(Ct,目的基因-Ct,管家基因)对照组。
2 结果与分析
2.1 民猪CIRP基因序列分析
克隆测序获得了民猪CIRP基因的3个转录变异体,转录变异发生在编码区内。CIRP变异体1基因cDNA长1 278 bp(GenBank登录号:HQ 908794),其中包括93 bp的5'UTR区,519 bp完整的CDS编码区以及666 bp的3'UTR区,编码172个氨基酸,终止密码子为TAA。ORF由113个腺嘌呤(A)、191个鸟嘌呤(G)、98个胸腺嘧啶(T)和117个胞嘧啶(C)组成,四种碱基的含量依次为21.77%、36.80%、18.88%和22.55%,G、C(59.36%)含量高于A、T(40.65%)含量。
CIRP变异体2基因cDNA长1 653 bp(GenBank登录号:HQ908795),与变异体1相比,在其编码区的第501碱基处,出现了一段375 bp的插入片段,该插入片段的第46~48个碱基为TAG,使翻译提前终止,共编码182个氨基酸。ORF由115个腺嘌呤(A)、207个鸟嘌呤(G)、105个胸腺嘧啶(T)和122个胞嘧啶(C)组成,四种碱基的含量依次为20.95%、37.70%、19.13%和22.22%,G、C(59.92%)含量高于A、T(40.08%)含量。
CIRP变异体3长1 765 bp(GenBank登录号:HQ908796),与变异体2相比,在其编码区的第428碱基处,出现了一段115 bp的插入片段,该插入片段的第5~7个碱基为TGA,使翻译提前终止,共编码144个氨基酸。ORF由91个腺嘌呤(A)、164个鸟嘌呤(G)、86个胸腺嘧啶(T)和94个胞嘧啶(C)组成,四种碱基的含量依次为20.92%、37.70%、19.77%和21.61%,G、C(59.31%)含量高于A、T(40.69%)含量。3种转录变异体的核苷酸和氨基酸序列比对结果见图1和图2。

用NCBI的Conserved Domains程序(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测该蛋白的保守区域,结果发现在该基因的氨基端具有1个高度保守的RNA结合域(RNA recognition motif)。该保守区域由73个氨基酸组成(第7到第80位氨基酸),其中包含2个高度保守序列,分别为1个氨基酸六聚体(序列为LFVGGL,位置:第8到第13位氨基酸)和1个氨基酸八聚体(序列为RDFGFVTF,位置:第47到第54位氨基酸),其他一些疏水性氨基酸掺杂在这些保守序列中。使用TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)和 TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)在线软件分析,CIRP不存在跨膜结构域,初步认为冷诱导RNA结合蛋白应是一种存在于细胞质中的蛋白质。NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)预测 CIRP 三种转录蛋白的磷酸化位点结果如表1所示。使用在线软件NetPhosK 1.0 Server预测特异蛋白激酶的磷酸化位点,临界值设为0.6,预测结果显示,变异体1存在7个特异蛋白激酶的磷酸化位点(3个PKA,1个PKB,3个PKC),变异体2存在7个特异蛋白激酶的磷酸化位点(2个PKA,1个PKB,4个PKC),变异体3存在4个特异蛋白激酶的磷酸化位点(2个PKA,1个PKB,1个PKC)。

表1 NetPhos 2.0 Server软件预测CIRP蛋白的磷酸化位点Table 1 Prediction phosphorylation sites of CIRP protein by NetPhos 2.0 Server
2.2 冷诱导后CIRP基因表达变化结果
将常温组民猪的CIRP基因mRNA表达量设定为1,以相对表达水平的差异倍数为纵坐标,测得3个重复的CIRP基因mRNA动态表达水平见图3。t-test结果显示民猪的CIRP基因的mRNA水平经冷诱导后出现了显著的上升(P<0.05)。
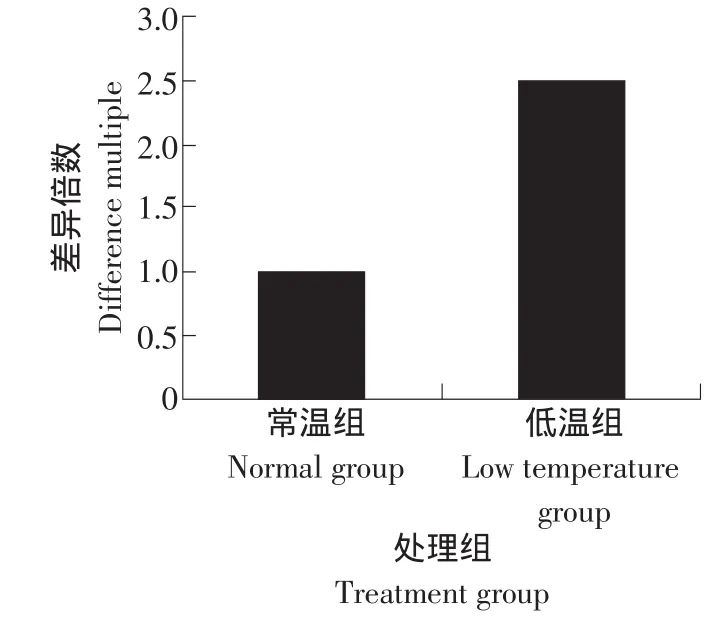
图3 冷诱导后CIRP基因表达变化结果Fig.3 Expression of CIRP gene after cold-induced
3 讨论与结论
温度降低可以降低组织器官的代谢率,并且对心、脑、肝脏等主要脏器功能有明显的保护作用,这种保护作用很可能是通过冷休克蛋白(Cold shock proteins,CSPs)在低温条件下的高表达来实现的,但具体是通过何种途径产生保护作用的机理目前仍不清楚,高等生物中CIRP和RBM3是研究相对较多的CSPs。CIRP广泛存在于植物、人类、小鼠、大鼠、非洲爪蟾、牛蛙、鲑鱼等生物体内,在神经系统发育、胚胎发育等许多进化过程中发挥重要的作用。但到目前为止,还没有见到关于猪的CIRP基因的相关报道。因此本研究以人的CIRP基因序列为源序列,BLAST比对后发现了一条已公布的完整的猪的EST序列,但按照此序列进行克隆测序后,竟发现3个转录变异体,它们在5'端高度保守,但在3'端出现较大变异,而且由于插入序列的存在,使得变异体2和变异体3均出现转录提前终止情况。这与Fageeh等在鼠上的研究结果略有不同[8],他们在扩增鼠的CIRP基因5'-UTR区时发现3个转录本,由于转录本长度的不同造成转录起始位点的改变,进而产生了3个转录变异体,而且3个转录变异体在不同温度下NIH-3T3细胞系的稳定性和活性均存在差异,据此推测CIRP表达受到不同长度的mRNA所调控。
冷应激对活体生物基因表达的影响少见报道,和细胞相比生物体具有更加复杂的冷应激调节机制,冷应激会对动物的生产性能[9]、免疫[10]、神经内分泌系统[11]均产生不同程度影响。已报道的关于温度变化对CIRP基因的表达影响结果基本一致,即高温会对该基因的表达产生抑制作用[12],而低温则可明显地诱导该基因的表达。本研究结果与前人的研究结果一致,即对民猪低温冷处理后,肌肉中CIRPmRNA的表达水平出现显著上升。“冷应激会上调CIRP基因的表达”这一结论已基本得到证实,但其上调表达的作用机理以及生物学意义仍是目前研究的热点。有人认为CIRP可能是通过激活细胞外信号调节激酶(Extracellular signalregulated kinase,ERK)信号通路来保护细胞免受低温伤害[12]。
本研究克隆获得了民猪CIRP基因的3种变异体,3种转录变异体的核苷酸序列同源性为86.45%,氨基酸序列同源性为87%。冷诱导后,CIRP基因在肌肉中的表达水平出现显著升高(P<0.05)。
[1] 李士泽,金福厚,赵巧香,等.冷诱导RNA结合蛋白的生物学功能研究进展[J].生理科学进展,2009,40(3):271-274.
[2] Nishiyama H,Itoh K,Kaneko Y,et a1.A glycine-rich RNA-binding protein mediating cold-inducible suppression of mammalian cell growth[J].J Cell Biol,1997,137:899-908.
[3] Saito T,Sugimoto K,Adachi Y,et al.Cloning and characterization of amphibian cold inducible RNA-binding protein[J].Biochem Physiol B Biochem Mol Biol,2000,125(2):237-245.
[4] Aoki K,Ishii Y,Matsumoto K,et a1.Methylation of Xenopus CIRP2 regulates its arginine and glycine-rich region·mediated nucleocytoplasmie distribution[J].Nucleic Acids Res,2002,27:5182-5192.
[5] Banks S,King SA,Irvine DS,et a1.Impact of a mild scrotal heat stress on DNA integrity in murine spermatozoa[J].Reproduction,2005,126:505-514.
[6] 薛菁晖,张志文,李安民,等.冷诱导RNA结合蛋白(CIRP)在脑缺血时的表达[C].中国医师协会神经外科医师分会首届全国代表大会论文集,2005.
[7] 赵巧香,张秀玲,纪丽丽,等.重组BALB/C鼠冷诱导RNA结合蛋白CIRP多克隆抗体的制备与鉴定[J].应用与环境生物学报,2009,15(5):634-637.
[8] Al-Fageeh MB,Smales CM.Cold-inducible RNA binding protein(CIRP)expression is modulated by alternative mRNAs[J].RNA,2009,15(6):1164-1176.
[9] 乔岩瑞.冷应激对猪生产性能的影响[J].饲料广角,2004(3):23-26.
[10] 李瑞刚.冷应激对小鼠免疫系统的影响[D].呼和浩特:内蒙古农业大学,2005.
[11] 屠云洁,耿照玉,陈国宏,等.冷应激对家禽神经内分泌系统的影响[J].安徽农业科学,2009,37(24):11555-11557.
[12] Sakurai T,Itoh K,Higashitsuji H,et al.Cirp protects against tumor necrosis factor-alpha-induced apoptosis via activation of extracellular signal-regulated kinase[J].Biochim Biophys Acta.,2006,1763(3):290-295.
